2. 天津市工业生物系统与过程工程重点实验室 中国科学院天津工业生物技术研究所,天津 300308;
3.黄山中科新佳生物科技有限公司,黄山 245000;
4.黄山市徽州区农业委员会,黄山 245061
2. Tianjin Key Laboratory for Industrial Biological Systems and Bioprocessing Engineering,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308;
3. Huangshan Zhongke Xinjia Biological Technology Co.,Ltd.,Huangshan 245000;
4. Commission of Agriculture in Huizhou District of Huangshan City,Huangshan 245061
土壤中的磷是植物生长发育必需的营养元素,然而约95%以上的磷以不能被植物吸收的形式存在于土壤中。因此,磷成为限制作物生长和产量的主要元素之一。磷肥的当季利用率低于25%,肥料中70%以上的水溶性磷与土壤中的Ca2+、Fe3+、Al3+等结合,转化为难溶性磷酸盐[1]。我国约有74%的耕地土壤缺磷,为了减缓磷匮乏对植物生长的影响,农业生产上主要依靠施用磷肥来增加磷素供应[2]。近年来对磷肥的需求量越来越大,每年都有过量的磷肥施入可耕地中。过量磷肥的施用不仅会造成严重的经济损失,还会造成土壤板结、水污染等,因此急需发展化学磷肥的可替代产品。解磷菌是一类能够溶解土壤中的不溶性磷,并能通过产胞外酶和有机酸来刺激植物的生长的土壤微生物[3, 4],在土壤中,解磷菌的施用可提高土壤中磷的利用率,从而减少磷化肥的使用量[5]。故从环境中分离筛选高效解磷菌,研制微生物解磷菌肥对调节土壤中磷的供需矛盾具有重要意义。
早在1908年,Goldstein[6]在植物根际发现了解磷菌,迄今为止,已有很多学者对解磷菌的筛选做了大量工作,筛选到的解磷菌分属不同的种类,包括勒克氏菌属、肠杆菌属、芽孢杆菌属、假单胞菌属、克雷伯氏菌属和节杆菌属等。解磷菌的解磷作用普遍被认为是由其生长过程中的代谢产物决定的,代谢产物包括有机酸、质子和多糖等。有机酸通过羟基和羧基对不溶性磷酸盐进行螯合使其溶解;质子通过降低周围的pH来溶解不溶性磷酸盐;多糖可通过与有机酸的协同效应来推动不溶性磷酸盐的溶解。近年来,解磷菌的应用成为国内外研究的热点,其在小麦、玉米等植物上的应用已有诸多报道[7],但是解磷菌在黄瓜的应用却鲜有报道。
本研究从土壤中筛选出对黄瓜苗有促生作用的高效解磷菌,并对其促生机制进行初步研究。
1 材料与方法 1.1 材料 1.1.1 土壤样品本研究筛菌所用采用的土壤来自辽宁鞍山葡萄根际土、辽宁鞍山葡萄根周土、辽宁鞍山茄子根际土、辽宁鞍山茄子根周土、安徽黄山土壤和天津草坪根际土。
1.1.2 培养基无机磷培养基:NaCl 0.3 g,MgSO4·7H2O 0.3 g,KCl 0.3 g,(NH4)2SO4 0.5 g,FeSO4·7H2O 0.003 g,MnSO4·4H2O 0.003 g,Ca3(PO4)2 5.0 g,葡萄糖10 g,琼脂18 g,蒸馏水1 L,pH7.0-7.5[8]。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂18 g,蒸馏水1 L,pH7.4-7.6。
阿须贝固氮菌培养基:KH2PO4 0.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO3 5.0 g,甘露醇10.0 g,CaSO4·2H2O 0.1 g,琼脂粉18-20 g,蒸馏水1 L,pH7.0[9]。
解钾培养基:Na2HPO4 2.0 g,MgSO4·7H2O 0.5 g,FeCl3 0.005 g,CaCO3 0.1 g,蔗糖5.0 g,钾长石粉1.0 g,琼脂粉15-20 g,pH7.0-7.5,蒸馏水1 L[10]。
Salkowski’s反应液:12 mg/L FeCl3,7.9 mol/L H2SO4,加蒸馏水至1 L[11]。
CAS(铬天青)检测平板的配制:每100 mL含20%蔗糖溶液1 mL,10 %酸水解酪素3 mL,1 mmol/L CaCl2 100 μL,1 mmol/L MgSO4 2 mL,琼脂 1.8 g。在60℃时缓慢加入0.1 mol/L磷酸盐缓冲液和CAS染液各5 mL,混合均匀即得蓝色检测平板。
CAS染液配制:1 mmol/L CAS,0.1 mmol/L FeCl3,4 mmol/L十六烷基三甲基溴化胺(HDTMA),0.1 mol/L磷酸盐缓冲液,pH6.8(每100 mL含Na2HPO4·12H2O 2.427 g,NaH2PO4·2H2O 0.590 5 g,KH2PO4 0.075 g,NH4Cl 0.250 g,NaCl 0.125 g,使用时10倍稀释)[12]。
1.2 方法 1.2.1 解磷菌的分离与筛选称取1 g土壤样品,置于9 mL无菌水中高速震荡制成土壤菌悬液,将梯度稀释的土壤悬液涂布在无机磷固体培养基上,倒置于生化培养箱中30℃培养3 d。挑取平板上透明圈较明显的菌落在无机磷固体培养基上进行重复划线分离纯化。将分离纯化的纯菌菌落转至牛肉膏蛋白胨斜面培养基上进行4℃保存。将分离纯化的纯菌菌液浸湿滤纸片,并放置在无机磷固体培养基平板上,对其解磷能力进行验证。
1.2.2 解磷菌解磷能力和pH测定及分析将初筛的解磷菌在牛肉膏蛋白胨液体培养基中30℃,180 r/min过夜培养。用牛肉膏蛋白胨液体培养基将菌浓度稀释至1×108个/mL,以10%接种量接入无机磷液体培养基中。以接入10%牛肉膏蛋白胨培养基作为对照,每个处理设3个重复。30℃,180 r/min在摇床上培养4 d后,将发酵液10 000 r/min离心10 min,取上清在波长690 nm下,采用钼锑抗比色法测定上清液中可溶性磷含量[13]。用pH计对发酵液进行pH进行检测。
利用SPSS 17.0中的皮尔逊相关分析对解磷菌的解磷能力和pH进行相关性分析。
1.2.3 盆栽实验选取辽宁鞍山土壤作为供试土壤,土壤性质:pH6.8;有机质 2.35%;总氮142 mg/kg;总磷107 mg/kg;总钾310 mg/kg;速效氮147 mg/kg;有效磷6 mg/kg;有效钾376 mg/kg。
将供试土壤在阴凉避光处晾干,过1 mm筛。每200 g土壤与1.1 g磷酸三钙混匀。供试植株采用黄瓜中农8号。将黄瓜种子育种7 d后,选取大小一致的植株作为实验植株。
将所筛到的解磷菌进行盆栽实验,以此筛选出对植物有促生作用的高效解磷菌。每200 g供试土壤装入直径为8 cm的花盆中,每个盆中种植1株黄瓜苗。将在牛肉膏蛋白胨中培养24 h的27株解磷菌进行菌体收集,用无菌生理盐水稀释至1×108个/mL。取20 mL菌悬液添加到黄瓜根际,20 mL生理盐水作为对照,每个处理3个重复。
将黄瓜放置于人工气候培养箱中进行培养(28℃,14 h光照,12℃,16 h无光照),并进行统一管理(每48 h浇水30 mL),培养20 d。实验结束后,对黄瓜苗株高、鲜重和干重进行测量。
1.2.4 解磷菌的促生机制研究 1.2.4.1 解磷机制研究将在牛肉膏蛋白胨液体培养基中生长24 h的解磷菌,用生理盐水将制成菌悬液(菌数约1×108个/mL),以10%的接种量接种到无机磷液体培养基中,30℃摇床培养(200 r/min)96 h,每12 h取样一次;发酵液中菌数利用细菌计数板进行计数;发酵液pH用pH计进行测量;取10 mL发酵液在12 000 r/min进行离心10 min,采用钼锑抗比色法测定上清液中可溶性磷含量;上清液经0.22 μm滤膜进行过滤,利用津岛LC-20A高效液相色谱仪对有机酸进行分析(色谱柱为美国Bio-Rad的HPX-87H,进样器为SIL-20AC,紫外检测器为SPD-20A,进样器为SIL-20AC,柱温箱为CTO-20AC,泵为LC-20AD)。色谱分离条件:柱温为60℃;流动相为0.5 mmol/L的H2SO4;流速为0.6 mL/min;进样量10 μL;紫外检测波长为215 nm。
利用SPSS 17.0中的皮尔逊相关分析对发酵液中菌数、pH、可溶性磷和有机酸进行相关性分析。
1.2.4.2 盆栽土壤的磷组分分析针对盆栽实验,每4 d取盆中土样一次,每次3个重复,在阴凉处阴干,过筛(100目)后,用钼锑抗比色法对土壤有效磷进行测定[14],用土壤总磷试剂盒(苏州科铭生物有限公司)对土壤全磷进行测定。
利用SPSS 17.0中的配对T检验对盆栽土壤中有效磷、总磷和有效磷与总磷比值进行显著性分析。
1.2.4.3 3-吲哚乙酸的测定将解磷菌接到King培养基[15]中,30℃,200 r/min摇床培养24 h。取3 mL的菌液12 000 r/min离心15 min,去沉淀。取1 mL的上清夜加入2 mL的Salkowski’s 反应液。在暗处混合反应30 min后,观察其变色情况,颜色变为粉红色,则视其产3-吲哚乙酸,颜色越深表示分泌3-吲哚乙酸的能力越强;不变色即为不产3-吲哚乙酸。
1.2.4.4 铁载体的检测将解磷菌在牛肉膏蛋白胨液体培养基中摇床培养24 h,吸取2 μL菌液点在CAS平板上,30℃培养3 d,观察其菌落周围是否有橙黄色透明圈。
1.2.4.5 固氮能力的检测从无机磷培养基平板上挑取解磷菌菌落,用无菌水制成菌悬液,取5 μL菌悬液点在阿须贝固体培养基上,来检测其是否有固氮能力。
1.2.4.6 解钾能力的检测从无机磷培养基平板上挑取解磷菌落,用无菌水制成菌悬液,取5 μL菌悬液点在解钾固体培养基上,检测其解钾能力。
1.2.5 高效解磷促生菌16S rDNA的测定使用细菌总DNA提取试剂盒提取高效解磷促生菌的DNA。利用PCR对16S rRNA基因片段进行扩增。50 μL反应体系中包括1 μL DNA模板,1 μL上游引物27F,1 μL下游引物1492R[16],25 μL PCR Master-Mix(2×),19 μL无菌水。扩增条件为:94℃预变性3 min;94℃变性45 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃终延伸10 min。将PCR产物在金维智进行测序。将测序得到的菌株16S rRNA基因序列在NCBI数据库中进行BLAST比对和分析。
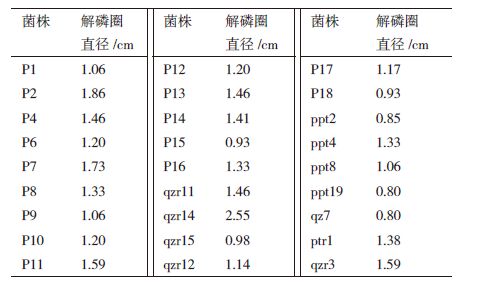
2 结果 2.1 解磷菌的筛选利用无机磷培养基平板法从土壤样品中筛选到68个菌株。在无机磷培养基平板上,经反复划线培养后,得到27株溶磷能力较强且可稳定遗传的解磷菌,由表 1可见,27株解磷菌的溶磷圈直径在0.80-2.55 cm,其中分离自鞍山茄子根际土的菌株qzr14的解磷圈最明显,直径为2.55 cm。
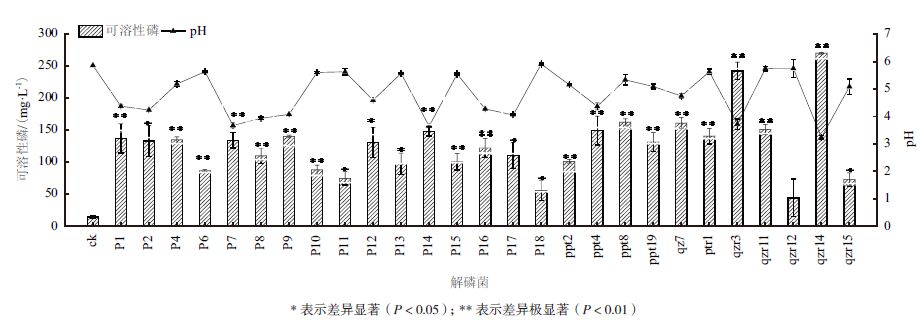
将筛选到的27株解磷菌在无机磷液体培养基中摇床培养4 d后,发现除qzr12外其余26株解磷菌发酵液中可溶性磷浓度均显著高于对照(14.9 mg/L)(P<0.05),介于44.4-270.0 mg/L范围内(图 1)。菌株qzr14的解磷能力最高,发酵液上清中可溶性磷浓度为270 mg/L,约是对照组的18倍。菌株qzr12的解磷能力最低,发酵液上清中可溶性磷浓度仅为44.4 mg/L。27株解磷菌发酵液的pH均低于对照,介于3.2-5.9,菌株qzr14的pH最低,为3.2。菌株P18的pH最高,为5.9。
|
| 图 1 解磷菌液体培养基中的解磷能力和pH |
对27株解磷菌发酵液的溶磷能力和pH值进行相关性分析,发现pH与溶磷量存在显著的负相关性(r= -0.671,P<0.01),但溶磷量和pH之间没有线性关系(图 2)。如解磷菌qzr11的发酵液pH为5.7,发酵液上清中可溶性磷浓度为151.0 mg/L,解磷菌qzr12的发酵液pH为5.7,而发酵液上清中可溶性磷浓度为44.4 mg/L。即pH相近时,不同菌株的溶磷能力相差较大。
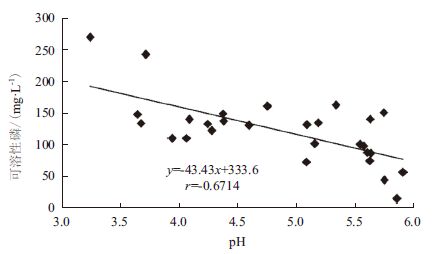
|
| 图 2 解磷菌解磷能力和pH 值相关性 |
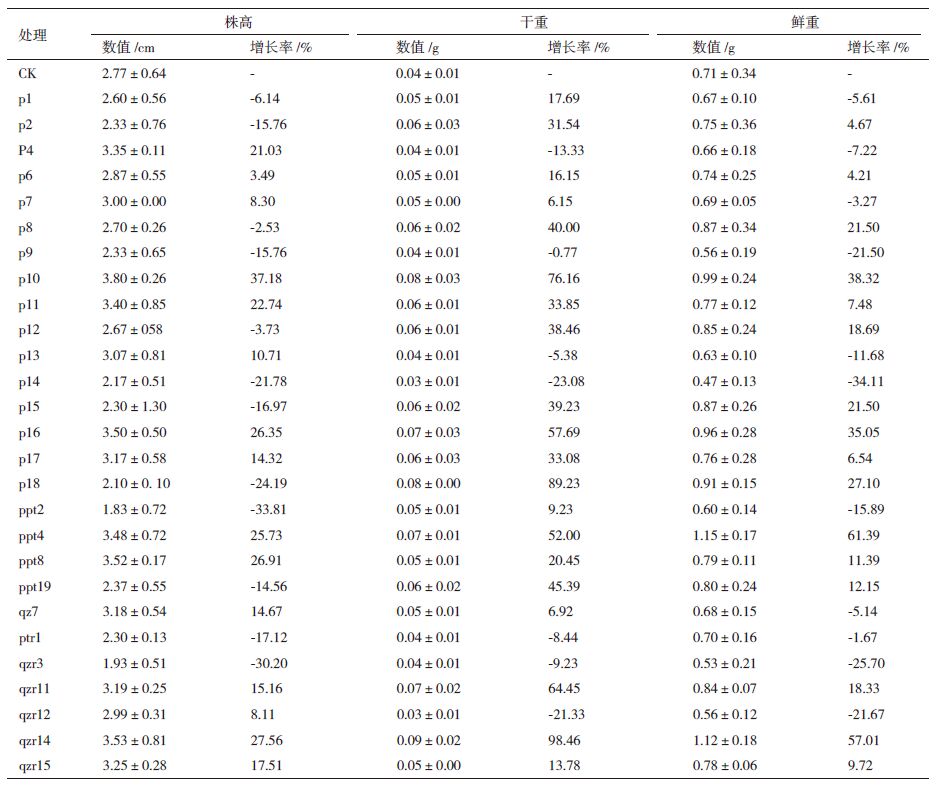
将筛选到的27株解磷菌作用于黄瓜苗,培养20 d后,测量黄瓜苗的株高、干重和鲜重,结果(表 2)显示,通过与对照相比,发现有15株解磷菌对黄瓜苗的株高有促生作用(3.49%-37.18%),其中p10对黄瓜苗的株高促生效果最明显,可提高株高37.18%;有20株菌对黄瓜苗干重有促生作用(6.15%-98.46%),其中qzr14对黄瓜苗的干重提高效果最明显为98.46%;有16株菌对黄瓜苗鲜重有促生作用(4.21%-61.39%),其中ppt4对黄瓜苗的鲜重提高效果最明显为61.39%。菌株qzr14对株高、干重和鲜重的增长率分别为27.71%、98.46%和57.01%。通过对黄瓜苗的株高、干重和鲜重数据的综合分析,发现菌株qzr14对黄瓜苗的促生作用优于其他菌株。
通过对高效促生解磷菌qzr14发酵液中菌数的监测,发现0-24 h解磷菌处于对数生长期,菌数快速增加到1.40×1010个/mL;24-36 h菌数小幅度下降到1.09×109个/mL;36 h之后,菌数维持在5.54×108-1.09×109个/mL。通过对发酵液中有机酸进行实时监测,发现该菌在发酵液中分泌的有机酸以葡糖酸为主,12-36 h葡糖酸的产量快速增加到1.72 g/L;36-96 h,葡糖酸的产量在1.03-1.78 g/L内波动,且从36 h开始有少量甲酸的分泌,96 h分泌微量的乙酸。发酵液pH在0-24 h从6.0快速下降到3.6,在24-60 h从3.6缓慢下降到3.2,60 h后一直维持在3.2。发酵液中的可溶性磷在0-24小时快速增加到247.07 mg/L,36-96 h可溶性磷缓慢上升至265.08 mg/L(图 3)。通过相关性分析发现溶磷量与pH(r= -0.977,P<0.01)、菌数(r=0.806,P<0.01)和葡糖酸(r=0.759,P<0.05)均有显著相关性。

|
| 图 3 解磷菌qzr14 的解磷机制 |
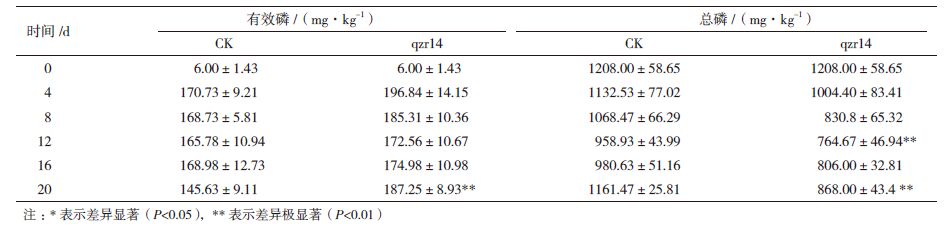
对高效促生解磷菌qzr14的促生机制进行研究。在黄瓜苗生长的20 d内,对土壤中磷组分进行实时监测,结果(表 3,图 4)表明,接种qzr14 4 d后,接种qzr14的土壤中有效磷含量(172.56-196.84 mg/kg)均高于对照(145.63-170.73 mg/kg);接种qzr14的土壤中总磷含量(764.67-1004.4 mg/kg)均低于对照(958.93-1161.47 mg/kg);解磷菌qzr14处理的盆栽土壤中有效磷占总磷的百分比(19.62%-22.57%)始终显著(P < 0.05)高于空白对照(12.53%-17.35%)。与对照相比,经qzr14处理的盆栽土壤中总磷减少,有效磷增多,比值增高,说明qzr14可溶解土壤中的不溶性磷,促进植株对有效磷的吸收。

|
| 图 4 有效磷占总磷的比值变化 |
解磷菌qzr14的发酵液与Salkowski’s 反应液反应后未变色,说明该菌不产3-吲哚乙酸。解磷菌qzr14在CAS平板上形成的菌落周围无黄色晕圈,表明该菌不产铁载体。在阿须贝固体培养基和解钾固体培养基上,qzr14均能生长(图 5),说明该菌有固氮和解钾的能力。

|
| 图 5 解磷菌qzr14 的促生机制 |
将测序结果在NCBI中进行BLAST,结果表明解磷菌qzr14与葡糖醋杆菌Gluconacetobacter sp.相似度为99%。解磷菌qzr14在无机磷平板上的菌落形态呈白色,不透明,表面光滑。显微镜下观察解磷菌qzr14细胞呈短杆状,与文献[17]中描述相似。因此初步鉴定解磷菌qzr14为葡糖醋杆菌属,故命名为葡糖醋杆菌qzr14。
3 讨论国内外已有较多关于解磷菌筛选的报道,解磷菌的解磷能力一般在31.5-519.7 mg/L范围内,多为芽孢杆菌和假单胞菌,其中一株节杆菌属细菌解磷能力最高(519.7 mg/L)[18, 19]。在已报道文献中,葡糖醋杆菌培养14 d后解磷能力最高可达323.0 mg/L[20]。本研究从环境中筛选到27株解磷菌,其中葡糖醋杆菌qzr14解磷能力最高,为270.3 mg/L,在已发现的解磷菌中居中等水平。葡糖醋杆菌较多的应用在食品发酵和医药中[17]。1989年,Gillis等[21]发现了固氮葡糖醋杆菌的固氮功能,随后发现其还具有解磷(解磷圈直径25-31 mm)、分泌激素、拮抗病原菌等能力,近年来该菌作为固氮微生物已被广泛应用,并对甘蔗苗、 豇豆等具有较好的促生效果[22]。除固氮葡糖醋杆菌外,其他葡糖醋杆菌促生机制的研究还鲜有报道。
溶磷菌普遍被认为主要通过分泌有机酸、质子和多糖等机制溶解不溶性磷。不同解磷菌的解磷机制不同,有些菌通过其中的一种机制,有些菌通过多种机制导致磷矿粉的溶解[23]。解磷菌对不溶性磷的溶解往往伴随着发酵液中pH的降低。本研究发现27株解磷菌的发酵液中溶磷量和pH值有显著的负相关性,说明培养基酸度的升高在溶磷中发挥着重要的作用,但是溶磷量和pH值不成线性关系,说明解磷菌的溶磷作用还可能与有机酸种类和多糖等有关。赵小蓉等[24]研究结果也表明培养介质酸度升高是溶解磷矿粉的重要条件。本研究通过对葡糖醋杆菌qzr14的解磷机制研究发现,该菌的解磷能力与pH相关性接近1,说明pH的降低是葡糖醋杆菌qzr14溶磷的主要原因。葡糖醋杆菌qzr14的解磷能力还与菌数和葡糖酸显著相关。随着菌数的上升,葡萄酸产量也明显提高,pH显著降低,解磷量明显增加,说明pH、菌数和葡糖酸在溶磷过程中均发挥着重要的作用。葡糖酸是微生物解磷过程中分泌的常见的有机酸之一[25, 26]。葡糖酸在摇瓶中可直接溶解不溶性磷[27],Hameeda等[28]的研究也表明葡糖酸和微生物的解磷能力存在正相关性。本研究结果还表明解磷菌数量与解磷能力存在显著正相关性。Chen等[29]的研究也证明解磷菌生长速率、活性等和解磷能力密切相关。因此推断葡糖醋杆菌qzr14的数量在解磷过程中发挥着尤为重要的作用,可能是其解磷的必要条件。
关于解磷菌对小麦的促生作用已有较多报道,其中Schoebitz[30]的研究表明荧光假单胞菌的解磷能力高于沙雷氏菌,但对小麦的促生作用却低于沙雷氏菌。本研究通过分析27株解磷菌对黄瓜苗的促生作用也发现解磷菌的解磷能力和其对植物的促生作用没有必然联系。这可能是因为(1)受环境因素的影响,不同解磷菌在土壤中的定殖能力和溶磷能力不同,从而造成其对植物提供的速效磷不同;(2)不同的解磷菌对土壤中微生物群落的影响不同,造成植物生长的微生态环境不同;(3)一些解磷菌不但可通过提供较多的有效磷及金属元素,而且还可通过产生生物素、铁载体、HCN等物质促生植物生长[31]。齐海季等[32]的研究表明,土壤速效磷含量在213 mg/kg时对黄瓜苗仍有显著的促生作用。本研究筛选到的葡糖醋杆菌qzr14与对照相比,可使土壤中总磷量减少,有效磷增多,有效磷占总磷的比例提高,并可显著提高黄瓜苗的鲜重、干重和株高。本研究筛选到的葡糖醋杆菌qzr14与对照相比,可使土壤中总磷量减少,有效磷增多,有效磷占总磷的比例提高,并可显著提高黄瓜苗的鲜重、干重和株高,说明葡糖醋杆菌qzr14可将土壤中不溶性磷转化为有效磷,为植物提供充足的磷及其他营养元素,从而促进黄瓜苗的生长。葡糖醋杆菌qzr14在平板上具有固氮和解钾能力,说明葡糖醋杆菌qzr14还可能通过固氮和解钾作用促进黄瓜苗生长,但这有待于我们进一步的研究和证明。
4 结论从环境中筛选到27株解磷菌,其中葡糖醋杆菌qzr14解磷能力最高(270 mg/L)。葡糖醋杆菌qzr14对黄瓜苗具有较好的促生效果,与对照相比,可提高黄瓜苗干重98.46%,鲜重57.01%,株高27.71%。葡糖醋杆菌qzr14可能主要通过分泌葡糖酸分解土壤不溶性磷,提高黄瓜苗对有效磷的吸收,促进黄瓜苗生长。葡糖醋杆菌qzr14还可能通过固氮和解钾作用促进黄瓜苗生长。
| [1] | 鲁如坤. 土壤植物营养学原理和施肥[M]. 北京:化学工业出版社, 1998:152-157. |
| [2] | 鲁如坤, 时正元. 土壤积累态磷研究—Ⅱ. 磷肥的表观积累利用率[J]. 土壤, 1995, 27(6):286-289. |
| [3] | Tripura C, Sashidhar B, Podile AR. Ethyl methane sulfonate mutage-nesis-enhanced mineral phosphate solubilization by groundnut-asso-ciated Serratia marcescens GPS-5[J]. Current Microbiology, 2007, 54(2):79-84. |
| [4] | Reyes I, Valery A, Valduz Z. Phosphate-solubilizing microorganisms isolated from rhizospheric and bulk soils of colonizer plants at an abandoned rock phosphate mine[C]. First international meeting on microbial phosphate solubilization. Springer Netherlands, 2007:69-75. |
| [5] | Illmer P, Schinner F. Solubilization of inorganic phosphates by microorganisms isolated from forest soils[J]. Soil Biology and Biochemistry, 1992, 24(4):389-395. |
| [6] | Goldstein AH. Bacterial solubilization of mineral phosphates:historical perspective and future prospects[J]. American Journal of Alternative Agriculture, 1986, 1(2):51-57. |
| [7] | Liu FP, Liu H Q, Zhou HL, et al. Isolation and characterization of phosphate-solubilizing bacteria from betel nut(Areca catechu)and their effects on plant growth and phosphorus mobilization in tropical soils[J]. Biology and Fertility of Soils, 2041, 50:927-937. |
| [8] | Jiao R, Peng Y. Preliminary Study on Phosphate Solubilization and K-releasing Abilities of Rhizobium tropici Martinez-Romero et al. Strains from Woody Legumes[C]//Proceedings of the 19th World Congress of Soil Science:Soil solutions for a changing world, Brisbane, Australia, 1-6 August 2010. International Union of Soil Sciences(IUSS), c/o Institut für Bodenforschung, Universität für Bodenkultur, 2010:104-107. |
| [9] | 吴翔, 甘炳成, 贾定洪, 等. 一株自生固氮细菌的分离和鉴定[J]. 西南农业学报, 2013(1):255-258. |
| [10] | 别运清, 胡正嘉. 硅酸盐细菌几种功能的研究[J]. 襄樊职业技术学院学报, 2002, 1(1):12-15. |
| [11] | Piromyou P, Buranabanyat B, Tantasawat P, et al. Effect of plant growth promoting rhizobacteria(PGPR)inoculation on microbial community structure in rhizosphere of forage corn cultivated in Thailand[J]. European Journal of Soil Biology, 2011, 47(1):44-54. |
| [12] | 荣良燕, 姚拓, 赵桂琴, 等. 产铁载体PGPR菌筛选及其对病原菌的拮抗作用[J]. 植物保护, 2011, 37(1):59-64. |
| [13] | 南京农业大学. 土壤农化分析[M]. 第2 版. 北京:中国农业出版社, 1996:311-312. |
| [14] | 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国土壤学会:中国农业科技出版社, 2000:179-183. |
| [15] | 姚拓. 高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J]. 草业学报, 2004, 13(3):85-90. |
| [16] | Hu XJ, Li ZJ, Cao YC, et al. Isolation and identification of a phosphate-solubilizing bacterium Pantoea stewartii subsp. stewartii g6, and effects of temperature, salinity, and pH on its growth under indoor culture conditions[J]. Aquaculture International, 2010, 18(6):1079-1091. |
| [17] | 冯静, 施庆珊, 欧阳友生, 等. 葡糖醋杆菌的研究进展[J]. 化学与生物工程, 2009, 26(5):10-13. |
| [18] | Chen YP, Rekha PD, Arun AB, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Applied Soil Ecology, 2006, 34(1):33-41. |
| [19] | Park JH, Bolan N, Megharaj M, et al. Isolation of phosphate solubi-lizing bacteria and their potential for lead immobilization in soil[J]. Journal of Hazardous Materials, 2011, 185(2):829-836. |
| [20] | Linu MS, Stephen J, Jisha MS. Phosphate Solubilizing Gluconacet-obacter sp., Burkholderia sp. and their Potential Interaction with Cowpea(Vigna unguiculata(L. )Walp. )[J]. International Journal of Agricultural Research, 2009, 4(2):79-87. |
| [21] | Gillis M, Kersters K, Hoste B, et al. Acetobacter diazotrophicus sp. nov., a nitrogen-fixing acetic acid bacterium associated with sugar-cane[J]. International Journal of Systematic Bacteriology, 1989, 39(3):361-364. |
| [22] | Muthukumarasamy R, Govindarajan M, Vadivelu M, et al. N-fertil-izer saving by the inoculation of Gluconacetobacter diazotrophicus and Herbaspirillum sp. in micropropagated sugarcane plants[J]. Microbiological Research, 2006, 161(3):238-245. |
| [23] | 吴海燕, 金荣德, 范作伟, 等. 解磷巨大芽孢杆菌(Bacillusm-egaterium)的溶磷机理探讨[J]. 吉林农业大学学报, 2014, 36(2):171-175. |
| [24] | 赵小蓉, 林启美, 李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J]. 微生物学杂志, 2003, 23(3):5-7. |
| [25] | Deubel A, Gransee A, Merbach W. Transformation of organic rhizodeposits by rhizoplane bacteria and its influence on the availability of tertiary calcium phosphate[J]. Journal of Plant Nutrition and Soil Science, 2000, 163:387-392. |
| [26] | Goldstein AH. Recent progress in understanding the molecular genetics and biochemistry of calcium phosphate solubilization by gram negative bacteria[J]. Biological Agriculture & Horticulture, 1995, 12(2):185-193. |
| [27] | Rodriguez H, Gonzalez T, Goire I, et al. Gluconic acid production and phosphate solubilization by the plant growth-promoting bacterium Azospirillum spp[J]. Naturwissenschaften, 2004, 91(11):552-555. |
| [28] | Hameeda B, Reddy Y H K, Rupela O P, et al. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna[J]. Current Microbiology, 2006, 53(4):298-302. |
| [29] | Chen Z, Ma S, Liu LL. Studies on phosphorus solubilizing activity of a strain of phosphobacteria isolated from chestnut type soil in China[J]. Bioresource Technology, 2008, 99(14):6702-6707. |
| [30] | Schoebitz M, Ceballos C, Ciamp L. Effect of immobilized phosphate solubilizing bacteria on wheat growth and phosphate uptake[J]. Journal of Soil Science and Plant Nutrition, 2013, 13(1):1-10. |
| [31] | 邵玉芳, 樊明寿, 乌恩, 等. 植物根际解磷细菌与植物生长发育[J]. 中国农学通报, 2007, 23(4):241-244. |
| [32] | 齐海季, 梁林洲, 赵学强, 等. 土壤磷含量对黄瓜幼苗生长和磷素吸收的影响[J]. 江苏农业科学, 2012, 40(1):152-154. |