2.深圳市绿微康生物工程有限公司,深圳 518055;
3.香港城市大学能源与环境学院,香港
2. Shenzhen Leveking Bio-engineening Co.,LTD,Guangdong Shenzhen 518055;
3. School of Energy and Environment,City University of Hong Kong,Hong Kong
脂肪酶(lipase,EC.3.1.1.3)又称为三酰基甘油酰基水解酶(triacylglycerol acylhydrolase)是一类特殊的酯键水解酶,可以催化三酰甘油酯及其它一些水不溶性酯类的水解、醇解、酯化、转酯化及酯类的逆向合成反应[1, 2, 3, 4]。脂肪酶是动物体内脂肪代谢的关键酶,被广泛应用于饲料添加、洗涤业、油脂改良、食品加工等诸多领域,是一种有较大开发价值和应用前景的多功能生物催化剂[5, 6]。目前,脂肪酶的工业制备主要采用微生物发酵的方法。黑曲霉(Aspergillus niger)是一种工业上重要的微生物,被广泛用于生产脂肪酶、纤维素酶、木聚糖酶等30多种酶制剂,且被美国FDA认定为GRAS(通常认为是安全的)菌株,其发酵产生的脂肪酶产品可以作为药品、食品和饲料的辅料及添加剂等[7, 8]。应用黑曲霉进行脂肪酶生产的另一优势是,黑曲霉能够将脂肪酶分泌到发酵液中,从而降低下游纯化成本[9]。目前,运用工业育种技术、培养基和发酵条件优化改良等方法进行提高菌种产量,降低发酵成本,是实现节能减排、提高企业竞争力的重要手段之一[10]。
响应面分析方法(Response surface methodology,RSM)是采用多元二次回归方程来拟合因素与响应值之间的函数关系,通过对函数响应面和等高线的分析,能够精确地研究各因子与响应值之间的关系,寻求最优工艺参数,解决多变量问题的一种统计方法。而Box-Behnken Design(BBD)是RSM常用的实验设计方法之一,是以较少的试验次数获得最有效、最经济试验设计和因素优化的方法,并且适用于摇瓶实验[11, 12]。近年来,RSM方法广泛应用于各种微生物发酵不同品种的培养基、培养条件及发酵工艺的优化设计中[5, 12, 13, 14]。
本文针对于产脂肪酶黑曲霉A. niger G62s菌株的摇瓶发酵条件进行优化研究,采用单因素方法考察影响菌株发酵及产酶特性的接种量、摇瓶装量、培养温度、培养时间等条件,在此基础上采用RSM对于4个主要影响产酶因素进行优化,以提高菌株产脂肪酶的能力。
1 材料与方法 1.1 材料 1.1.1 菌株来源黑曲霉A. niger为深圳绿微康生物工程有限公司提供的生产菌株,该菌株现保藏于公司酶制剂研究中心,保藏号:A. niger G62s。
1.1.2 试剂和仪器主要试剂 酵母膏、蛋白胨、葡萄糖、玉米淀粉、豆粕、无机盐、琼脂等培养基所用试剂均为国产化学级试剂,蛋白Marker为美国thermo公司产品,脂肪酶分析所用试剂为分析级试剂。仪器 净化工作台,苏州净化设备厂;PHS-25型酸度计,杭州科晓化工仪器设备有限公司;Avanti J-30I型高效离心机,美国贝克曼库尔特有限公司;TS-3112型双层大容量摇床,上海仪纯实业有限公司;JY600凝胶电泳仪,北京君意东方电泳设备有限公司。
1.1.3 培养基斜面培养基(YPD)酵母膏10 g,蛋白胨20 g,葡萄糖20 g,琼脂 15 g,蒸馏水定容至1 000 mL,pH7.0。种子培养基 葡萄糖 30 g,NaNO3 7 g,NaH2PO4 0.5 g,K2SO4 0.1 g,蒸馏水定容至1 000 mL,pH 7.2。发酵培养基 葡萄糖 20 g,玉米淀粉 10 g,豆粕 30 g,橄榄油 5 g,NaNO3 10 g,NaH2PO4 2 g,K2SO4 0.2 g,CaCO3 5 g,蒸馏水定容至1 000 mL,pH7.2。
1.2 方法 1.2.1 菌株培养方法斜面种子培养方法:将- 80℃保藏的菌株冷冻管,用接种针取1环均匀涂布于斜面培养基表面,于30℃恒温静置培养7 d,制备成斜面种子,于3-5℃冰箱保存备用。摇瓶种子培养方法:将斜面种子用接种针取1环接种于装有30 mL种子培养基的250 mL摇瓶中,于30℃恒温220 r/min振荡培养20-32 h,见培养液浑浊,OD600值为0.24-0.5,得到摇瓶种子液备用。摇瓶发酵方法:选用500 mL摇瓶,发酵培养基装量为50 mL。摇瓶接种量按照装量的1.5%进行转种。培养温度为30℃恒温培养,220 r/min振荡培养,发酵培养时间66 h。培养好的发酵液在10 000 r/min,4℃低温下离心10 min,取上清液检测脂肪酶活性。
1.2.2 单因素实验方法在摇瓶中分别对于发酵过程的接种量、摇瓶装量、培养时间、培养温度等进行单因素实验,筛选出对酶活性影响较为显著的因素和合理的取值范围。
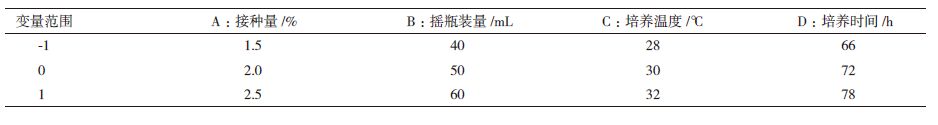
1.2.3 RSM方法采用“Design-Expert 8.0”软件,以脂肪酶活性为响应值,对单因素实验得到的较为显著的影响因素进行RSM设计(表 1)。采用BBD模型,得到4因素3水平共29组的试验设计,实验为3批,每批平行3瓶。实验得到的数据在 “Design-Expert 8.0”软件中的BBD模型对数据进行拟合和分析,通过ANOVA分析得到二次多项式,最终确定最优化发酵条件。
取发酵液上清20 μL,加入5 μL Loading Buffer(5×),进行SDS-PAGE电泳分析,电泳完毕后用考马斯亮蓝R250染色过夜,然后脱色获得清晰的电泳条带为止。
1.2.5 脂肪酶活性测定方法以碱滴定法测定发酵液中脂肪酶活性。取1 mL发酵液上清液,加入5 mL橄榄油和4 mL的glycine-NaCl缓冲液(pH9.4,50 mmol/L)振荡混匀,在36℃孵育15 min,加入20 mL的95%乙醇和10 mL的30% NaCl溶液终止反应。脂肪酶活性单位定义为,在一定温度和pH条件下,1 min水解底物产生1 μmol的可滴定的脂肪酸,即为1个酶活单位,以U/mL表示[15, 16]。
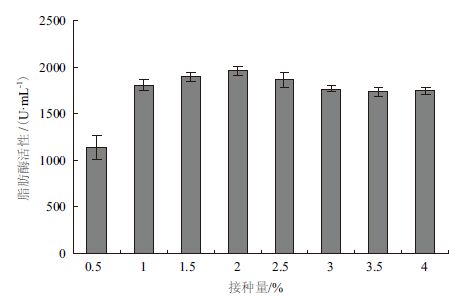
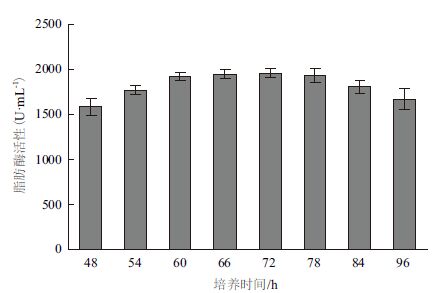
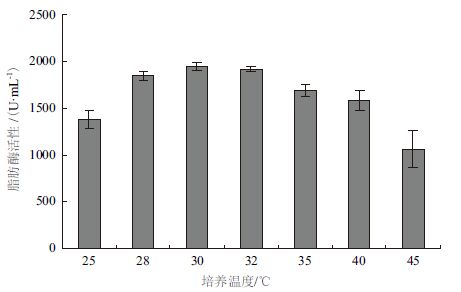
2 结果 2.1 摇瓶发酵条件的单因素优化首先采用单因素实验,对接种量、摇瓶装量、发酵培养温度和培养温度等4个主要的发酵条件进行初步的研究。根据A.niger G62s菌种的发酵特性,确定各个待考察因素水平,对于各个因素的取值范围比较宽,以保证试验结果能够覆盖高值点。取值范围为接种量为0.5%-4.0%,摇瓶装量为30-100 mL,发酵培养温度为25-45℃,发酵培养时间为48-96 h(图 1-图 4)。
|
| 图 1 摇瓶接种量对于脂肪酶活性的影响(n=9) |
|
| 图 4 培养时间对于脂肪酶活性的影响(n=9) |
G62s菌株在接种量为0.5%时发酵不稳定,增加接种量有利于菌株产脂肪酶。当接种量增加至2%时,发酵液的脂肪酶活性最高。而接种量继续增加,在大于2.5%时菌株产酶能力随之降低(图 1)。摇瓶装量的改变主要是影响通气量,当摇瓶装量≥50 mL时,菌株产酶能力趋于稳定,随着摇瓶装量的增加,菌种的产酶能力没有显著降低(图 2),说明该菌株发酵过程对于摇瓶装量和通气量的要求不高。培养温度可以影响菌种产脂肪酶的稳定性和能力。本实验的结果(图 3)显示,适于G62s产脂肪酶的发酵培养温度在30-32℃之间,温度过低或过高都不利于脂肪酶的产生。最适发酵培养时间则为66-78 h,延长发酵培养时间到84 h脂肪酶活性显著降低(图 4)。通过单因素考察,确定发酵条件为:接种量为2.0%,摇瓶装量为50 mL(500 mL摇瓶),培养温度为30℃,培养时间为72 h。

|
| 图 2 摇瓶装量对于脂肪酶活性的影响(n=9) |
|
| 图 3 培养温度对于脂肪酶活性的影响(n=9) |
在单因素实验基础上,采用Design-Expert 8.0软件RSM的BBD设计,针对于影响发酵的接种量(A),摇瓶装量(B),培养温度(C),培养时间(D)进行优化分析,以脂肪酶活性为响应值(Y),选择4因素,3水平,共29组实验,其中有6组为中心点重复实验(表 2)。
将得到的数据,输入至Design-Expert 8.0软件中,进行多元回归拟合,得到Y值对编码自变量A、B、C、D的二元多次回归方程为:
Y = 2 085.8 + 70.67 A + 33.75 B + 63.92 C + 83.33 D - 43.25 AB + 10.5 AC - 77.25 AD - 54.75 BC - 19.75 BD - 54.5 CD - 100.15 A2 - 26.53 B2 - 75.02 C2 - 77.9 D2
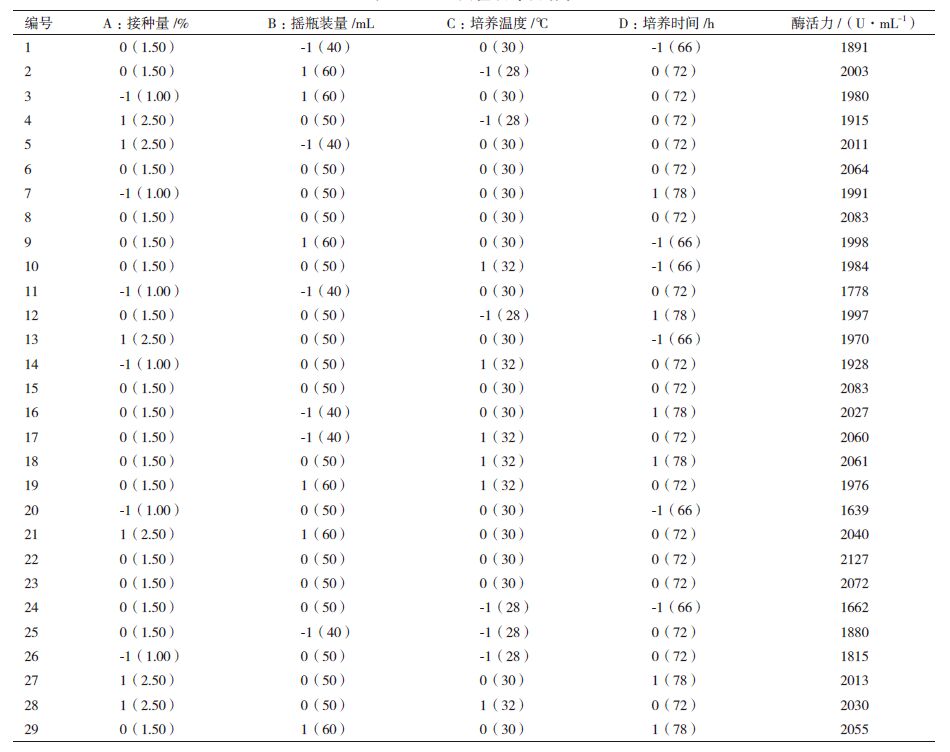
在该拟合方程的基础上,对试验数据进行统计分析和模型方差分析(表 3)。结果显示,模型决定系数R2 =0.934 5,信噪比Adeq Precision = 13.22,表明方程的拟合度与可信度较高,实验误差较小。所选用的模型的P值检验显著(P<0.000 1),说明方程拟合度较好。失拟项P = 0.098 3(P>0.05),说明失拟项差异不显著,模型产生的残差值是由随机误差引起。由此可以认为该模型的选择合理,并且能够对响应值Y进行分析和预测。
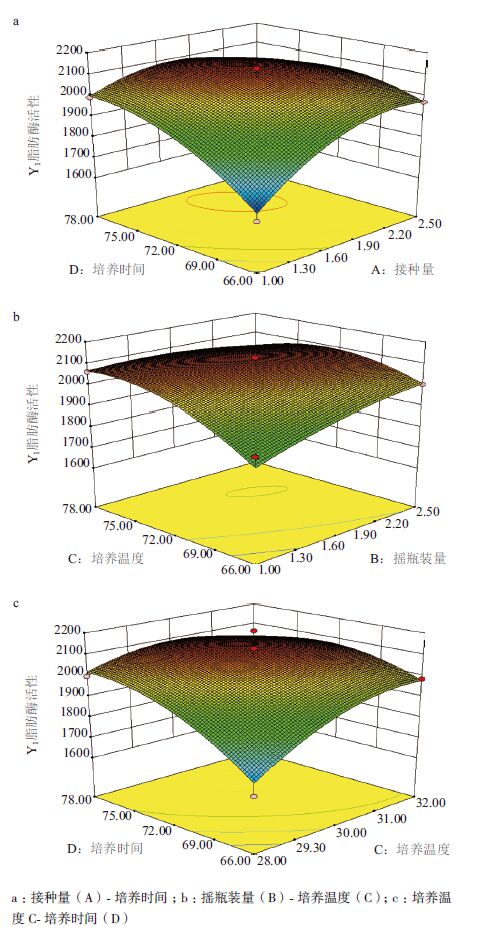
根据表 3对于模型所列4个变量的方差分析,在检验项P<0.05的说明该项的影响是显著的,否则为不显著。该模型的一次项A,B,C,D、二次项A2,C2,D2以及交互项中AD,BC,CD对于Y值影响显著(P < 0.05)。其中,交互项AD影响最大(P=0.003<0.05),即接种量与培养时间之间的交互作用最大。而其他的3个交互项AB、AC、BD,则对于Y值影响不显著(P > 0.05)。
根据方差分析得出AD、BC、CD交互项对于Y值的影响(图 5)。进一步对于回归方程进行求导,得到极值点,即Y最大化时各个因素水平的取值。由软件预测可得,接种量(A)为1.9%,摇瓶装量(B)为56 mL(500 mL摇瓶),培养温度(C)为30℃,培养时间(D)为75 h。并预测在此优化的条件下,G62s菌株的产脂肪酶活性为2 121 U/mL。
|
| 图 5 因素交互作用对于脂肪酶活性的响应面分析 |
按照RSM优化前后的发酵条件对于G62s菌株的发酵液进行SDS-PAGE分析,结果(图 6)显示在箭头所指位置出现了明显的蛋白条带,说明发酵条件优化前后所产脂肪酶的相对分子量没有改变。根据软件Gel-pro 3.0计算,该条带的分子量约为33.2 kD。

|
| 图 6 G62s 的SDS-PAGE 分析 |
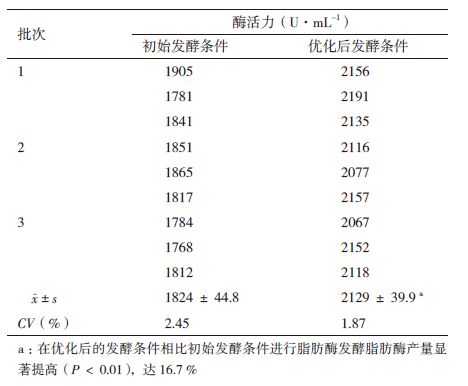
按照RSM优化后的摇瓶发酵条件对于G62s菌株进行验证实验,并检测脂肪酶活性,以验证RSM得到的预测值。试验进行3批,每批平行3瓶。结果(表 4)可见,优化的发酵条件其脂肪酶活性为2 129 ± 39.9 U/mL,与预测值相符(相差0.4%)。与初始发酵条件下发酵比较,脂肪酶活性提高16.7%(C.V. = 1.87%,P < 0.01,差异显著),说明经过RSM优化后菌株的产脂肪酶活性获得了稳定提高。
近年来,微生物发酵产生代谢物的研究越来越多,由于培养基的内在条件(培养基组成、浓度等)及外在条件(发酵温度、时间、通气量等)都会影响微生物的生长与代谢产物的积累,因此对于发酵培养条件的优化成为了研究的热点[17]。在微生物的发酵实验中单因素方法可以最直接、有效地反应各个因素对于菌株影响,广泛应用于发酵条件的优化和菌株的特性考察[18, 19, 20]。响应面法是一种有效的统计方法,可以在更广泛的范围内考虑因素的组合、预测响应值,比一次次的单因素分析方法和正交试验更有效,因此,响应面法会更加广泛应用于发酵培养基工艺条件优化的研究中。响应面分析的关键因素包括:选择合适的研究对象及合适的实验水平,建立一个可信的有效的模型。评估相关性,预测响应值考察模型的准确性等[17,21]。王挥等[22]采用单因素试验和RSM对黑曲霉产单宁酶的摇瓶发酵条件进行优化,确定单宁浓度、培养温度、培养时间为发酵产酶影响最大的因素。其最适产酶条件为:培养温度31.7℃,转速180 r/min,单宁浓度1.5%,初始pH6.0,接种量10%,装液量20%,培养时间72 h,得到的酶活力最高值1 141.82 U/mL。吴茜茜等[23]采用单因素试验和RSM优化设计了黑曲霉(A. niger PZ321)发酵异淀粉酶的摇瓶培养条件,筛选出硝酸铵、接种量、培养温度3个主要因素,确定了最优化培养条件为接种量2%,30℃培养72 h,酶活为137.3 μ/mL;比基础培养基提高了1.71倍。本研究通过单因素方法结合BBD优化,得到了影响G62s菌株脂肪酶产量的主要影响因素,分析各因素之间的相互关系,得到了最优化的摇瓶发酵条件。其中,摇瓶接种由最初的1.5%提高到1.9%;摇瓶装量由50 mL提高到56 mL;培养温度30℃不变;培养时间由66 h延长到75 h,在最佳摇瓶发酵条件组合下,黑曲霉G62s的脂肪酶产量可以增至(2 129±39.9)U/mL,提高了16.7%。本研究结果与上述报道比较,尽管发酵的酶有差异,但是均为黑曲霉的发酵,其优化结果基本一致。G62s菌株发酵SDS-PAGE分析结果显示,摇瓶发酵条件改变没有影响脂肪酶的相对分子量。说明采用单因素试验和RSM优化法,对提高黑曲霉脂肪酶产量是很有效的。
4 结论黑曲霉G62s优化后的摇瓶发酵条件:在装液量56 mL的500 mL摇瓶中,1.9%接种量,于30℃培养时间75 h可得到最优化的脂肪酶产量。
G62s菌株在优化后的发酵条件下发酵得到脂肪酶活性为(2 129±39.9)U/mL,与模型预测值相符,脂肪酶活性提高16.7%,而且发酵稳定。在单因素实验的基础上通过RSM方法优化发酵培养条件,显著提高了目标菌株的脂肪酶产量。
| [1] | Jaeger KE, Egger T. Lipases for biotechnology[J]. Curr Opin Biotech, 2002, (13):390-397. |
| [2] | Gunasekaran V, Das D. Lipase fermentation:Progress and prospects[J]. Indian J Biotech, 2005, 4:437-445. |
| [3] | Vargas GDLP, Treichel H, de Oliveira D, et al. Optimization of lipase production by Penicillium simplicissimum in soybean meal[J]. J Chem Technol Biotechnol, 2008, 83(1):47-54. |
| [4] | Watanabe YS, Sato S, Sera C, et al. Enzymatic analysis of positional distribution of fatty acids in solid fat by 1, 3-Selective transesterification with Candida antarctica lipase B[J]. J Am Oil Chem Soc, 2014, 91:1323-1330. |
| [5] | Edwinoliver NG, Thirunavukarasu K, Purushothaman S, et al. G. Corn steep liquor as a nutrition adjunct for the production of Aspergillus niger lipase and hydrolysis of oils thereof[J]. J Agric Food Chem, 2009, 57(22):10658-10663. |
| [6] | 张志敏, 王琰, 王斌, 等. 甲醇耐受性脂肪酶产生菌-发酵条件的优化[J]. 河南农业大学学报, 2013, 47(3):318-324. |
| [7] | Schuster E, Dunn-Coleman N, Frisvad JC, et al. On the safety of Aspergillus niger-a review[J]. Appl Microbiol Biotech, 2002, 59(4-5):426-435. |
| [8] | 张谦, 王剑英, 林智, 等. 华根霉脂肪酶在黑曲霉中的重组表达研究[J]. 生物技术通报, 2015, 31(3):165-170. |
| [9] | Mekmouche Y, Zhou S, Cusano AM, et al. Gram-scale production of a Basidiomycetous laccase in Aspergillus niger[J]. J Biosci Bioeng, 2014, 117(1):25-27. |
| [10] | 张谦, 贾佳, 林智, 等. 饲料用脂肪酶产生菌—黑曲霉G55高产菌株的选育[J]. 中国饲料, 2014, 16:28-32. |
| [11] | 褚以文. 微生物培养基优化方法及其优化软件[J]. 国外医药:抗生素杂志分册, 1999, 20(2):58-61. |
| [12] | Rafigh SM, Yazdi AV, Vossoughi M, et al. Optimization of culture medium and modeling of curdlan production from Paenibacillus polymyxa by RSM and ANN[J]. Int J Biol Macromol, 2014, 70:463-473. |
| [13] | 王春明, 钟超, 王凤学, 等. 一株发酵产木聚糖酶培养基的响应面优化[J]. 生物技术通报, 2015, 31(2):179-186. |
| [14] | Dobrev GT, Pishtiyski IG, Stanchev VS, et al. Optimization of nutrient medium containing agricultural wastes for xylanase production by Aspergillus niger B03 using optimal composite experimental design[J]. Bioresour Technol, 2007, 98(14):2671-2678. |
| [15] | Zhang T, Qi Z, Wang YY, et al. Agrobacterium tumefaciens-mediated transformation of Penicillium expansum PE-12 and its application in molecular breeding[J]. Microbiolog Res, 2013, 168:130-137. |
| [16] | Kouker G, Jaeger K E. Specific and sensitive plate assay for bacterial lipases[J]. Appl Environ Microbiol, 1987, 53(1):211-213. |
| [17] | 刘志祥, 曾超珍. 响应面法在发酵培养基优化中的作用[J]. 北方园艺, 2009, 2:127-129. |
| [18] | 王义强, 王启业, 马国辉, 等. 戊糖乳酸杆菌发酵产乳酸及高产菌株诱变选育[J]. 生物技术通报, 2014, 30(11):179-186. |
| [19] | 吴孔阳, 王学军, 周培华, 等. 响应面法优化黑曲霉发酵产低聚异麦芽糖培养基[J]. 食品科学, 2012, 33(19):216-222. |
| [20] | 吴升山, 倪辉, 肖安风, 等. 黑曲霉DB056产柚苷酶发酵条件初步优化[J]. 微生物学通报, 2010, 37(9):1305-1311. |
| [21] | Vohra A, Satyanarayana T. Statistical optimization of themedium components by response surface methodology to enhance phytase production by Pichia anomala[J]. Process Biochem, 2002, 37(9):999-1004. |
| [22] | 王挥, 张蕾, 黎继烈, 等. 响应面法优化黑曲霉发酵产单宁酶条件[J]. 中南林业科技大学学报, 2011, 31(10):122-126. |
| [23] | 吴茜茜, 田晓敏. 响应面法优化黑曲霉产异淀粉酶的培养方法[J]. 生物学杂志, 2014, 31(6):60-63, 78. |