D-乳酸是一种重要的手性中间体,其聚合物具有较高的热稳定性,可制成生物可降解材料,因此其生产和应用受到广泛关注,成为目前研究的热点[1, 2]。微生物发酵法由于原料来源广泛、生产成本低、光学纯度高、安全性高等优点已成为国内外生产D-乳酸的主要方法[3]。目前D-乳酸的生产主要以葡萄糖作为底物。自然界中生物质种类繁多,分布广泛,且数量巨大,价格低廉。木质纤维素的水解产物富含大量糖类,包括葡萄糖、木糖、阿拉伯通和半乳糖等[4]。这些混合糖可以作为碳源用以微生物发酵生产。如果能以木质纤维素水解后的混合糖替代葡萄糖作为碳源用于微生物发酵就能够节省生产成本,同时将如秸秆等农业废弃物加以利用,变废为宝,有益于保护环境。但是利用混合糖进行发酵面临着两个难题:(1)混合糖中的六碳糖较容易被微生物利用,但木糖等五碳糖很少有微生物能够利用;(2)利用混合糖发酵时大肠杆菌优先利用六碳糖,待六碳糖消耗完才利用五碳糖,而利用五碳糖特别是木糖前有一段很长的停滞期,相比于纯木糖其利用速度较慢,且通常木糖没能利用完[5]。
在两种混合碳源环境中大肠杆菌通常优先利用其中容易代谢的一种(通常是葡萄糖),待前一种耗尽和一段停滞期后再开始利用另一种碳源,这种葡萄糖代谢对其他碳源利用的抑制作用被称为分解代谢产物阻遏(Carbon catabolite repression,CCR),有时也称为葡萄糖效应(Glucose effect)[6, 7, 8]。大量研究表明,CCR的产生与糖类磷酸转移酶系统(PTS转运系统)有关[9]。PTS系统负责特异性地将葡萄糖从细胞外跨膜主动运输进入细胞,并在此过程中,将葡萄糖磷酸化为葡萄糖-6-磷酸,进入糖酵解途径[10]。PTS系统包括EⅠ、HPr以及EIIs,前两者是非特异性的可溶性胞质蛋白,后者为蛋白复合体,包括EIIMan、EIIFru、EIIBgl、EIIAGlc、EIICBGlc 等,其中crr 基因编码的EIIAGlc 以及ptsG基因编码的EIICBGlc 在葡萄糖磷酸化转运中起主要作用[11, 12]。通过敲除ptsG基因可以降低葡萄糖由胞外向胞内转运的速度,提高胞内EIIAGlc的磷酸化水平,降低葡萄糖抑制效应。
本研究选用糖类代谢范围广的大肠杆菌工程菌E.coli JH13为出发菌株,该菌是在能利用五碳糖产高纯度L-乳酸的大肠杆菌基因工程菌E.coli JH12[13, 14, 15, 16]的基础上通过Red同源重组技术将乳酸片球菌(Pediococcus acidilactici)的L-乳酸脱氢酶(L-lactatedehydrogenase,L-ldh)基因置换成D-乳酸脱氢酶(ldhA)基因,构建的一株能利用五碳糖产D-乳酸的大肠杆菌基因工程菌。在该菌的基础上通过Red同源重组技术敲除葡萄糖跨膜转运基因ptsG,降低葡萄糖抑制效应,构建一株能够同时高效利用五碳糖和六碳糖发酵产D-乳酸的重组大肠杆菌工程菌。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒出发菌株E.coli JH13是能够高效利用五碳糖发酵产D-乳酸的工程菌,其来源于野生菌株E.coli B,菌株JH13敲除了丙酮酸甲酸裂解酶(focA-pflB)、延胡索酸还原酶(frdABCD)、乙酸激酶(ackA)、乙醇脱氢酶(adhE)基因,并通过无氧启动子融合表达技术倍增了NADH还原力,能够在无氧条件下良好生长,由本实验室保存。质粒pKD46(温度敏感型复制子,Ampr)和pKD4(含有卡那霉素抗性基因Kanr)由本实验室保存。
1.1.2 主要试剂和仪器DNA marker,PCR Master Mix购自Fermentas公司,氨苄青霉素和卡那霉素购自Mersco公司,D-乳酸标样购于Sigma公司,PCR引物由生工生物工程(上海)股份有限公司合成,分析纯葡萄糖、木糖及其他无机盐等购于国药集团。
Sartorius BB-8846880发酵罐(德国Sartorius Ste-dim Biotech公司),Waters e2695型高效液相色谱仪(美国Waters公司),mycycler PCR仪(美国Bio-Rad公司),MicroPluser 电转仪(美国Bio-Rad公司)。
1.1.3 培养基 LB培养基:蛋白胨10 g/L、酵母粉5 g/L、氯化钠5 g/L;种子培养基:LB培养基加2%葡萄糖;发酵培养基:LB培养基加5%葡萄糖和5%木糖;选择培养基:LB固体培养基加2%葡萄糖加抗生素(50 mg/L氨苄青霉素或卡那霉素)。 1.2 方法 1.2.1 PCR引物设计根据质粒pKD4及ptsG的基因序列设计敲除引物P1、P2,这对引物为两侧带ptsG同源臂的卡那霉素抗性基因片段的扩增引物,靠近5'端未加下划线的序列与ptsG基因序列相同,靠近3'段加下划线的序列与质粒pKD4上卡那霉素抗性基因序列一致;P3、P4为ptsG基因敲除后的验证引物,该引物序列与扩增引物上ptsG同源臂序列一致,如表 1所示。
根据ptsG基因序列设计特异性引物P1和P2,该对引物一端与ptsG基因序列一致,另一端为卡那霉素抗性基因序列。以pKD4质粒为模板,进行PCR扩增,得到两端带有ptsG 同源臂的卡那霉素抗性基因片段。扩增条件为:95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 2 min,30个循环;72℃ 5 min。用CaCl2法将pKD46转化到E.coli JH13细胞中,经过氨苄青霉素抗性平板筛选后得到阳性菌落。通过电转方法将扩增的卡那霉素抗性基因片段电转到L-阿拉伯糖诱导过的E.coli JH13/pKD46感受态细胞中,30℃复苏培养2 h,立刻涂布于含卡那霉素的LB培养基抗性平板上。37℃培养24 h,挑选生长较大的单菌落在卡那霉素抗性平板上转接2-3次,以P3、P4为引物进行PCR验证。将ptsG基因成功敲除的菌株命名为E.coli JH15。
1.2.3 发酵罐发酵培养从LB平板上挑一个单菌落,接种于含有10 mL种子培养液的无氧管中,37℃过夜培养。取2 mL菌液接种于300 mL种子液中,37℃下150 r/min培养至OD600 = 1.0-1.5。以10%的接种量将菌液接种至3 L发酵培养基(5%葡萄糖加5%木糖)中,置于带自动调节系统的7 L发酵罐中,37℃下150 r/min培养发酵,流加3 mol/L Ca(OH)2控制pH为7.0。定时取样,测定菌体浓度、葡萄糖、木糖、乳酸及其它代谢产物的浓度。
1.2.4 秸秆水解液发酵称取300 g粉碎后的秸秆,按10%(W/V)固液比加入2%(W/V)H2SO4,混匀后置于高压灭菌锅中处理1 h,冷却后添加Ca(OH)2至pH达到10。置于90℃水浴锅保持30 min,待其冷却至室温,用6 mol/L的H2SO4或HCl将pH调至中性,离心或滤纸过滤除去不溶性固体,液体部分装入发酵罐灭菌。称取10 g/L蛋白胨和5 g/L酵母粉,单独灭菌后加入发酵罐。以10%的接种量进行接种,并用无菌水定容至3 L。37℃下150 r/min培养发酵,流加3 mol/L Ca(OH)2控制pH为7.0。定时取样,测定葡萄糖、木糖、阿拉伯糖及乳酸的浓度。
1.2.5 发酵产物检测与分析菌体浓度测定时先用3 mol/L HCl溶液酸解,再在可见光分光光度计测定波长600 nm下OD值。葡萄糖、木糖、阿拉伯糖和有机酸采用高效液相色谱法分析,色谱柱为Bio-Rad HPX 87H,流动相为4 mmol/L H2SO4,流速0.5 mL/min,柱温40℃,检测器为PDA、ELS检测器。
2 结果2.1 ptsG基因缺陷菌株JH15的鉴定
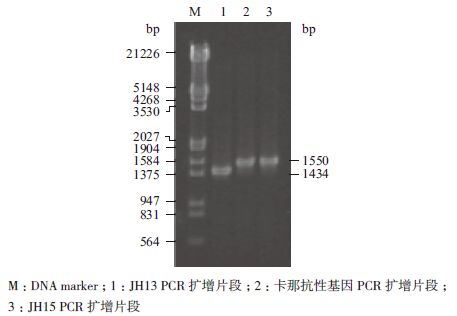
用鉴定引物P3、P4对ptsG缺失菌株JH15进行PCR验证,以出发菌株JH13为对照。由于鉴定引物P3、P4的基因序列与卡那霉素抗性基因扩增引物上ptsG同源臂的基因序列一致,所以敲除成功菌株扩增出来的片段大小应与卡那霉素抗性基因扩增片段的大小相同。结果如图 1所示,以JH13为底物扩增的ptsG片段大小为1 434 bp;JH15和卡那霉素抗性基因的扩增片段大小均为1 550 bp,与ptsG自身长度相差116 bp,表明ptsG基因已成功敲除。
|
| 图 1 ptsG 基因敲除验证 |
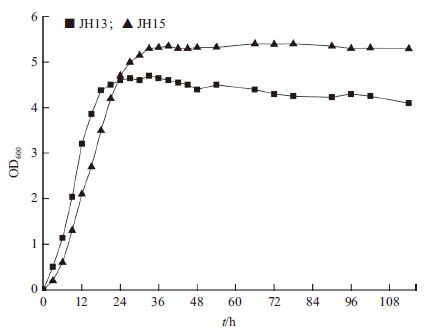
为了测试ptsG缺陷菌株JH15利用混合糖发酵的情况,本实验在带有pH 自动调节功能的7 L发酵罐中进行。JH13和JH15菌体生长曲线如图 2所示,出发菌JH13发酵到24 h时OD600达到4.6,之后进入稳定期;工程菌JH15在36 h进入稳定期,OD600值为5.3。在0-24 h之间JH13的OD600值比JH15大;但随着发酵的进行,发酵24 h后JH15的OD600值反而超过了JH13。JH15的最大OD600值是JH13的1.15倍。
|
| 图 2 ptsG 缺陷菌JH15 和出发菌JH13 在混合糖培养基中的菌体生长曲线 |
JH13和JH15耗糖情况如图 3 所示,在114 h的发酵过程中,ptsG缺陷菌株JH15在混合糖发酵过程中葡萄糖和木糖同时消耗;而对照菌JH13优先利用葡萄糖,待葡萄糖消耗完才开始利用木糖。说明ptsG基因的敲除确实能够降低葡萄糖抑制效应,同时利用葡萄糖和木糖进行发酵。

|
| 图 3 ptsG 缺陷菌JH15 和对照菌JH13 混合糖发酵(7 L发酵罐,50 g/L 葡萄糖,50 g/L 木糖)糖消耗曲线 |
JH15在发酵36 h时葡萄糖消耗完,发酵114 h木糖利用完,发酵结束;JH13发酵21 h葡萄糖消耗完才开始利用木糖,发酵114 h时还有18 g/L木糖残留。表 2 所示,JH15葡萄糖的消耗速率为1.39 g/(L·h),木糖消耗速率为0.44 g/(L·h);JH13葡萄糖消耗速率为2.38 g/(L·h),木糖消耗速率为0.34 g/(L·h)。与JH13相比JH15葡萄糖消耗速率降低了41.6%,但是木糖的消耗速率提高了29.41%。这是由于ptsG基因的敲除阻断了葡萄糖的主要运输途径(PTS转运系统),导致葡萄糖的转运速度降低,但是敲除ptsG基因降低了代谢产物阻遏效应,在利用葡萄糖的同时利用木糖,这样就提高了木糖的利用率。
图 4 和表 2所示,发酵30 h以前对照菌JH13的乳酸产量高于ptsG缺陷菌株JH15,发酵30 h后JH15的乳酸产量反而高于JH13;发酵114 h,JH15乳酸产量为83.04 g/L,转化率为83.04%;而JH13乳酸产量为66.02 g/L,转化率为80.51%。实验表明ptsG基因的敲除使得JH15相比于JH13最大生产强度提高了2.37%,平均生产强度提高了25.86%。

|
| 图 4 ptsG 缺陷菌JH15 和对照菌JH13 混合糖发酵(7 L 发酵罐,50 g/L 葡萄糖,50 g/L 木糖)的乳酸产量曲线 |
为了验证ptsG缺陷菌株JH15利用木质纤维素水解液发酵的情况,本实验以稻草秸秆为原料经过2%的H2SO4酸解和Ca(OH)2脱毒处理后得到秸秆水解液。以秸秆水解液为碳源,添加10 g/L蛋白胨和5 g/L酵母粉,配制成3 L发酵培养基。水解液中主要含有葡萄糖、木糖和L-阿拉伯糖,其中葡萄糖浓度为16.5 g/L、木糖9.8 g/L、L-阿拉伯糖2.8 g/L。
JH15利用秸秆水解液发酵情况如图 5所示,JH15生长速度逐渐加快,12 h时OD600达到2.5,随后生长速度减慢。JH15在发酵过程中同时利用葡萄糖、木糖和L-阿拉伯糖,15 h时发酵结束。其中葡萄糖在12 h消耗完,消耗速率为1.37 g/(L·h);木糖和L-阿拉伯糖15 h消耗完,木糖消耗速率为0.65 g/(L·h),L-阿拉伯糖消耗速率为0.19 g/(L·h)。发酵结束时乳酸产量为25.12 g/L,生产强度为1.67 g/(L·h),转化率为86.42%。

|
| 图 5 JH15 利用稻草秸秆水解液发酵菌体生长、糖消耗和乳酸产量曲线 |
国内外关于利用ptsG缺陷菌株进行混合糖发酵的研究已有报道。Nichols等[17]敲除了产乙醇大肠杆菌工程菌的ptsG基因,获得的ptsG缺陷菌株能够同时利用8%混合糖(葡萄糖、木糖和阿拉伯糖)进行发酵,乙醇产率达到理论值87%-94%。严涛等[18]构建的ptsG缺陷菌株E.coli SZ470P在5%混合糖(2.5%木糖和2.5%葡萄糖)培养基中能同时利用葡萄糖和木糖进行发酵,木糖消耗量是对照菌株的3.8倍,乙醇产量提高了14.32%。但是关于同时利用五碳糖和六碳糖发酵产D-乳酸的文献尚未见报道。
本实验以能够高效利用木糖产D-乳酸的重组大肠杆菌工程菌JH13为出发菌株,利用Red同源重组技术敲除ptsG基因,成功构建一株能够同时利用五碳糖和六碳糖发酵产D-乳酸的工程菌E.coli JH15。在混合糖培养基中,在前24 h,JH15生长的比JH13缓慢,是因为敲除了葡萄糖跨膜转运的主要基因ptsG,葡萄糖的摄取速度降低;24 h后JH15的菌体密度超过了JH13,是因为ptsG缺陷菌JH15降低了葡萄糖效应,在混合糖培养基中能更好的利用碳源来维持菌体的生长。在10%混合糖(5%葡萄糖和5%木糖)发酵中,JH15由于ptsG基因的敲除降低了葡萄糖效应,因此能够完全利用葡萄糖和木糖,并且完成发酵,最终乳酸产量为83.04 g/L;对照菌株JH13先利用葡萄糖,待葡萄糖消耗完才利用木糖,发酵结束时还有18 g/L木糖残留,乳酸产量为66.02 g/L。相比于对照菌,JH15木糖消耗速度提高了29.41%,乳酸产量提高了25.86%。因此ptsG基因的敲除能够降低葡萄糖抑制效应,提高木糖的利用率,提高D-乳酸的产量。在稻草秸秆水解液发酵中,JH15同时利用葡萄糖、木糖和L-阿拉伯糖,15 h发酵结束,乳酸产量为25.15 g/L,转化率为86.42%。稻草秸秆水解液发酵实验进一步验证了菌株JH15能够很好的利用秸秆水解液发酵生产D-乳酸,为利用廉价的木质纤维素水解物为原料发酵生产D-乳酸提供参考依据。
4 结论通过Red 同源重组技术敲除ptsG基因而成功构建的D-乳酸工程菌E.coli JH15,具有同时利用五碳糖和六碳糖发酵的能力。该菌经证实在10%的混合糖(5%葡萄糖和5%木糖)发酵过程中能有效的利用完葡萄糖和木糖,糖酸转化率达到83.04%;并且能够很好的利用稻草秸秆水解液发酵。
| [1] | 刘鹏, 李爽, 贾晓强, 等. 基因工程菌生产D-乳酸研究进展[J]. 现代化工, 2010, 30(10):13-17. |
| [2] | Datta R, Tsai SP, Bonsignore P, et al. Technological and economic potential of poly(lactic acid)and lactic acid derivatives[J]. FEMS Microbiology Reviews, 1995, 16(2-3):221-231. |
| [3] | Vijayakumar J, Aravindan R, Viruthagiri T. Recent trends in the production, purification and application of lactic acid[J]. Chemical and Biochemical Engineering Quarterly, 2008, 22(2):245-264. |
| [4] | Bothast RJ, Nichols NN, Dien BS. Fermentations with new recombinant organisms[J]. Biotechnology Progress, 1999, 15(5):867-875. |
| [5] | Dien BS, Nichols NN, O’Bryan PJ, et al. Development of new etha-nologenic Escherichia coli strains for fermentation of lignocellulosic biomass[J]. Applied Biochemistry and Biotechnology, 2000, 84(1-9):181-196. |
| [6] | Magasanik B. Catabolite repression[M]. Cold Spring Harbor Laboratory Press, 1961, 26:249-256. |
| [7] | Deutscher J. The mechanisms of carbon catabolite repression in bacteria[J]. Current Opinion in Microbiology, 2008, 11(2):87-93. |
| [8] | Postma PW, Lengeler JW, Jacobson GR. Phosphoenolpyruvate:carbohydrate phosphotransferase systems of bacteria[J]. Microbiological Reviews, 1993, 57(3):543. |
| [9] | Tanaka Y, Teramoto H, Inui M, et al. Regulation of expression of general components of the phosphoenolpyruvate:carbohydrate phosphotransferase system(PTS)by the global regulator SugR in Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology, 2008, 78(2):309-318. |
| [10] | Kundig W, Ghosh S, Roseman S. Phosphate bound to histidine in a protein as an intermediate in a novel phospho-transferase system[J]. Proceedings of the National Academy of Science of the United States of America, 1964, 52(4):1067-1074. |
| [11] | Deutscher J, Francke C, Postma PW. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J]. Microbiology and Molecular Biology Reviews, 2006, 70(4):939-1031. |
| [12] | Meins M, Jenö P, Müller D, et al. Cysteine phosphorylation of the glucose transporter of Escherichia coli[J]. Journal of Biological Chemistry, 1993, 268(16):11604-11609. |
| [13] | Zhou S, Iverson AG, Grayburn WS. Engineering a native homoethanol pathway in Escherichia coli B for ethanol production[J]. Biotechnology Letters, 2008, 30(2):335-342. |
| [14] | Zhou S, Iverson AG, Grayburn WS. Doubling the catabolic reducing power(NADH)output of Escherichia coli fermentation for production of reduced products[J]. Biotechnology Progress, 2010, 26(1):45-51. |
| [15] | Wang Y, Manow R, Finan C, et al. Adaptive evolution of nontransgenic Escherichia coli KC01 for improved ethanol tolerance and homoethanol fermentation from xylose[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9):1371-1377. |
| [16] | 赵锦芳, 许丽媛, 王永泽, 等. 利用五碳糖产高纯度 L-乳酸的大肠杆菌基因工程菌的构建[J]. 微生物学报, 2013, 53(4):328-337. |
| [17] | Nichols N, Dien B, Bothast R. Use of catabolite repression mutants for fermentation of sugar mixtures to ethanol[J]. Applied Microbiology and Biotechnology, 2001, 56(1-2):120-125. |
| [18] | 严涛, 赵锦芳, 高文慧, 等. 大肠杆菌工程菌 ptsG 基因敲除及其缺陷株混合糖同型乙醇发酵[J]. 生物工程学报, 2013, 29(7):937-945. |