微生物农药在四大种类生物农药中占有举足轻重的地位[1]。芽孢杆菌由于抗逆性高、作用机制复杂、功能明显等因素已作为微生物农药在农业领域广泛应用。解淀粉芽孢杆菌(B. amyloliquefaciens)是芽孢杆菌的一个种,也是重要的防治植物病害的微生物资源[2, 3, 4]。解淀粉芽孢杆菌能够分泌多种依赖NRPs(Nonribosomal peptide synthetase,NRPs)和PKS(Polyketide synthetase,PKS)以及NRPS/PKS代谢途径组合的次生代谢抑菌物质[5, 6, 7, 8],并协同其他机制如诱导抗病性[9]、促进生长[10]和提高植物营养吸收率[11]等因素保障植物的健康。优化发酵条件,增加生物活性物质的含量和微生物的生物量是提高生防制剂应用效果的的重要前提,与此相关的与解淀粉芽孢杆菌的研究已有报道[12, 13, 14]。
解淀粉芽孢杆菌B. amyloliquefaciens LJ1是从土壤中分离获得的一株生防菌株,它与环境相容性好,对生物安全,大田试验表明LJ1发酵液对瓜类白粉病有很好的防治效果并可以诱导黄瓜产生抗病性[15, 16]。本实验探索解淀粉芽孢杆菌LJ1的抑菌谱和对黄瓜灰霉病防治能力,并对其摇瓶发酵条件和培养基进行初步优化,以期提高其抑菌能力和防病效果。
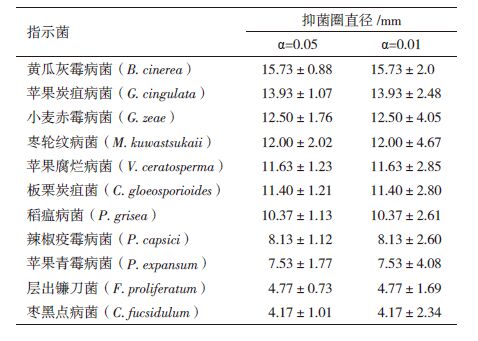
1 材料与方法 1.1 材料 1.1.1 供试菌株解淀粉芽孢杆菌(B. amyloliquefaciens)LJ1由天津农学院植物病理实验室从土壤中分离,筛选,保存。指示菌:黄瓜灰霉病菌(Botrytis cinerea)、苹果炭疽病菌(Glomerella cingulata)、小麦赤霉病菌(Gibberrella zeae)、栆轮纹病菌(Macrophoma kuwastsukaii)、板栗炭疽病菌(Colletotrichum gloeosporioides)、苹果腐烂病菌(Valsa ceratosperma)、稻瘟病菌(Phyricularia grisea)、辣椒疫霉病菌(Phytophthora capsici)、苹果青霉病菌(Penicillium expansum)、枣黑点病菌(Coniothyrium fucsidulum)、层出镰刀菌(Fusarium proliferatum)、高粱炭疽病菌(Colletotrichum graminicola)、小麦纹枯病菌(Rhizoctonia cerealis)、小麦全蚀病菌(Gaeumanomyces graminis)由天津农学院植物病理实验室提供。
1.1.2 主要培养基PDA:马铃薯200 g,葡萄糖 20 g,琼脂粉 16 g,蒸馏水 1 000 mL。LB培养基:Yeast extract 5 g,Tryptone 10 g,氯化钠 10 g,琼脂粉 16 g,蒸馏水 1 000 mL。种子培养基:Yeast extract 5 g,Tryptone 10 g,氯化钠 10 g,蒸馏水 1 000 mL。无碳培养基:(NH4)2SO4 2.0 g,NaH2PO4·H2O 0.5 g,K2HPO4 0.5 g,MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.1 g,蒸馏水 1 000 mL,pH 6.5。无氮培养基:葡萄糖 10 g,KH2PO4 1.36 g,Na2HPO4 2.13 g,MgSO4·7H2O 0.2 g,FeSO4·7H2O 0.000 5 g,CaCl2 0.005 g,蒸馏水1 000 mL,pH7.0-7.2。
1.2 方法 1.2.1 解淀粉芽孢杆菌LJ1平板抑菌效果的测定采用管碟法[17]稍加改进来检测解淀粉芽孢杆菌LJ1对上述14种病原真菌的抑菌效果。取25℃培养5 d的指示菌,取4 cm2的菌块加入3 mL无菌水冲洗,制成菌丝悬浮液,取1 mL菌丝悬浮液加入30-50℃的PDA培养基中迅速摇匀,倒入培养皿中(厚度为3 mm),待凝固后将牛津杯置于培养基中央,加入200 μL在PDA液体培养基中28℃,200 r/min培养16 h的LJ1发酵液。将平板置于27℃下培养3 d后,观察并测量抑菌圈的直径。
1.2.2 解淀粉芽孢杆菌LJ1生长曲线的测定种子液的制备:将解淀粉芽孢杆菌LJ1在LB培养基上划线培养,挑取单菌落接种在种子培养基中,28℃,200 r/min振荡培养16 h。取48支含5 mL种子培养基的试管,接10 μL种子液加入试管中,于28℃,200 r/min振荡培养,每隔2 h用种子培养基接LJ1菌株,置于摇床中,28℃ 200 r/min摇菌。每隔2 h测定培养液吸光值,每个处理重复3次。以OD600值为纵坐标,以培养时间为横坐标,绘制LJ1菌株的生长曲线。
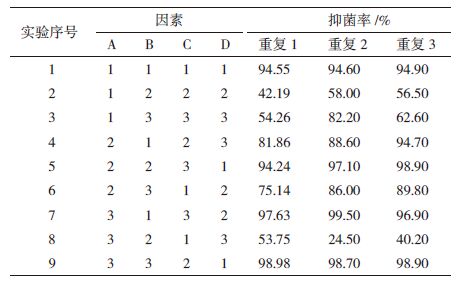
1.2.3 摇瓶发酵条件优化以初始pH值、温度、转速、装液量为试验因素,按照正交设计表L9(34)设计4个因素、3个水平(表 1)的正交试验来优化B. amyloliquefaciens LJ1的摇瓶发酵条件。
在PDA液体培养基中加入1%的种子液,根据正交实验表各处理不同发酵条件摇菌26 h。各组发酵液稀释100倍后采用载玻片孢子萌发法测定对B. cinerea孢子萌发的抑制效果。
萌发率=孢子萌发数/孢子总数×100%
LJ1发酵液抑菌率=(对照萌发率-处理萌发率)/对照萌发率×100%
1.2.4 解淀粉芽孢杆菌LJ1培养基的优化 1.2.4.1 解淀粉芽孢杆菌LJ1培养基碳源的选择参考谷医林的研究[18],在无碳培养基中分别添加10 g/L的可利用碳源,28℃,200 r/min摇菌26 h。分别用分光光度计检测600 nm下的OD值,筛选出有利于LJ1菌株生长的几种碳源。将筛选出的碳源加入无碳培养基中,终浓度分别为10 g/L、20 g/L、50 g/L。加入1%种子液,28℃,200 r/min摇菌26 h,每处理重复3次,用活菌计数法[19]测定培养基中菌量,进而筛选出最佳碳源及其最适浓度。
1.2.4.2 解淀粉芽孢杆菌LJ1氮源的选择在无氮培养基中分别加入终浓度为5 g/L的牛肉浸膏、酵母膏、草酸铵、乙酸铵、硝酸钾、尿素、硫酸铵、亚硝酸钠、钼酸铵、氯化铵、磷酸二氢铵、黄豆粉、硝酸钙等氮源,28℃,200 r/min摇菌26 h。用分光光度计检测OD600值和转接划线的方法来测定LJ1可利用氮源,并选取有利于菌株LJ1生长的氮源,进一步筛选。将初步筛选出的氮源加入无氮培养基中,终浓度分别为5 g/L、10 g/L、20 g/L。加入1%种子液,28℃,200 r/min摇菌26 h,每处理重复3次,用活菌计数法测定培养基中菌量,筛选出最佳氮源及其最佳浓度。
1.2.4.3 解淀粉芽孢杆菌LJ1无机盐的选择将MnSO4·H2O、MgCl2·6H2O、ZnSO4·7H2O、FeC6H5O7、FeCl3、CuSO4·5H2O加入PDA液体培养基中终浓度分别为0. 5 g/L、1 g/L、1.5 g/L。以PDA液体培养基为对照,加入1%种子液,28℃,200 r/min摇菌26 h,每处理重复3次,用活菌计数法测定培养基中菌量,筛选出最佳金属离子及其的最佳浓度。
1.2.5 发酵条件优化验证用孢子萌发法和盆栽试验法来验证培养基和条件优化后的发酵液抑菌效果。将种子液以1%接种量分别接种到PDA液体培养基和优化后的培养基中。PDA液体培养基发酵条件:28℃,200 r/min,初始pH 7.0 装液量100 mL,优化培养基采用优化后的发酵条件,采用孢子萌发法测定发酵液对B. cinerea孢子萌发的抑制效果。
盆栽实验:将优化前、后发酵液稀释100倍后喷施于三叶期黄瓜幼苗上,每个处理重复6盆,每盆3株黄瓜苗,以无菌水喷洒为对照。24 h后,将1×105 CFU/mL的黄瓜灰霉病菌孢子悬浮液均匀喷洒在黄瓜苗叶片上。于20℃,保湿,温室密闭培养,7 d后观察黄瓜苗发病情况,统计病情指数并计算发酵液防治效果,病情分级参考曹春娜等的方法[20]。
病情指数=∑[(各级病叶数×代表级值)]/(调查总叶数×最高代表级值)×100
防治效果(%)=(对照发病指数-处理发病指数)/对照发病指数×100
2 结果 2.1 解淀粉芽孢杆菌LJ1平板抑菌效果将LJ1与14种病原真菌做平板对峙培养,结果表明解淀粉芽孢杆菌LJ1与高粱炭疽病菌(C. graminicola)、小麦纹枯病菌(R. cerealis)、小麦全蚀病菌(G. graminis)对峙培养无抑菌圈产生,对黄瓜灰霉病菌(B. cinerea),苹果炭疽病菌(G. cingulata)、枣轮纹病菌(M. kuwastsukaii)等11种病原菌均产生明显抑菌圈,其中对黄瓜灰霉病菌的抑制效果最高,抑菌圈直径达15.73 mm。对峙培养结果显示B. amyloliquefaciens LJ1具有广谱抑菌效果,有较好的应用潜力。
生长曲线反映了细菌培养过程中的生长和繁殖规律。细菌的生长一般要经过延滞期、对数期、稳定期、死亡期4个时期,LJ1的生长曲线如图 1所示为S型生长曲线。在0-6 h LJ1菌量处在延滞期,LJ1菌株繁殖较少,为细菌的分裂增殖储存充足的酶、能量及中间代谢产物。6-14 h细菌LJ1处于对数增长期,OD值快速上升。14-26 h细菌LJ1处于稳定期,群体生长停止,生长曲线趋于平稳。实验中检测B. amyloliquefaciens LJ1的活菌数和抑菌效果均在稳定期进行检测。26 h后进入死亡期,细菌繁殖速度减慢逐渐死亡。

|
| 图 1 B. amyloliquefaciens LJ1 的生长曲线 |
正交实验不同发酵条件培养的B. amyloliquefac-iens LJ1发酵液对B. cinerea孢子萌发的抑制效果如表 3所示,表 4为正交实验各因素不同水平的评价。由表 4可以看出不同pH值、温度、转速、装液量培养的LJ1发酵液对B. cinerea孢子萌发的抑制效果不同。由极差R值的大小比较说明对LJ1菌株发酵液抑菌能力的影响顺序为装液量> pH值>温度>转速。其中,装液量和pH值对发酵液的抑菌效果影响较大。装液量50 mL,pH值5,温度30℃均显著好于其他水平。转速200 r/min与150 r/min无显著差异,但显著好于100 r/min。综合考虑仍选择200 r/min为最优转速。因此,B. amyloliquefaciens LJ1发酵条件最优组合为装液量50 mL,pH值5,温度30℃,转速200 r/min。
以16种解淀粉芽孢杆菌LJ1可以利用碳源为单一碳源摇菌培养。以脯氨酸、葡萄糖、蔗糖为碳源的培养基摇菌后B. amyloliquefaciens LJ1生长状态最好,培养基浑浊度较高。在无碳培养基中分别加入10 g/L、20 g/L、50 g/L的脯氨酸、葡萄糖、蔗糖,28℃,200 r/min摇菌26 h 后,检测B. amyloliquefaciensLJ1菌量,结果如图 2所示,不同碳源对LJ1菌量的影响不同。在无碳培养基中加入相应碳源后,碳源对菌量的影响由大到小依次为:蔗糖>葡萄糖>脯氨酸,当加入10 g/L蔗糖时菌量达到最大,为9.08×108 CFU/mL。由图 2可知各碳源最适浓度均为10 g/L,加入过量碳源不利于LJ1的生长。因此,选择10 g/L的蔗糖为最佳碳源。

|
| 图 2 碳源对菌株LJ1 生长量大小的影响 |
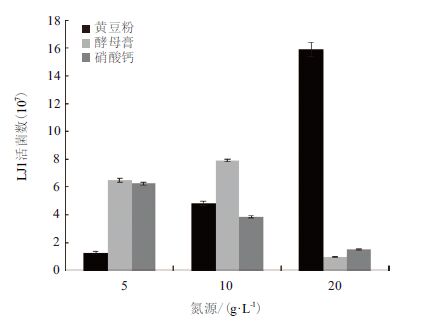
将各氮源加入无氮培养基中,结果显示B. amyloliquefaciens LJ1可利用氯化铵、牛肉浸膏、酵母膏、草酸铵、乙酸铵、尿素、硫酸铵、磷酸二氢铵、硝酸钙、黄豆粉为唯一氮源;不可利用钼酸铵、亚硝酸钠、硝酸钾。其中以黄豆粉、酵母膏和硝酸钙为氮源时B. amyloliquefaciens LJ1生长状态最好,培养基浑浊度较高。
所筛选的氮源就LJ1生长量而言,都有一个较为适合的浓度(图 3),硝酸钙适宜浓度为5 g/L,酵母膏适宜浓度为10 g/L,黄豆粉适宜浓度为20 g/L。比较而言,以有机氮源对LJ1的生长较为有利,尤其黄豆粉最为明显,其最大生长量达到1.59×108 CFU/mL,分别为前两者最大生长量的2.02倍和2.56倍。同为有机氮源,黄豆粉较酵母膏更适宜LJ1的生长,可能由于黄豆粉富含速效氮源和迟效氮源,以及碳水化合物和微量元素,更适宜细菌快速繁殖。因此,选择20 g/L的黄豆粉为最佳氮源。
|
| 图 3 氮源对菌株LJ1 生长量大小的影响 |
在PDA液体培养基中加入无机盐,摇菌后检测其菌量。结果(图 4)表明培养基中加入CuSO4·5H2O后菌株LJ1在培养基中生长极慢,说明Cu2+对解淀粉芽孢杆菌LJ1的生长有抑制作用,这与Cu2+使细菌蛋白变性有关。如图 4所示,MnSO4·H2O、MgCl2·6H2O、ZnSO4·7H2O、FeC6H5O7、FeCl3均能促进LJ1菌量的增长,且MgCl2·6H2O > MnSO4·H2O > ZnSO4·7H2O > FeC6H5O7 >FeCl3。研究中发现,当MgCl2·6H2O达到1.5 g/L时,其菌量较加入0.5 g/L和1.0 g/L有明显的跃升,为2.403×1010 CFU/mL。这一现象与镁离子参与细菌细胞质的合成,尤其对革兰氏阳性菌的生长繁殖影响较大有关[21]。因此,研究中选择1.5 g/L MgCl2·6H2O作为适宜浓度。
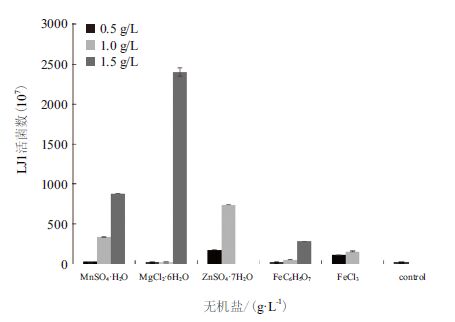
|
| 图 4 无机盐对LJ1 生长量(107)的影响 |
PDA液体培养基(优化前)为:马铃薯200 g,葡萄糖 20 g,蒸馏水 1 000 mL,初始pH7.0,28℃,200 r/min,装液量100 mL/250 mL。
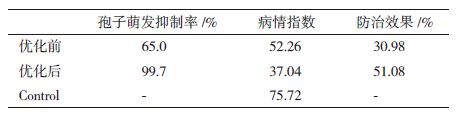
优化后为:马铃薯 200 g,蔗糖 10 g,黄豆粉20 g,MgCl2·6H2O 1.5 g,初始pH 5.0,30℃,200 r/min,装液量50 mL/250 mL。如表 5所示,经过优化B. amyloliquefaciens LJ1摇瓶发酵培养基成分和发酵条件后,发酵液对B. cinerea的抑制和防治效果都得到了显著提高。LJ1发酵液对B. cinerea孢子萌发的抑菌率从65.0%提高至99.7%;温室条件下对黄瓜灰霉病发生的防治效果从30.98%提高到51.08%。
B. amyloliquefaciens LJ1对 B. cinerea、G. cingul-ata、G. zeae、M. kuwastsukaii等11种病原真菌均有较好的抑菌效果。优化解淀粉芽孢杆菌发酵培养液及发酵条件不仅可以提高菌体的生长速度,还可以有效地提高抗菌活性物质的产量及防效[22, 23, 24]。对B. amyloliquefaciens LJ1发酵条件的研究表明,温度30℃、初始pH 5、转速200 r/min、装液量50 mL时,LJ1发酵液抑菌活性达到最高。其中,装液量和pH值对发酵液的抑菌效果影响较大。装液量与抑菌效果呈负相关,转速与抑菌效果呈正相关,说明解淀粉芽孢杆菌LJ1为好氧型细菌。这一结果暗示LJ1所产抑菌物质多少和菌体数量有相关性,通过提高溶解氧可以加速LJ1的生长,提高LJ1细胞生长量,从而缩短其进入次生代谢的时间,加快、加大次生代谢抑菌物质的产生。pH值主要通过影响菌体细胞膜渗透性及营养物质离子化程度来影响菌体对养分的吸收。实验发现LJ1菌株在初始pH 4的培养基中无法生长,而初始pH 5时效果最好,说明B. amyloliquefaciens LJ1适宜在偏酸性的环境中生长,过酸过碱均不利于它的生长,与Zhao等[25]的研究一致。
细菌菌体发酵过程中,延滞期和对数期主要进行菌体的繁殖,菌量大量增加,进入稳定期后菌量基本保持稳定,细菌次级代谢产物积累,常常在这个时期进行次级代谢产物的生产和检测。B. amyloliquefaciens LJ1在14-26 h处于稳定期,在26 h时菌量保持较高但略有下降,此时次生代谢物质较多,因此选择发酵26 h时进行抑菌能力检测。在不同培养条件下,菌量是次生代谢物质产生多少的一个重要前提条件[26],这与上述结果与分析相一致。研究中也发现,一些矿物质元素能提高发酵产物产量,尤以Mg2+最为明显,这和Mg2+是一些功能蛋白的重要辅酶因子有关,Mg2+可以提高其催化活性,加快代谢进程,提高抑菌活性[27]。
碳氮比是微生物发酵培养中关键的参数,它反映了培养基中碳、氮营养物质的浓度和两者的比率。众多研究发现,适宜的碳氮比是提高发酵活性物质含量和生物量的重要条件[28, 29, 30]。本研究中,氮源对生物量变化的影响尤其明显,分析认为主要是因为受到碳氮比率的影响所致。此外,由于培养基中没有目的性加入缓冲物质,不适宜的碳氮比也可能通过影响动态发酵过程中pH值来影响发酵生物量。
4 结论解淀粉芽孢杆菌LJ1有广谱的抑菌效果。优化后发酵条件为30℃、初始pH 5、转速200 r/min、装液量50 mL/250 mL,装液量和pH值对发酵液的抑菌效果影响较大。优化后的培养基成分为:马铃薯 200 g,蔗糖 10 g,黄豆粉20 g,MgCl2·6H2O 1.5 g,蒸馏水 1 000 mL。在优化条件下B. amyloliquefaciens LJ1发酵液对B. cinerea孢子萌发的抑制率从65.0%提高至99.7%;温室条件下对黄瓜灰霉病的防治效果从30.98%提高到51.08%。
| [1] | EPA. Regulating biopesticides[EB]. 2014-11-18. |
| [2] | 杨洪凤, 薛雅蓉, 余向阳, 等. 内生解淀粉芽孢杆菌CC09菌株在小麦叶部的定殖能力及其防治白粉病效果研究[J]. 中国生物防治学报, 2014, 30(4):481-488. |
| [3] | 裘纪莹, 黄玲玲, 陈蕾蕾, 等. 解淀粉芽孢杆菌NCPSJ7抑制青霉病病原菌及防治梨采后青霉病的效果[J]. 中国农学通报, 2014, 30(21):311-315. |
| [4] | Crane JM, Gibson DM, Vaughan RH, et al. Iturin levels on wheat spikes linked to biological control of fusarium head blight by Bacillus amyloliquefaciens[J]. Phytopathology, 2013, 103(2):146-155. |
| [5] | 张宝. 解淀粉芽孢杆菌抗菌脂肽 bacillomycin L的纯化鉴定及抑菌机理研究[D]. 北京:中国农业大学, 2014. |
| [6] | Arias AA, Ongena M, et al. Characterization of amyloly-sin, a novel lantibiotic from Bacillus amyloliquefaciens GA1[J]. PLoS One, 2013, 8(12):e83037. doi:10. 1371/journal. pone. 0083037. |
| [7] | Sun LJ, Lu ZX, Bie XM, et al. Isolation and characterization of a cop-roducer of fengycin and surfactins, endophytic Bacillus amyloliquef-aciens ES-2, from Scutellaria baicalensis georgi[J]. World Journal of Microbiology and Biotechnology, 2006, 22(12):1259-1266. |
| [8] | Arias AA, Ongena M, Halimi B, et al. Bacillus amyloliquefaciens GA1 as a source of potent antibiotics and other secondary metabolites for biocontrol of plant pathogens[J]. Microbial Cell Factories, 2009, 8:63 doi:10. 1186/1475-2859-8-63. |
| [9] | Cawoy H, Mariutto M, et al. Plant defense stimulation by natural isolates of Bacillus depends on efficient surfactin production[J]. Molecular Plant-Microbe Interactions, 2014, 27(2):87-100. |
| [10] | Yuan J, Ruan Y, Wang B, et al. Plant growth-promoting rhizobacte-ria strain Bacillus amyloliquefaciens NJN-6 enriched bio-organic fertilizer suppressed Fusarium wilt and promoted the growth of banana plants[J]. Journal of Agricultural and Food Chemistry, 2013, 61(16):3774-3780. |
| [11] | Idriss EE, Makarewicz O, et al. Extracellular phytase activity of Bacillus amyloliquefaciens FZB45 contributes to its plant-growth-promoting effect[J]. Microbiology, 2002, 148(7):2097-2109. |
| [12] | 刘京兰, 薛雅蓉, 等. 内生解淀粉芽孢杆菌CC09产 Iturin A 摇瓶发酵条件优化[J]. 微生物学通报, 2014, 41(1):75-82. |
| [13] | Tanyildizi MS, Elibol M,Özer D. Optimization of growth medium for the production of α-amylase from Bacillus amyloliquefaciens using response surface methodology[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(4):618-622. |
| [14] | Caldeira AT, Feio SS, Arteiro JMS, et al. Envitonmental dynamics of Bacillus amyloliquefaciens CCMI 1051 antifungal activity under different nitrogen patterns[J]. Journal of Applied Microbiology, 2008, 104(3):808-816. |
| [15] | 李文明, 谷医林, 王远宏, 等. 解淀粉芽孢杆菌LJ1对实验鼠的急性毒性研究[J]. 农药学学报, 2013, 15(4):434-438 |
| [16] | 谷医林, 王远宏, 常若葵, 等. 解淀粉芽孢杆菌LJ1诱导黄瓜抗白粉病的研究[J]. 农药学学报, 2013, 15(3):293-298. |
| [17] | 李青, 刘华梅, 等. 管碟法测定苏云金杆菌上清液中增效物质含量的研究[J]. 微生物学通报, 2002, 29(3):73-104. |
| [18] | 谷医林. 瓜类白粉病生防菌LJ1的鉴定和诱导抗病性研究及生物安全性评价[D]. 郑州:河南农业大学, 2013. |
| [19] | Herigstad B, Hamilton M, Heersink J. How to optimize the drop plate method for enumerating bacteria[J]. Journal of Microbiol Methods, 2001, 44(2):121-129. |
| [20] | 曹春娜, 石延霞, 李宝聚. 枯草芽孢杆菌可湿性粉剂防治黄瓜灰霉病药效试验[J]. 中国蔬菜, 2009(14):53-56. |
| [21] | Webb M. The influence of magnesium on cell division:the effect of magnesium on the growth of bacteria in simple chemically defined media[J]. Journal of General Microbiology, 1949:418-424 |
| [22] | Wang SL, Shih IL, et al. Purification and characterization of two an-tifungal chitinases extracellularly produced by Bacillus amylolique-faciens V656 in a shrimp and crab shell powder medium[J]. Agricultural and Food Chemistry, 2002, 50(8):2241-2248. |
| [23] | 权春善, 王军华, 徐洪涛, 等. 一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J]. 微生物学报, 2006, 46(1):7-12. |
| [24] | Yang TW, Rao ZM, Zhang X, et al. Fermentation of biodiesel-deriv-ed glucerol by Bacillus amyloliquefaciens:effects of cosubstrates on 2, 3-butanediol production[J]. Applied Microbiology and Biotechnology, 2013, 97(17):7651-7658. |
| [25] | Zhao J, Zhao P, Quan C, et al. Comparative proteomic analysis of antagonistic Bacillus amyloliquefaciens Q-426 cultivated under different pH conditions[J]. Biotechnology and Applied Biochemistry, 2014, doi:10. 1002/bab. 1293. |
| [26] | Vedaraman N, Venkatesh N. Production of surfactin by Bacillus subtilis MTCC 2423 from waste frying oils[J]. Brazilian Journal of Chemical Engineering, 2011, 28(2):175-180. |
| [27] | Sanders RL, May BK. Evidence for extrusion of unfolded extracellular enzyme polypeptide chains through membranes of Bacillus amyloliquefaciens[J]. Journal of Bacteriology, 1975, 123(3):806-814. |
| [28] | Kalil MS, Alshiyab HS, Yusoff WMW. Effect of nitrogen source and carbon to nitrogen ratio on hydrogen production using C. acetobutylicum[J]. American Journal of Biochemistry and Biotechnology, 2008, 4(4):393-401. |
| [29] | Touratier F, Legendre, Vézina A. Model of bacterial growth influenced by substrate C:N ratio and concentration[J]. Aquatic Microbial Ecology, 1999, 19:105-118. |
| [30] | Dinarvand M, Rezaee M, Masomian M, et al. Effect of C/N ratio and media optimization through response surface methodology on simultaneous productions of intra and extracellular inulinase and invertase from Aspergillus niger ATCC 20611[J]. BioMed Research International, 2013, doi:10. 1155/2013/508968. |