2.西安交通大学生命科学与技术学院,西安 710049
2. College of Life Science and Technology,Xi’an Jiaotong University,Xi’an 710049
辅酶Q(CoQ)是一种脂溶性醌类衍生物,呼吸链上的电子传递体[1]。人体中主要以CoQ10的形式存在[2],具有抗氧化、保护细胞膜完整、消除心血管治疗中他汀类药物导致的副作用等良好的生物学功能[3, 4],已成功地应用于线粒体相关的多种疾病的治疗、预防保健和化妆品等领域[5, 6, 7, 8, 9, 10, 11]。较之合成或提取法,微生物发酵法制备的CoQ生物活性高、无原材料限制、成本低无污染,成为CoQ生产的理想途径[12, 13]。但目前生产菌株缺乏,成为发酵生产的瓶颈,因此构建CoQ高产菌株是实现CoQ发酵生产的必由之路[14]。
目前微生物发酵法选育CoQ高产菌株主要通过诱变育种和代谢工程育种实现。诱变育种包括基因诱变[15]和抗终产物结构类似物诱变[16]。运用诱变手段虽然可使菌株发生突变,但目标性不明确,需要无数次的变异才能达到目的,周期比较长,而且容易发生回复突变。Red同源重组技术是代谢工程育种的一种新兴技术,可将一段抗性片段导入宿主菌细胞,利用λ噬菌体Red 重组酶的作用,使导入细胞的线性DNA 片段与染色体特定靶序列重组,靶基因被标记基因置换下来。
本研究基于Red同源重组技术,经L-阿拉伯糖诱导表达λ噬茵体的3个重组蛋白后,对pKD46 介导的大肠杆菌CoQ合成旁路途径[17, 18]的关键基因1,4-二羟基-2-萘酸八异戊烯基转移酶基因menA[19, 20]进行敲除,阻断旁路途径、积累侧链前体IPP,搜寻能提高菌株CoQ含量的有效途径,为日后构建CoQ高产菌株积累经验。
1 材料与方法 1.1 材料大肠杆菌DH5α由本实验室保存;pkD4、pkD46由军事医学科学院惠赠;10×PCR Buffer,10 mmol/mL dNTP,高保真Taq酶(10 U/μL),EB指示剂,6×loading buffer,DNA marker等均购自西安沃尔森;氨苄青霉素,卡纳霉素,罗红霉素,胰蛋白胨,琼脂糖,无水氯化钙,Tris,EDTA,酵母膏,琼脂粉,牛肉膏等均购自交大物资中心;快捷型琼脂糖凝胶DNA回收试剂盒,PCR纯化试剂盒,质粒提取试剂盒,基因组DNA提取试剂盒均购自大连宝生物。
1.2 方法 1.2.1 kanr片段扩增以pKD4质粒作为模板设计带有FRT位点的kan r基因引物,扩增kanr片段用于menA基因的敲除。上游引物为GATGGGGCTGAAAGGCCCCATTTTTATTGGCGCGTATTATGAGGAATTAGCCATGGTCC,下游引物为TTGTTAATTGATATTTGTCAGTTATGCTGCCCACTGGCTTAGTAGGCTGGAGCTGCTTC。PCR扩增条件:94℃预变性5 min;94℃变性30 s,58℃退火40 s,72℃延伸1 min10 s,35个循环;72℃延伸10 min。
1.2.2 menA基因的敲除活化大肠杆菌DH5α,OD600=0.2-0.4时用CaCl2法制备感受态细胞。利用热击法将pKD46转入感受态细胞,32℃复苏45 min,涂布于含青霉素(50 μg/mL)的LB平板上,32℃过夜培养。
挑选阳性克隆传代,加L-阿拉伯糖(终浓度为0.1%),继续培养至OD600=0.5-0.6,无菌条件下操作:冰浴15 min,4℃,2 500 r/min离心10 min,弃上清,分别用无菌水和500 μL 10%灭菌甘油冰上温和清洗,重复前操作,溶于500 μL 10%灭菌甘油得制备DH5α(pKD46)感受态细胞。将kanr片段电转化,电击参数为:25 μF,200 Ω,2.5 kV,5 ms。32℃孵育1 h,涂布于含青霉素(50 μg/mL)和卡那霉素(50 μg/mL)的LB平板上,32℃过夜培养[21]。挑取阳性单克隆,划线接种于含氨苄青霉素和卡那霉素的LB平板上,转接2次,验证其遗传稳定性。
1.2.3 E.coli[menA]菌株的验证分别以稳定传代的E.coli[menA]和E.coli原始菌株基因组为模板,PCR扩增验证menA基因是否被敲除。上游验证引物:ATGGCAGGTGAACGAATC;下游验证引物1:CCATTTCCCGCATCACAT,下游验证引物2:CAGTCATAGCCGAATAGC;PCR扩增条件同前,退火温度改变为56.9℃。
1.2.4 大肠杆菌中CoQ的提取纯化制备流程:发酵液→4 000 r/min离心20 min收集菌体→真空冷冻干燥后称重→90℃醇碱皂化30 min,同时加入焦性没食子酸防止CoQ被氧化→石油醚萃取2次→超纯水洗至pH7.0→无水Na2SO4干燥→-20℃冷冻1 h→过滤除杂→旋转蒸发仪干燥→10 mL无水乙醇定容→低温保存待用。
1.2.5 menA基因敲除对CoQ种类和含量的影响测定 1.2.5.1 CoQ10标准曲线的绘制CoQ10标准曲线制备过程如下:配制0.2 mg/mL的CoQ10标准品溶液,分别稀释成5、10、15、20、25和30 μg/mL浓度,在275 nm处紫外检测其吸收值[22]。
1.2.5.2 HPLC方法验证CoQ种类为了检测基因敲除后是否造成CoQ种类的改变,在CoQ提取纯化基础上,对各菌株的提取液进行了HPLC检测,以大肠杆菌DH5α提取液作为CoQ8的保留时间标准对照。实验参数[23, 24]为:色谱柱为Agilent XDB-C18(4.6 mm×150 mm);流动相为95%无水乙醇:5%甲醇;流速l mL/min;检测波长275 nm;温度25℃;进样量20 μL。
1.2.5.3 menA基因敲除对CoQ含量的影响测定实验以M9培养基作为基础培养基,需要情况下加入卡那霉素50 μg/mL,培养至对数中期(13 h),提取纯化CoQ,采用紫外分光光度计法测定menA基因敲除菌株E.coli[menA]的CoQ含量,以出发菌株E.coli为对照。
1.2.6 紫外线诱变对CoQ含量的影响 1.2.6.1 菌悬液制备分别取10 mL培养至对数期的发酵液于6个无菌离心管中,4 000 r/min离心10 min,弃上清,收集菌体,沉淀用10 mL生理盐水洗涤离心2次。
1.2.6.2 紫外线诱变紫外灯预热15 min,取6组菌悬液各0.1 mL注入LB平板中,涂布均匀。紫外灯照射条件:15 W,30 cm,照射时间分别为15、30、45、60、75、90 s,整个过程在暗室中完成。未经照射的平板作为对照,每组3个平行。照射后立即取出,暗室中37℃培养24 h。将处理好的菌悬液做适当稀释,将细胞浓度控制在107-108个/mL。
1.2.6.3 初筛根据致死率曲线,取对菌株致死率为70%-80%的处理时间进行诱变[25]。吸取0.1 mL菌悬液涂布于罗红霉素筛选平板上,进行紫外照射。挑选长势好的菌株进行复筛。
1.2.6.4 复筛经初筛挑选的突变株,种子液中过夜培养,按2%的接种量转入发酵培养液,37℃ 180 r/min摇床培养至对数期,按方法1.5提取COQ,采用紫外分光光度计法测定突变菌株CoQ含量。
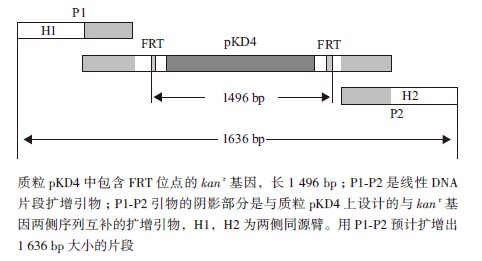
2 结果 2.1 kanr线性片段的扩增设计kanr基因的扩增引物,以pKD4质粒为模板进行PCR。带有FRT位点的kanr基因净长1 496 bp,加上两端外延部分及menA基因同源臂共长1 636 bp(图 1),凝胶电泳结果(图 2)显示扩增产物与理论长度相符。
|
| 图 1 kanr 基因片段扩增引物设计示意图 |

|
| 图 2 kanr 线性片段扩增结果 |
抗性筛选结果显示,对照组由于kan r基因未转入,平板上没有菌株生长;而转入kan r基因的平板上有单菌落出现。以初步认为此菌落是kan r基因重组成功菌株。从上述平板B中挑取阳性菌落,将单克隆接种于含氨苄青霉素、卡那霉素的LB培养基上传代培养,发现其遗传稳定性良好。
将筛选到的目的菌株稀释涂布接种在卡那霉素单抗培养基上,42℃过夜消除pKD46。将42℃下形成的单菌落分别接种于卡那霉素单抗培养基和氨苄青霉素、卡那霉素双抗性培养基上验证抗性,选取在卡那霉素培养基上生长良好而氨苄青霉素、卡那霉素双抗性培养基无法生长的菌种,视为pKD46消除的E.coli[△menA]候选菌株进行进一步验证。
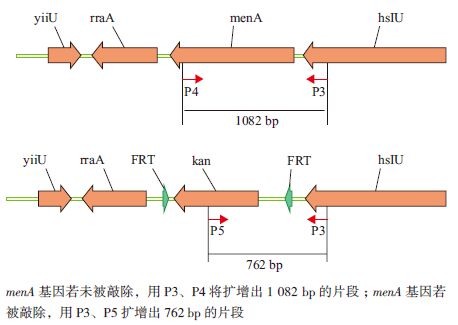
2.3 E.coli[△menA]重组子验证选取pKD46质粒消除的待验证E.coli[△menA]候选菌株,提取基因组DNA,用设计的两对引物P3-P4和P3-P5分别对menA 基因敲除前后的菌株进行PCR扩增,引物扩增到762 bp片段说明menA基因被kanr敲除,若用P3-P4引物扩增到1 082 bp片段说明menA基因未被敲除。
|
| 图 3 E.coli[△ menA]菌株PCR 验证示意图 |
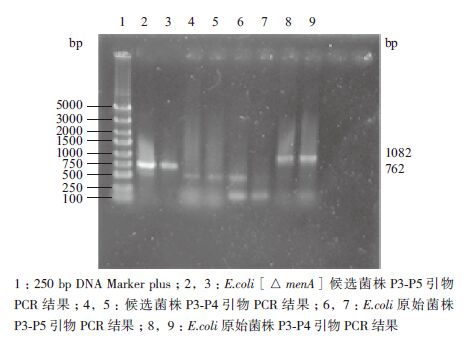
扩增产物电泳结果(图 4)显示,第2-5泳道为E.coli[△menA]候选菌株PCR结果,当用P3-P4引物扩增时,未能扩增得到理论上的1 082 bp menA基因片段,说明menA基因不存在。当用P3-P5引物扩增时,获得了762 bp的片段,与理论上推测的kanr替换menA结果一致,说明敲除成功。对照组E.coli菌株PCR结果(泳道6-9)显示,P3-P4引物可以和E.coli菌株基因组模板特异结合,PCR产物大小为1 082 bp(泳道8,9);而P3-P5引物扩增的结果是无特异性条带生成(泳道6,7)。通过menA 基因敲除前后菌株特异PCR产物的鉴定,认为实验构建菌株即为E.coli[△menA]菌株,此构建工作已顺利完成。
|
| 图 4 E.coli[△ menA]重组子PCR 验证结果/span> |
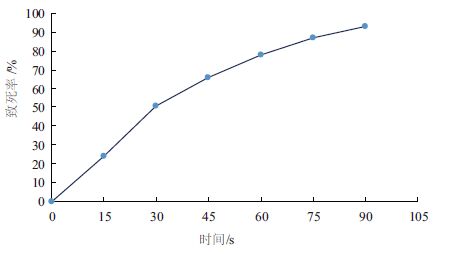
紫外诱变大肠杆菌的致死率曲线如图 5,随着紫外照射时间延长,大肠杆菌致死率提高,当紫外诱变时间为60 s时,致死率达到78%。下一步对紫外诱变60 s的正突变菌株进行研究。
|
| 图 5 紫外诱变大肠杆菌的致死率曲线 |
取稀释好的菌悬液涂于初筛培养基平板上,紫外处理60 s,37℃培养24 h,得突变菌落17株,挑选单菌落保存于斜面培养基,摇床复筛,测定突变株COQ产量。
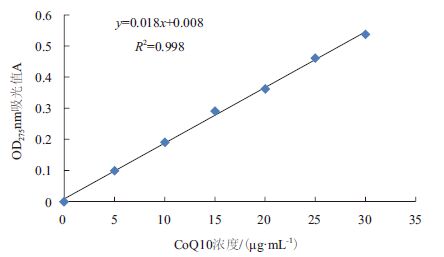
2.5 menA基因敲除与紫外诱变对CoQ的影响测定 2.5.1 CoQ10标准曲线的绘制用无水乙醇配制不同浓度的CoQ10标准品溶液,OD275nm处检测其吸光值,标准曲线如图 6。以CoQ10质量浓度(x)为横坐标,吸光度(y)为纵坐标进行回归计算,得回归方程为y=0.018x+0.008,相关系数R2=0.998。
|
| 图 6 CoQ10 标准曲线 |
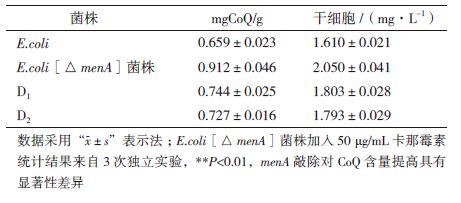
采用紫外分光光度计法分别测定menA基因敲除菌和突变株的CoQ含量,结果如表 1所示,紫外诱变产生2株正突变株(编号为D1,D2),CoQ含量都有不同程度的提高,但相比于menA基因敲除菌,CoQ含量提高不大,故选定menA基因敲除菌作为候选菌株进一步研究。
测定结果表明,menA敲除菌株在相同条件下,比出发菌CoQ含量明显提高,提高幅度约为38%。
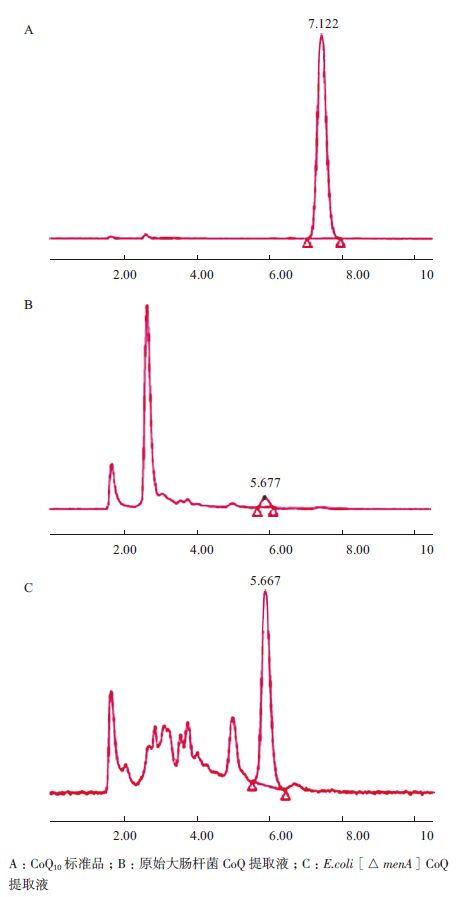
2.5.3 CoQ种类验证分别以CoQ10标准品和原始大肠杆菌DH5α CoQ提取液作为CoQ8对照,对menA基因敲除菌CoQ提取物进行了HPLC定性鉴定(图 7)。从图 7可以看出,CoQ10标准品保留时间为7.1 min,原始大肠杆菌CoQ8提取液保留时间为5.6 min,根据保留时间可以判断大肠杆菌menA基因敲除菌CoQ提取物中为CoQ8。
|
| 图 7 大肠杆菌menA 基因敲除菌CoQ 提取液的HPLC 鉴定图(保留时间min) |
维生素K2又称甲基萘醌,也是一种芳香族醌类化合物,与CoQ拥有相同的底物分支酸和聚异戊烯长链。大肠杆菌维生素K2的合成途径涉及到6个特定的基因,依次为menA,menB,menC,menD,menE和menF。分支酸先在menF编码的分支酸异构酶作用下变成异分支酸,然后在menD、menC、menB和menE基因编码的相应酶作用下生成1,4-二羟基-2-萘酸,最后在menA基因编码的1,4-二羟基-2-萘酸八异戊烯基转移酶作用下发生链环缩合,1,4-二羟基-2-萘酸和聚异戊烯长链连接成维生素K2。其中,menA基因编码的酶是维生素K2合成过程中的限速酶。大肠杆菌既产CoQ又产维生素K2,因此可在兼性厌氧条件下生长。维生素K2作为大肠杆菌在厌氧条件下替代CoQ的电子传递载体,在好氧条件下并非细菌正常生长所必需的物质。因此敲除menA基因可以使维生素K2合成底物聚异戊烯长链积累,使得CoQ合成前体增加,使反应向CoQ合成的方向流动。同时维生素K2和CoQ都是脂溶性的膜定位活性物质,抑制维生素K2的合成还可以留给CoQ更多的膜空间。加拿大学者Corinne在加拿大工业微生物学会年会摘要中报道了与本研究相似的大肠杆菌旁路基因敲除思路[20],但尚未见研究结果报道。本实验首次对menA基因进行了敲除,并对其积累CoQ的能力进行了测定,与预期结果相符,在丰富CoQ高产菌株的构建方面具有重要意义。menA基因敲除相较于紫外诱变方法稳定性好,无回复突变,可短时间内定向改造菌种,提高目标产物量。
在此基础上,可增加COQ合成过程中关键酶的表达提高COQ产量[26, 27, 28]。华东理工大学叶江等[29, 30]对大肠杆菌UbiCA强化表达来提高COQ合成能力。改变COQ10合成途径[31]主要包括两个方面:通过重组聚十异戊二烯合成酶使大肠杆菌合成COQ10;将真核生物合成IPP的甲羟戊酸途径重组入大肠杆菌,使IPP供应能力加强。将脱氮副球菌的dps基因重组入大肠杆菌,使其获得合成CoQ10的能力;或将酵母合成聚十异戊二烯的ispB基因与大肠杆菌的ubiA基因在大肠杆菌中共表达,使CoQ10产量提高。华南理工大学李家洲等[32]将放射型根瘤菌ddsA基因替换大肠杆菌ispB基因并强化CoQ合成关键酶来提高CoQ10产量。要想获得理想的代谢工程COQ生产菌株,应进行系统代谢通量分析,确定修饰和改造的靶点,多点协同改造。Xu[33]、刘建忠等[34, 35]通过多基因策略、染色体工程改造大肠杆菌高效生产CoQ10取得了一定的效果。
发酵工艺优化方面,有意识的控制培养基的溶氧或氧化还原电位,或在培养基中添加抑制呼吸作用的叠氮化合物,控制相对较高的pH值,都有助于提高COQ的产量。另外采取边生产边萃取[36]的方法有助于降低生产过程中COQ对自身合成的反馈调节。江南大学金赛等[37]通过根癌土壤杆菌产辅酶Q10的补料分批发酵工艺使CoQ10产量得到大幅提高。总之,要实现COQ的工业化生产,应从多方面入手:生物合成途径的探讨、高产COQ大肠杆菌的构建、高产菌株的选育、发酵工艺的优化以及COQ提纯检测等下游技术的研究。
4 结论首次成功敲除menA基因,大肠杆菌CoQ产量增加约38%,种类不变,达到预期目标。
| [1] | Nohl H, Gille L. The bifunctional activity of ubiquinone in lysosomal membranes[J]. Biogerontology, 2002, 3(1-2):125-132. |
| [2] | Cluis CP, Burja AM, Martin VJ. Current prospects for the production coenzyme Q10 in microbes[J]. Trends in Biotechnology, 2007, 25(11):514-521. |
| [3] | Kawamukai M. Biosynthesis, bioproduction and novel roles of ubiquinone[J]. J Biosci Bioeng, 2002, 94(6):511-517. |
| [4] | Gille L. The Existence of a Lysosomal Redox Chain and the Role of Ubiquinone[J]. Archives of Biochemistry and Biophysics, 2000, 375(2):347-354. |
| [5] | Lenaz G, Fato R, Formiggini G, et al. The role of Coenzyme Q in mitochondrial electron transport[J]. Mitochondrion, 2007, 7:S8-S33. |
| [6] | Bentinger M, Dallner G, Chojnacki T, et al. Distribution and breakdown of labeled coenzyme Q10 in rat[J]. Free Radic Biol Med, 2003, 34(5):563-575. |
| [7] | Nohl H, Staniek K, Kozlov V, et al. The biomolecule ubiquinone exerts a variety of biological functions[J]. BioFactors, 2003, 18(14):23-31. |
| [8] | Mizuno K, Tanaka M, Nozaki S, et al. Applied nutritional investigation Antifatigue effects of coenzyme Q10 during physical fatigue[J]. Nutrition, 2008, 24:293-299. |
| [9] | Crane FL. Discovery of ubiquinone(coenzyme Q)and an overview of function[J]. Mitochondrion, 2007, 7S:S2-S7. |
| [10] | Turunen M, Olsson J, Dallner G. Metabolism and function of coenzyme Q[J]. Biochim Biophys Acta, 2004, 1660(1-2):171-199. |
| [11] | 文涵. 辅酶Q10可减缓帕金森病的发展[J]. 国外医学情报, 2004, 25:17. |
| [12] | 黄伟, 徐建忠, 冯晓亮. 辅酶Q10研究新进展[J]. 河南化工, 2003(2):12-15. |
| [13] | 张楠, 曹玉成. 辅酶Q10制备方法研究进展[J]. 榆林学院院报, 2006, 16(6):12-14. |
| [14] | 王智文, 马向辉, 陈洵, 等. 大肠杆菌CoQ10的代谢工程研究进展[J]. 化工进展, 2009, 28(5):855-863. |
| [15] | 朱俊丰, 郑方亮, 艾海新, 等. 微波结合紫外诱变选育辅酶Q10高产菌株[J]. 微生物学杂志, 2010, 30(2):57-62. |
| [16] | 李继扬, 丁妍, 周佩. 通过耐受前体或结构类似物筛选提高辅酶Q10产量[J]. 复旦学报:医学版, 2008, 35(3):293-395, 400. |
| [17] | Meganathan R. Biosynthesis of menaquinone(Vitamin K2)and ubiquinone(coenzyme Q):a perspective on enzymatic mechanisms[J]. Vitam Horm, 2001, 61:173-218. |
| [18] | Ronald Bentley, Meganathan R. Biosynthesis of vitamin K(Menaquinone)in bacteria[J]. Microbiological Reviews, 1982, 46(3):241-280. |
| [19] | Dahm C, Mueller R, Schulte G, et al. The role of isochorismate hydroxymutase genes entC and menF in enterobactin and menaquinone biosynthesis in Escherichia coli[J]. Biochimica et Biophysica Acta, 1998, 1425:377-386. |
| [20] | Vincent J, Cluis C. Engineering E. coli for coenzyme Q10 production:poster session2. SIM Annual Meeting and Exhibition of Society for Industrial Microbiology[C]. San Diego, 2008. |
| [21] | 韩聪, 张惟材, 游松. Red同源重组技术研究进展[J]. 中国生物工程杂志, 2003, 23(12):17-21. |
| [22] | Tripodi V, Flor S, Contin M. Simple, Highly sensitive micro HPLC method for the determination of coenzyme Q10 and its major related substances[J]. Journal of Liquid Chromatography & Related Technologies, 2009, 32:860-873. |
| [23] | Seo MJ, Im EM, Nam JY, et al. Increasse of CoQ10 Production level by the coexpression of decaprenyl diphosphate synthase and 1-deoxyd-xylulose 5-phosphate synthase isolated from Rhizobium radiobacter ATCC 4718 in Recombinant Escherichia coli[J]. Microbiol Biotechnol, 2007, 17(6):1045-1048. |
| [24] | Choi GS, Kim YS. Restricted electron flux increases coenzyme Q10 production in Agrobacterium tumefaciens ATCC4452[J]. Process Biochemistry, 2005, 40:3225-3229. |
| [25] | 曹燕妮, 岳田利, 袁亚红. 辅酶Q10高产菌株的诱变选育[J]. 食品科学, 2012(11):121-125. |
| [26] | 林丹枫, 李力, 柯崇榕, 等. 辅酶Q10的生物合成及其高表达研究进展[J]. 生物技术通讯, 2012, 23(3):465-469. |
| [27] | 孔卓怡, 钟莉, 邱乐泉, 等. 基因工程策咯强化生物法生产CoQ10研究进展[J]. 黑龙江科学, 2013, 7:45-47. |
| [28] | 邵庆伟, 柯崇榕, 杨威, 等. 辅酶Q10的微生物合成[J]. 生命的化学, 2013, 33(2):91-95. |
| [29] | 叶江, 马林, 吴海珍, 等. ubiCA基因的强化表达及对大肠杆菌辅酶Q生物合成的影响[J]. 华东理工大学学报:自然科学版, 2006, 32(3):269-273. |
| [30] | 傅楠, 叶江, 吴海珍, 等. 基因替换及多基因共表达强化大肠杆菌辅酶Q10的合成能力[J]. 华东理工大学学报:自然科学版, 2008, 34(5):654-659. |
| [31] | 李家洲, 张冬青, 肖玉平, 等. 辅酶Q10生物合成与生产研究进展[J]. 生物技术通报, 2011(10):37-42. |
| [32] | 李家洲, 谢明权, 李安兴, 等. 产辅酶Q10大肠杆菌工程菌的构建[J]. 华南理工大学学报:自然科学版, 2012, 40(5):90-95. |
| [33] | Xu W, Yang S, Zhao J, et al. Improving coenzyme Q8 production in Escherichia coli employing multiple strategies[J]. J Ind Microbiol Biotechnol, 2014, 41(8):1297-303. |
| [34] | Huang MT, Wang Y, Liu JZ, et al. Multiple strategies for metabolic engineering of Escherichia coli for efficient prodution of coenzyme Q10[J]. Chinese Journal of Chemical Engineering, 2011, 19(2):316-326. |
| [35] | Huang MT, Chen YY, Liu JZ, et al. Chromosomal engineering of Escherichia coli for efficient prodution of coenzyme Q10[J]. Chinese Journal of Chemical Engineering, 2014, 22(5):559-569. |
| [36] | Zhong WH, Fang JJ, Liu HG, et al. Enhanced production of CoQ10 by newly isolated Sphingomonas sp. ZUTEO3 with a coupled fermeantation-extraction process[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(5):687-693. |
| [37] | 金赛, 徐俭, 张梁, 等. 根癌土壤杆菌产辅酶Q10的补料分批发酵工艺[J]. 过程工程学报, 2011, 11(1):113-116. |