2.大连民族大学生命科学学院,大连 116600
2. College of Life Science,Dalian Nationalities University,Dalian 116600
酿酒酵母(Saccharomyces cerevisiae)是一类被广泛应用的生产菌株,同时也是真核模式生物。它的非病原性以及用于生产消费性产品(乙醇、面包等)的长久历史激发了人们对该微生物的研究兴趣,同时它是公认安全(generally regarded as safe,GRAS)的微生物。Saccharomyces cerevisiae发酵的最适温度在28-33℃,一般不超过36℃。在发酵过程中,高温会使蛋白变性,也会引起质膜流动性的变化,如高温使磷脂分子在膜内作快速的侧向扩散,使膜脂的流动性增加,破坏膜的完整性,从而导致细胞的存活力迅速下降[1, 2, 3]。
自从 1962 年 Ritossa 首次在果蝇中发现热激现象(Heat shock)后,便成为研究酵母耐热机制的一个重要领域。陆续有研究发现酿酒酵母经不同程度的热激后会产生不同种类热激蛋白(Heat shock proteins,HSP),酵母耐热机制的研究则主要以热激蛋白及生物耐热性为中心。由于酵母的耐热机制非常复杂,其研究方法也从经典的遗传学方法过渡到了分子生物学技术。最近几年,已知的参与热耐受的分子有热激蛋白[4]、海藻糖[5]、应激糖蛋白、膜结合 ATP 酶等,这些因素都在酵母耐热机制中扮演着重要角色。
Saccharomyces cerevisiae在发酵过程中要经受一系列的环境胁迫,如高温、高糖以及不断积累的乙醇,所有的这些胁迫条件都会影响细胞的生长速率和活性。当细胞经受这些胁迫时,复杂的生物代谢网络中会发生一系列动态的变化:包括基因、蛋白和代谢物等的变化[6],以尽快的适应周围变化的环境。
Saccharomyces cerevisiae的碳代谢途径主要为糖酵解(EMP)途径和戊糖磷酸(HMP)途径,与之相关的酶系分布在线粒体、内质网、液泡、细胞质膜及细胞壁上,其代谢调节及其复杂。研究表明与糖酵解有关的果糖-1,6-二磷酸激酶(Fructose-1,6-bisphosphatase),苹果酸脱氢酶(Malate Dehydrogenase)等酶在细胞壁中发挥作用[7]。鉴于此本研究利用蛋白质组学技术考察高温对Saccharomyces cerevisiae细胞壁蛋白质的影响。
1 材料与方法 1.1 材料实验菌种:Saccharomlyces cerevisiae FFC2146,由大连工业大学菌种保藏所提供。培养基:YPD培养基(1%酵母提取物,2%蛋白胨,2%葡萄糖)。实验所用试剂:Chaps,IAM,DTT,IPG两性电解质来自Sigma公司;ASB-14为CALBIOCHEM公司;过硫酸铵,尿素为优级纯;其他试剂均为分析纯。
1.2 方法 1.2.1 驯化培养从保藏的斜面上接取Saccharom-lyces cerevisiae FFC2146至20 mL培养基中好氧条件过夜培养,经过两次活化制成种子液。按2%接种量接入YPD培养基,分别在28℃和37℃下160 r/min驯化培养,每隔24 h,取1 mL菌液稀释测600 nm处的吸光值,至28℃和37℃两温度的吸光度值基本一致,即生长速度基本相同为止。
1.2.2 酿酒酵母培养驯化培养后的菌株在对数期按2%接种量接入100 mL培养基中,培养条件为160 r/min,28℃和37℃。做出酿酒酵母正常生长温度28℃和对照温度37℃时的生长曲线。
1.2.3 酵母细胞扫描电镜观察活化单菌落,接种1 mL种子液培养至稳定期,分别于28℃和37℃下以160 r/min进行24 h的振荡培养后10 000×g 离心10 min收集细胞。离心后的菌体用超纯水洗涤两次,再次离心得酵母菌体,烘干、制片后用扫描电镜观察。
1.2.4 胞壁结合蛋白的提取采用DTT抽提结合苯酚萃取法[8]。取28℃第15代与37℃第15代20 h发酵液于4℃,10 000×g离心,收集细胞沉淀。用50 mmol/L Tris-HCl缓冲液清洗3次。用含有DTT,PMSF的上述缓冲液于冰浴中振荡2 h后离心收集上清。上清液中加入等体积的Tris-平衡酚(pH8.0)冰浴振荡萃取1 h后离心收集酚相与中间层。该液体加入3倍体积的预冷的乙酸铵/甲醇溶液,于-20℃冰箱中静置过夜。第2天离心后,用含有DTT的丙酮清洗2次,再用冷丙酮清洗1次,冻干得到蛋白干粉。
1.2.5 双向电泳技术双向电泳的操作在季杨杨[9]的方法上进行了改进。分装蛋白:将得到的蛋白干粉用适量的蛋白裂解液(8 mol/L尿素、3 mol/L硫脲、50 mmol/L DTT、2% ASB-14、4% IPG buffer pH 3-10)溶解,用Bradford[10]方法测定蛋白质含量,每管100 μg分装。
双向电泳:将0.64 g尿素、560 μL双蒸水、250 μL 30%丙烯酰胺溶液混匀超声除气3 min,加入24 μL IPG buffer pH4-6、12 μL IPG buffer pH3-10混匀超声除气3 min,再加入4 μL10%过硫酸铵溶液、5 μL TEMED溶液,用1 mL枪反复吸打混匀,缓慢注入胶管中,室温聚合45 min后使用。阴极缓冲液为30 mmol/L NaOH溶液,阳极缓冲液采用10 mmol/L H3PO4溶液,阴极上样,以300 V 35 min,700 V 1 h,1 600 V 4 h进行第一向等电聚焦。
等电聚焦结束后,将胶条挤出进行两次胶条平衡,每次15 min。平衡液1(挤出平衡液加0.4%DTT 200 μL),平衡液2(基础平衡液加1%碘乙酰胺500 μL)。平衡结束后,进行第二向SDS-PAGE电泳,将平衡好的胶条放置在提前制好的15%的分离胶上,在转移胶条的过程中要尽量避免产生气泡。电泳条件为20 mA 20 min,50 mA电流至电泳结束。二维电泳结束后,将凝胶固定过夜,次日用考马斯亮蓝染色液染色,直至凝胶上蛋白点清晰可见。染色后的凝胶用扫描仪照相,利用PDquest8.0软件对蛋白点进行差异性分析。
1.2.6 质谱分析 1.2.6.1 前期酶解用去尖的枪头从胶上切下蛋白点后清洗,加入50%乙腈/0.2 mol NH4HCO3(pH8.0)进行脱色,用100%ACN进行脱水,冻干后的胶加入胰蛋白酶溶液进行酶解。
1.2.6.2 质谱样品制备向吸涨后的胶块加入不含胰蛋白酶的50 mmol NH4HCO3缓冲液,放置在37℃培养箱反应过夜。离心后,取出上清转移至加入了60%CH3CN/5 %TFA的新管中;在沉淀中加入超纯水,孵化10 min,离心移出上清与前一管上清液混合;再向沉淀中加入60% ACN/0.1%TFA超声15 min,吸出溶液并入前次上清,反复抽提2次,将所得上清用真空离心浓缩仪干燥5 min,放入-80℃冰箱中过夜。次日冻干后-80℃保存。
1.2.6.3 质谱分析利用Q Exactive质谱进行鉴定。色谱条件:富集柱:C18(100 μm×2 cm),分析柱C18(75 μm×15 cm,2 μm),流动相a:98%H2O+2%CH3CN+0.1%TFA,流动相b:20%H2O+80%CH3CN+0.1%TFA,柱温35℃,流速0.25 μL/min。质谱条件:喷雾电压2.5 kV,离子源温度300℃,扫描范围:m/z=300-2 000。然后利用Xcalibue软件和NCBI等相关数据库搜索比对,再利用KEGG将鉴定出的蛋白进行代谢流分析。
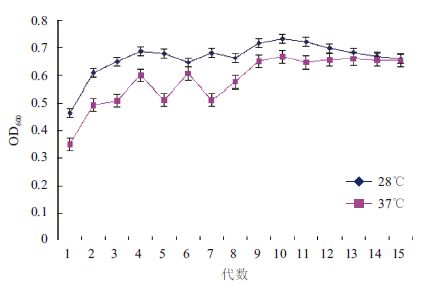
2 结果 2.1 驯化结果传统酿酒酵母的最适温度在 28-33℃,一般不超过 36℃,40℃以上将严重抑制菌体生长[1]。首先对Saccharomlyces cerevisiae FFC2146进行了耐温驯化。由图 1可知,Saccharomlyces cerevisiae FFC2146在37℃驯化前期其生长速度明显低于28℃的,但随着驯化时间的延长(第15代),两个培养温度下菌体生长速度基本一致。将驯化的菌株作为种子液,分别在28℃和37℃下进行培养,两者均在20 h达到最大生长量,且菌体浓度相近(图 2);扫描电镜分析表明,经过驯化培养的酿酒酵母菌株在28℃与37℃下外观形态无明显变化,细胞完整(图 3),说明Saccharomlyces cerevisiae FFC2146经驯化后细胞生长及形态依然保持良好的状态。
|
| 图 1 酿酒酵母FFC2146 耐热驯化结果 |

|
| 图 2 酿酒酵母FFC2146 生长曲线 |

|
| 图 3 28℃(A)和37℃(B)FFC2146 酿酒酵母的扫描电子显微镜图 |
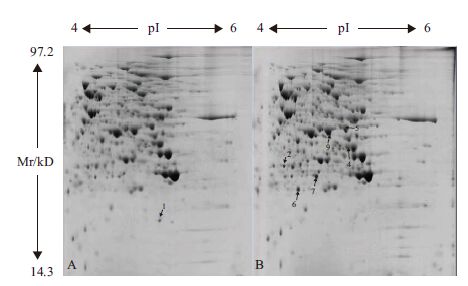
图 4为在28℃与37℃培养温度下酿酒酵母细胞壁蛋白质的双向电泳图谱。利用PDquest软件进行检测,分别检测到539个蛋白斑点和540个蛋白点,两者胞壁蛋白质大多聚集在pH4-6的区域,分子量分布在30-90 kD之间。由于细胞壁蛋白的糖基化造成分子量不均,因此在图谱上可见较为清晰的横向拖尾,但图谱的重复率(97.1%)比较好,灵敏度比较高,不影响图谱的进一步分析。当外界环境改变时,生物体合成一系列响应蛋白,以适应环境变化,酿酒酵母在37℃培养时,新增2个(No.6、7);消失1个(No.1);上调2个(No.2、3);下调2个(No.4、5),可见在不同温度下胞壁蛋白的数量和表达量没有明显变化。
|
| 图 4 正常生长温度28℃(A)与高温37℃(B)条件下的酿酒酵母FFC2146 胞壁蛋白双向电泳图 |
根据上述双向电泳图谱分析的结果,选取1-7号蛋白质斑点进行了质谱鉴定,结果如表 1所示。
大多数生物体在受到高温刺激时,首先会合成进化上高度保守的热休克蛋白(Heat shock proteins),关闭某些正常的代谢途径保护自身的同时开启另一代谢途径,以保护细胞继续生长繁殖。当细胞受到胁迫时,细胞内热休克蛋白HSP70与热激蛋白转录因子(Heat shock factor 1,HSF1)分离,HSF1迅速识别并结合至热激元件(Heat shock element,HSE,5'-NGAAN-3')[11]启动分子伴侣的转录,分子伴侣结合至未折叠的蛋白质,阻止折叠错误的发生。HSP70等热休克蛋白结合至锌指转录因子(MSN2/MSN4),MSN2/MSN4调控多个代谢胁迫应答有关的基因,防止细胞内的蛋白质受到高温影响时产生沉淀,减少由蛋白酶体和溶酶体造成的不稳定蛋白的水解降解[12],从而使环境的不利影响降到最低限度[13]。然而热胁迫首先会影响细胞壁及细胞膜的结构与功能,质谱鉴定结果表明Saccharomlyces cerevisiae FFC2146受到热胁迫后胞壁中出现了Ssa2蛋白。Ssa2属于热休克蛋白70家族,在正常生长环境中,调控基因Ssa2的表达处于休眠水平,Saccharomlyces cerevisiae FFC2146细胞壁中起到“管家”功能[14]。Saccharomlyces cerevisiae FFC2146新增的Ssa2蛋白不仅帮助保护细胞免受应激力的不利影响[15],还参与真菌细胞壁的生物合成和蛋白质的跨膜转运,使酵母细胞在高温下保持完整细胞形态及细胞膜的转运功能。
3.2 无机焦磷酸酶调节糖酵解途径流向在酿酒酵母中,无机焦磷酸酶(Inorganic pyrophosphatase,PPase,EC3.6.1.1)由基因IPP1的编码,该酶在控制生物体内无机焦磷酸浓度过程中起重要的作用。它催化一分子的焦磷酸脂转化成两分子正磷酸盐离子[16]。图 4、表 1可见Saccharomlyces cerevisiae FFC2146受到热胁迫后细胞壁中的无机焦磷酸酶活性显著提高,研究表明无机焦磷酸酶在催化焦磷酸水解的同时能够提高细胞耐受非生物胁迫的能力[17]。焦磷酸水解是一个高放能的反应,因此该反应可以偶联到一些不利于生物转化的过程中,推动热力学平衡向生物合成方向进行[18]。无机焦磷酸酶参与氧化磷酸化反应,可以控制体内ATP的生成,从而调节糖酵解途径流向[19]。
酿酒酵母的碳代谢途径主要为糖酵解(EMP)(88%)途径和戊糖磷酸(HMP)(12%)途径(图 5),与之相关的酶系分布在线粒体、内质网、液泡、细胞质膜及细胞壁上,其代谢调节比较复杂。研究表明与糖酵解有关的果糖-1,6-二磷酸激酶(Fructose-1,6-bisphosphatase),苹果酸脱氢酶(Malate dehydrogenase)、异柠檬酸裂解酶(Isocitrate lyase)、磷酸烯醇式丙酮酸烯醇酶(Phosphoenolpyruvate Carboxykinase)、甘油醛-3-磷酸脱氢酶(Glycerald-ehyde-3-phosphate Dehydrogenase)、亲环蛋白(Cycl-ophilin)等酶在细胞壁中发挥作用[20]。EMP途径中有三个不可逆反应步骤,分别由己糖激酶、磷酸果糖激酶和丙酮酸激酶(Pyruvate kinase,PK)参与。EMP途径中三个关键酶之一的丙酮酸激酶是EMP途径最后一个关键步骤,即磷酸烯醇式丙酮酸的磷酰基团在PK的作用下,转移到ADP上形成ATP,相应地磷酸烯醇式丙酮酸转化为丙酮酸。蛋白质解析结果可见高温胁迫下Saccharomlyces cerevisiae FFC2146的丙酮酸激酶表达关闭,说明EMP途径受阻,其上游的6-磷酸葡萄糖酸脱氢酶,3-磷酸甘油醛脱氢酶等酶的表达量亦下调。导致能量生成链的中间产物5-磷酸核酮糖和1,3-二磷酸甘油酸等合成减少。3-磷酸甘油醛脱氢酶已被鉴定为细胞壁的组成性蛋白[21],1,3-二磷酸甘油酸合成受阻,导致糖酵解途径中第一次底物水平磷酸化反应被破坏。受高温胁迫的Saccharomlyces cerevisiae FFC2146胞内EMP途径受到抑制后,在无机焦磷酸酶的调节作用下糖酵解流向发生改变,即EMP途径的产物3-磷酸甘油醛进入HMP途径(图 5),转酮醇酶(Transketolase,TK)是关联HMP途径和EMP途径的纽带,戊糖和己糖途径的纽带[22]。TK 主要催化三磷酸甘油醛和六磷酸果糖反应产生五磷酸木糖和四磷酸赤癣糖,促进3-磷酸甘油醛和七磷酸景天庚酮糖转变为五磷酸木糖和四磷酸赤癣糖[21]。可见,酿酒酵母受到外界非生物胁迫后通过改变糖代谢流向,获取新陈代谢提供足够的能量,维持生命。
3.3 Small GTPase GSP1P的耐热机制Small GTPase GSP1P是属于鸟苷三磷酸酶超家族的一类单分子蛋白质,它是一种温度敏感蛋白[23]。它可以通过活性与非活性状态控制细胞内信号转导通路的开关,使细胞内的蛋白质处于运输状态。Small GTPase Gsp1p主要与核过程有关,高温胁迫后出现在酵母细胞壁,可能作为应急反应参与细胞膜的蛋白质输送。
4 结论高温胁迫的Saccharomlyces cerevisiae FFC2146细胞壁蛋白质中新增Ssa2和小分子鸟苷三磷酸酶,无机焦磷酸酶上调表达,而丙酮酸激酶缺消失,同时6-磷酸葡萄糖酸脱氢酶和3-磷酸甘油醛脱氢酶下调表达。说明热休克蛋白Ssa2保护细胞壁在高温下保持完整,使细胞继续生长繁殖;高温胁迫下酿酒酵母的EMP糖酵解途径受阻,在转酮醇酶的作用下糖酵解途径转向HMP途径,获取足够的能量,维持细胞正常的新陈代谢。
| [1] | Stanley D, Bandara A, Fraser S, et al. The ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae[J]. Appl Microbiol, 2010, 109(1):13-24. |
| [2] | Suutari M, Liukkonen K, Laakso S. Temperature adaptation in yeast:the role of fatty acids[J]. Gen Appl Microbiol, 1990, 136(1):1469-1474. |
| [3] | Benschoter AS, Ingram O. Thermal tolerance of Zymomonas mobilis:Temperature-induced changes in membrane composition[J]. Appl Environ Microb, 1986, 6(4):1278-1284. |
| [4] | Lindquist S, Kim G. Heat shock protein 104 expression is sufficient for thermotolerance in yeast[J]. Proc Natl Acad Sci USA, 1996, 93(3):5301-5306. |
| [5] | Hottiger T, Virgilio C, Hall M N, et al. The role of trehalose synthesis for the acquisition of thermotolerance in yeast[J]. Eur J Biochem, 2005, 219(10):187-193. |
| [6] | Belloch C, Orlic S, Barrio E, et al. Fermentative stress adaptation of hybrids within the Saccharomyces sensu stricto complex[J]. Int J Food Microbiol, 2008, 122(3):188-195. |
| [7] | Griffin TJ, Aebersold R, Chem JB. Advances in Proteome Analysis by Mass Spectrometry[J]. Molecular and Cellular Biology, 2001, 276(2):45497-45500. |
| [8] | 姚继兵, 祖国仁, 朴永哲, 等. 不同传代次数的酿酒酵母细胞壁蛋白组学分析[J]. 微生物学通报, 2013, 40(11):1962-1969. |
| [9] | 季杨杨, 朴永哲, 袁方, 等. 不同传代次数酿酒酵母细胞内蛋白质组学分析[J]. 食品科技, 2014, 9(7):26-30. |
| [10] | 程君升, 毛开荣, 丁家波, 等. 微量Bradford法测定提纯禽结核菌素蛋白含量[J]. 中国兽药杂志, 2007, 41(6):9-11. |
| [11] | Bienz M, Pelham HR. Heat shock regulatory elements function as an inducible enhancer in the Xenopus hsp70 gene and when linked to a heterologous promoter[J]. Cell, 1986, 45(3), 753-760. |
| [12] | Hartl FU. Molecular chaperones in cellular protein folding[J]. Nature, 1996, 3(8):571-580. |
| [13] | Mayer M, Bukau B. Hsp70 chaperones:cellular functions and molecular mechanism[J]. Cell Mol Life Sci, 2005, 62(6):670-684. |
| [14] | Lopez JL, Chaffin WL. Member of the Hsp70 family of proteins in the cell wall of Saccharomyces cerevisiae[J]. Journal of Bacteriology, 1996, 180(2):4724-4726. |
| [15] | Sharma D, Masion CN. Functionally redundant isoforms of a yeast Hsp70 chaperone subfamily have different antiprion effects[J]. Genetics, 2008, 179(3):1301-1311. |
| [16] | Harold FM, Bacteriol H. Inorganic polyphosphates in biology:structure, metabolism, and function[J]. Bacteriol Rev, 1966, 30(4):772-778. |
| [17] | Yoon HS, Kim SY, Kim S. Stess response of plant H+-PPase-expressing transgenic Escherichia coli and Saccharomyces cerevisiae:a potentially useful mechanism for the development of stress-tolerant organisms[J]. J App l Genetics, 2013, 3(54):129-133. |
| [18] | Terkeltaub RA. Inorganic pyrophosphate generation and disposition in pathophysiology[J]. Physiol Cell Physiol, 2001, 281(1):C1-C11. |
| [19] | Larsson C, Pahlman I, Gustafsson L. The importance of ATP as a regulator of glycolytic flux in Saccharomyces cerevisiae[J]. Yeast, 2000, 16(3):797-809. |
| [20] | Giardina BJ, Chiang HL. Fructose-1, 6-bisphosphatase, malate de-hydrogenase, isocitrate lyase, phosphoenolpyruvate carboxykinase, glyceraldehyde-3-phosphate dehydrogenase, and cyclophilin a are secreted in Saccharomyces cerevisiae grown in low glucose[J]. Communicative&Integrative Biology, 2013, 6(6):234-238. |
| [21] | Pardo M, Monteoliva L, Pla J, et al. Two-dimensional analysis of pr-oteins secreted by Saccharomyces cerevisiae regenerating protoplasts a novel approach to study the cell wall[J]. Yeast, 1999, 5(43):459-472. |
| [22] | Endo T, Mitsui S, Nakai M, et al. Binding of tochondrial presequen-ces to yeast cytosolic heat shock protein70 depends on the a mphip-hilicity of the presequence[J]. Journal of Biological Chemistry, 1996, 271(8):4161-4167. |
| [23] | Baudin A. simple and efficient method of direct gene deletion in Saccharomyces cerevisiae[J]. Nucleic Acids Res, 1993, 21(2):3329-3330. |





