2. 山东隆利特酶制剂有限公司,临沂 276000;
3. 天津科技大学,天津 300222
2. Linyi Longkete Enzyme Preparation Co. Ltd,Linyi 276000;
3. Tianjin University of Science and Technology,Tianjin 300222
毕赤酵母表达系统作为目前应用广泛的真核表达系统,已有约500种外源蛋白获得成功表达,毕赤酵母工业化生产中通常进行高密度发酵,细胞密度随着发酵时间的延长不断增加,氧气在发酵液中的溶解度和传质效率逐步降低,使得溶氧控制成为影响毕赤酵母高表达目的蛋白的重要因素,而用于通气和搅拌的能耗已占毕赤酵母发酵成本的50%以上,又使得该工程菌发酵成为高能耗项目。通常在工业化生产中,通过改善发酵罐通气管道设计、罐压以及通纯氧来提高溶氧量,但现有工艺极限供氧传输速率约为500 mmol/(L·h),难以满足毕赤酵母高达2 000 mmol/(L·h)的需氧量[1]。另一方面,虽然较低的甲醇流加速率(5 mL/(L·h))可以降低需氧量,但过长的发酵周期(150 h以上)又极大的增加了发酵成本。
透明颤菌血红蛋白(Vitreoscilla hemoglobin,VHb)是一种专性好氧的革兰氏阴性丝状菌在低氧环境中产生的一种分子量约为15.8 kD的可溶性蛋白,具有较高的氧吸附和解离速率常数[2]。在毕赤酵母中共表达目的蛋白和VHb是改善高密度发酵过程中溶氧限制的一种有效方式,已在多种宿主中成功表达,提高代谢物产率[3]。同时,有研究表明,VHb在毕赤酵母中的表达不仅能提高氧的利用率和S-腺苷甲硫氨酸的产率,还能促进ATP合成,增强甲醇代谢活性[4]。VHb基因在各种表达系统中均有重要应用,如在大肠杆菌中,Khosravi等[5]发现将VHb基因在大肠杆菌中共表达时,可使细胞密度提高1.4倍,α-淀粉酶的产量提高3.3倍;在酵母表达系统中,1944年Wilfred等在Biotechnical Prog上发表了VHb在酵母中的应用研究结果,并进一步研究了它对好样代谢的影响,并证明VHb在酵母中主要存在于细胞质中;在毕赤酵母中应用尤其广泛。王清路等[6]在毕赤酵母中以Ppic9K为研究对象,转化GS115后,经发酵验证在贫氧条件下可以明显促进酵母菌体生长和目的基因的分泌表达;在霉菌中,李兵等[7]将VHb基因构建至表达载体pMK4-LV,并转化产黄青霉的原生质体,获得转化子后发酵表明,VHb的表达使得生物量提高9.76%,青霉素的产量提高9.68%。
β-甘露聚糖酶可降解饲料中含有的甘露聚糖,有助于解除甘露聚糖对机体胰岛素分泌和胰岛素样生长因子生成的抑制作用,提高葡萄糖吸收效率,是一种优良的饲料添加[8]。本课题组前期通过筛选高表达基因以及工程菌构建,优化发酵条件等方法,使β-甘露聚糖酶在30 L发酵罐水平达到29 600 U/mL,达到工业化生产要求。但为从根源解决毕赤酵母发酵工业生产中溶氧限制、发酵周期长等问题,本实验将经密码子优化后的透明颤菌血红蛋白基因(VHb)导入β-甘露聚糖酶毕赤酵母工程菌中,使VHb和β-甘露聚糖酶都在AOX1启动子下表达,并通过30 L发酵罐高密度发酵,讨论限氧条件下共表达VHb蛋白对毕赤酵母产β-甘露聚糖酶的影响。
1 材料与方法 1.1 材料 1.1.1 菌株及质粒β-甘露聚糖酶表达菌株Pichia pastoris GS115/Ppic9K-β-MAN、大肠杆菌(Escherichia coli)DH5α和质粒pPICZαA均由本实验室保存,VHb基因以及相关引物由上海生工生物工程有限公司合成。
1.1.2 主要试剂限制性内切酶AsuⅡ、NotⅠ、SacⅠ、T4 DNA连接酶等均购自宝生物工程(大连)有限公司;G418和Zeocin购自上海生工生物工程有限公司;蛋白分子量标准购自赛默飞世尔科技公司,核酸分子量标准、EasyPfu DNA Polymerase、酵母基因组提取试剂盒、质粒小量抽提试剂盒、纯化试剂盒等购自北京全式金生物技术有限公司;其余试剂均为国产分析纯。
1.1.3 培养基LB培养基:氯化钠10 g/L、胰蛋白胨10 g/L、酵母提取物5 g/L;YPD培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母提取物10 g/L;发酵基础培养基:葡萄糖2.5%、KH2PO4 5 g/L、CaSO4 3 g/L、K2SO4 15 g/L、MgSO4 15 g/L、NH4H2PO4 35 g/L、KOH 4.2 g/L、12 mL/L微量元素;分批补料培养基:50%甘油(W/V)(含12 mL/L微量元素);诱导剂:100%甲醇(含12 mL/L微量元素);补料培养基:NH4H2PO4 200 g、CaSO4 20 g、K2SO4100 g、MgSO4 100 g,定容至2 L;微量元素溶液:参照Invitrogen表达手册。
1.2 方法 1.2.1 VHb密码子优化与引物设计根据已经报道的VHb蛋白的氨基酸序列(GenBank:AF274976),VHb蛋白共有441 bp,编码147个氨基酸,结合毕赤酵母密码子的偏爱性,使用CodonW软件包和RNAstructure分析基因序列,进行密码子优化。密码子优化后的VHb基因提交NCBI数据库(登录号:KM108313)。
使用Primer Premier 5、Oligo7.0软件进行引物设计、分析,设计引物:
F1:5'-AGTTCGAAACGATGTTGGACCAG-3'(引入AsuⅡ酶切位点),
F2:5'-TAAAGCGGCCGCCTACTCAACAGCCTGG-3'(引入NotⅠ酶切位点)。
1.2.2 重组质粒的构建与转化以上海生工生物工程有限公司合成基因序列为模板,F1与F2为引物,进行目的片段的PCR扩增。基因扩增条件为:94℃预变性5 min,94℃ 30 s,54℃退火30 s,72℃延伸3 min,循环30次,72℃后延伸10 min。将PCR扩增得到的目的片段纯化、双酶切,并与经过同样双酶切处理表达载体pPICZαA连接,转化感受态大肠DH5α,利用Zeocin(100 μg/mL)筛选抗性菌落,PCR鉴定重组质粒,且送交上海生工生物工程有限公司测序,测序正确后得到重组质粒pPICZαA -VHb。重组质粒别分经SacⅠ线性化后,电击转化至GM115中。
1.2.3 重组菌株的筛选和摇瓶复筛将电击转化产物涂布于含100、200、300 μg/mL的Zeocin梯度YPD平板(且含500 μg/mL的G418),30℃培养3-4 d,至菌落出现。原始菌株为非Zeocin抗性,只有重组质粒pPICZαA -VHb整合入GM115基因组中,才能在含有Zeocin和G418的抗性YPD平板上生长。从平板上挑取重组工程菌,使用TaKaRa的lysis buffer提取酵母基因组,以F1、F2为引物进行菌落PCR,条件为:94℃预变性10 min,94℃ 30 s,54℃退火30 s,72℃延伸3 min,循环30次,72℃后延伸10 min。
挑取经PCR验证正确的重组菌株,接种至YPD液体摇瓶培养基中,30℃、240 r/min,培养至OD600≈8.0,按10%接种量接入发酵基础培养基中,28℃,240 r/min培养24-30 h,初始碳源耗尽后,补充1 mL 50%甘油,甘油耗尽后饥饿培养0.5 h,每24 h补充100%甲醇1.5 mL,发酵120 h,取上清测定β-甘露聚糖酶酶活力,筛选高表达菌株进行30 L发酵罐放大实验。
1.2.4 30 L发酵罐放大试验发酵罐装液量60%,控制pH5.5,YPD种子罐移种后,调节转速400 r/min、温度30℃、空气流量1 m3/h、罐压0.05 MPa,进行分批发酵,基础培养基中碳源耗尽后,DO值急速上升,此时以15 mL/(L·h)速度流加50%甘油(W/V,含12 mL/L的PTM1),稳定罐压为0.08 MPa,调节通气量、搅拌速度控制溶氧为20%左右。
当菌体浓度达到30 g/L左右时,停止流加甘油,饥饿40 min,耗尽细胞内残留的甘油。诱导阶段采取连续补料方式添加甲醇(含12 mL/L的PTM1),初始流加速度为1 mL/(L·h),之后每小时增加一个单位,直至添加量为10 mL/(L·h)后,调节转速为800 r/min、温度28.5℃、空气流量4-6 m3/h、罐压0.1 MPa,同时离线检测甲醇浓度在0.08%±0.02(V/V)左右,控制DO为10%-20%,诱导β-甘露聚糖酶基因表达。
1.2.5 β-甘露聚糖酶酶活测定方法采用DNS法测酶活力,酶活力单位定义:在37℃、pH5.5的条件下,每分钟从浓度3 mg/mL的甘露聚糖(Sigma G0753)溶液降解释放1 μmol还原糖所需的酶量为一个酶活力单位。
1.2.6 细胞质量浓度测定方法细胞干质量(80℃烘干)与发酵液体积之比即为细胞质量浓度,根据测量数值绘制线性回归曲线,细胞干重与OD600的关系为:DCW=0.226OD600+0.017(R2=0.989 2)。
1.2.7 VHb表达产物活性检测方法采用CO-差示光谱法检测[9]。 2 结果 2.1 VHb基因PCR扩增产物及重组克隆质粒的鉴定VHb基因PCR产物经1%琼脂糖凝胶电泳分析,在约460 bp处可见特异的DNA条带,大小与预期相符(图 1)。重组表达质粒pPICZαA-VHb双酶切产物(AsuⅡ、NotⅠ)经1%琼脂糖凝胶电泳分析,均可见与目的基因大小相符的目的条带(图 2),且测序结果与人工合成的基因序列一致,表明重组质粒构建正确。
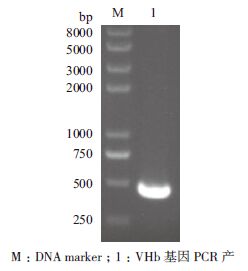
|
| 图 1 VHb 基因扩增产物电泳图 |
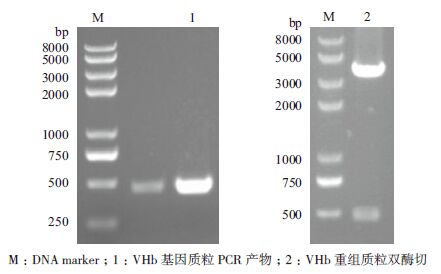
|
| 图 2 重组表达质粒的PCR 及双酶切鉴定 |
甲醇诱导5 d后,离心取菌体,采用玻璃珠法,破碎细胞提取胞内总蛋白,经SDS-PAGE分析,可见相对分子量约16 kD的VHb特异性条带(图 3),大小与预期相符,说明VHb在毕赤酵母内成功表达。
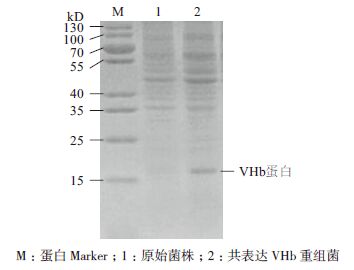
|
| 图 3 胞内VHb 蛋白表达的SDS-PAGE 分析 |
经甲醇诱导培养VHb重组酵母和原始菌株,收集菌体,破碎提取胞内蛋白,分别对两个样品作CO-差示光谱分析,结果见图 4。VHb重组菌的CO-差示光谱图为典型的VHb特征曲线,而原始对照菌的CO-差示光谱图为一条在420 nm处无特殊吸收峰的平缓曲线,表明VHb重组毕赤酵母表达的透明颤菌血红蛋白具有正常的生物活性。

|
| 图 4 CO- 差示光谱 |
为了考察低溶氧条件下VHb对高密度产β-甘露聚糖酶的影响,在30 L发酵罐中,调节转速及罐压控制溶氧在10%±5%,其他条件不变,进行发酵研究。由图 5可知,在低溶氧条件下,共表达VHb工程菌与原始菌株相比β-甘露聚糖酶表达量有明显提高。VHb重组菌在发酵96 h后,酶蛋白表达量增速明显,而对照菌株增速缓慢,发酵132 h后,共表达VHb工程菌的菌体浓度和酶活力达到最高值,为130 g/L和29 900 U/mL,分别是原始菌株的1.3倍、1.9倍。
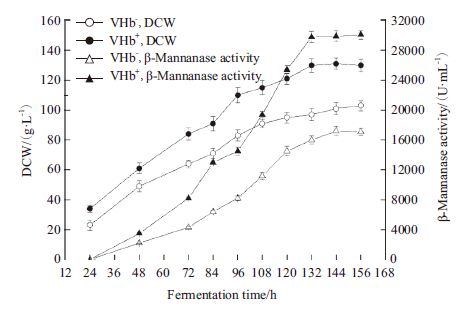
|
| 图 5 低溶氧条件下VHb 对菌体生长和酶活力的影响 |
在不同甲醇补料量下,通过摇瓶考察了VHb基因对毕赤酵母产β-甘露聚糖酶的影响,结果如图 6所示。每天补充甲醇1%时,VHb重组的最高菌体量和酶活与原始菌株一致,但随着甲醇补料量的增加,VHb重组菌在2%甲醇添加量下,最高菌体量和酶活并未出现受抑制现象,而原始菌株则下降50%以上,当甲醇补料量增至每天3%时,VHb重组菌和原始菌株菌体量和酶活均出现大幅下降。
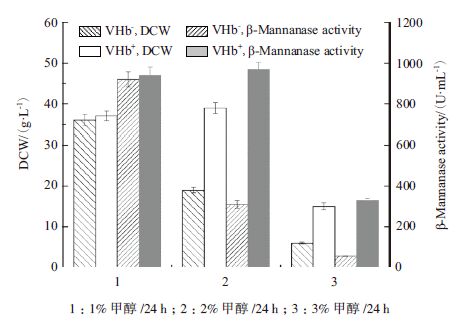
|
| 图 6 甲醇添加量对VHb 重组菌、原始菌生长以及产β-甘露聚糖酶的影响 |
甲醇诱导阶段采取连续补料方式添加甲醇(含12 mL/L的PTM1),初始流加速度为6 mL/(L·h),之后每小时增加3个单位,直至添加量为15 mL/(L·h),维持高甲醇流加速度至发酵结束,其余条件保持不变。诱导表达阶段提高甲醇流加速度一方面会促进酵母菌加速繁殖,提高目的产物表达;另一方面,过高的甲醇流加速度会对细胞造成毒害作用,进而影响发酵过程。如图 7所示,原始菌株限于高甲醇的毒副作用,菌体量和酶活严重下降,而VHb重组菌同摇瓶验证结论相同,耐甲醇能力显著提高。同时,得益于高甲醇添加量,VHb重组菌发酵96 h后,菌体量和酶活达到最高值,分别为129 g/L和28 500 U/mL,与低甲醇补料下相比没有大幅度波动,但发酵时间缩短约40 h。
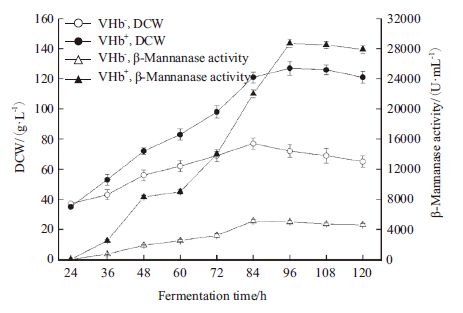
|
| 图 7 30 L 发酵罐中高甲醇添加量对VHb 重组菌、原始菌生长以及产β-甘露聚糖酶的影响 |
β-甘露聚糖酶在动物饲料业具有广阔的应用前景,毕赤酵母作为成熟的商业菌株,便于大规模高密度发酵以及外源蛋白的高表达,而溶氧限制却成为毕赤酵母高密度发酵的瓶颈,已有众多学者致力于解决发酵供氧问题。在工艺设备方面,尽量提高搅拌速率、通气量、罐压、优化通气系统设计、使用空气与氧气的混合气等[10],但优化工艺并不能从根本上解决溶氧限制问题,更难以解决100 m3规模以上发酵罐中由于溶氧分布不均导致的低溶氧和溶氧波动问题,因此众多学者尝试在工程菌中引入透明颤菌血红蛋白共表达的方法,提高重组细胞对氧的利用率、促进细胞生长、改善细胞的表达量、降低发酵过程的动力成本[11]。在工业化的基因工程菌中,酵母是更易于工业化及表达更优越的系统,VHb在酵母中的成功应用,无疑对微生物发酵行业有着深远的影响,而对于毕赤酵母高密度发酵而言,孟志刚等[12]报道其可使得酵母生长速度表快,细胞密度增加等,这对于提高发酵效率,缩短发酵周期有着重要工业化价值。另一方面,唐辉桂等[13]的研究却表明VHb对宿主细胞的生长没有明显影响,但是却使植酸酶活性提高了3倍。而本研究表明VHb菌株对菌体浓度有一定影响,但酶活力没有提升,但是宿主菌对甲醇的耐受能力得到了提高,这使得发酵周期可以进一步缩短。综上,VHb对不同工程菌影响效果不一,在对VHb作用机制尚不完全了解的前提下,目前公认的VHb的作用机制主要在两方面:其一是清除对细胞生长不利的自由氧与NO,其二是促进氧的扩散,提高细胞对溶氧的利用,而最近报道它与细胞膜脂可能才在一定的相互作用[14]。
在毕赤酵母表达系统中,透明颤菌血红蛋白的启动子有多种选择,应用AOX1强启动子[15]和PsADH2低氧压力启动子[16]均有促进外源蛋白表达的报道,根据前期试验数据,该工程菌在正常溶氧下外源蛋白表达量已经达到10.9 g/L,在毕赤酵母系统中已属较高水平。因此为了降低动力消耗以缩减成本,以及通过控制低溶氧水平以获得尽可能快的甲醇补料速度,本实验计划在整个发酵中采用低溶氧条件发酵,这就要求在整个发酵过程中血红蛋白应在诱导期连续表达,因此选择AOX1强启动子在低氧水平下与目的蛋白同时表达,以期最大程度缩短发酵周期。
在低甲醇浓度下共表达VHb菌与原始菌株相比生长情况并无区别,此时毕赤酵母菌体量已达130 g/L,接近毕赤酵母表达系统菌体浓度的峰值,由此说明VHb的胞内表达对宿主的生长并没有明显的促进作用,结果见图 6(1%甲醇组),这也与唐辉桂[13]和卢俊裕[17]等的报道相一致。酶蛋白表达方面,Hu等[18]发现,诱导型Pichia pastoris进入甲醇诱导期后,胞内ATP供应不足成为蛋白合成的主要限制性因素,而Chen等[19]的研究则表明VHb的表达虽然对ATP水平影响不明显,但能提高ATP的合成速率达1.68倍,因此Chen等猜测VHb可能对和氧有关的代谢途径的产物有直接的作用。图 6、图 7也表明高甲醇浓度下,VHb共表达菌株酶蛋白表达速率明显较高,高效的ATP合成速率可以促进细胞的呼吸[20],提高能量代谢水平,加快了毕赤酵母目的蛋白的表达速率。诱导期高甲醇浓度条件下,由于甲醇浓度较高致使细胞内产生大量的甲醇及过氧化氢,从而导致细胞的死亡[21],但本实验中共表达VHb工程菌耐甲醇能力明显提高,这可能与VHb的抗氧化胁迫性质有关[22],VHb蛋白具有的高氧吸附和解离速率常数[2],提高了氧气的利用效率,提高了毕赤酵母对甲醇的耐受性。
在不同甲醇添加量下,通过30 L发酵罐对比考察了共表达VHb工程菌和原始菌株的生长与β-甘露聚糖酶的合成情况,如图 5中,在低甲醇浓度下,两株菌均在发酵130 h左右达到菌体浓度和酶蛋白的峰值,而图 7中在高甲醇浓度下,共表达VHb工程菌在96 h左右便达到峰值,发酵周期缩短近40 h,根据Mayson[23]、Hong等[24]的研究,诱导期尽量提高甲醇补料速度有助于菌体生长和酶蛋白的表达,而共表达VHb工程菌较高耐甲醇能力又极大的缩短了发酵周期。
4 结论本研究将密码子优化后的VHb基因,构建到表达β-甘露聚糖酶的毕赤酵母中,共表达VHb基因能明显提高毕赤酵母对甲醇的耐受性,当控制溶氧10%±5%,甲醇流加速度维持为15 mL/(L·h)时,使得β-甘露聚糖酶酶活力未有明显变化,但发酵周期降至96 h,缩短约40 h,在动力成本占到总成本约50%以上的毕赤酵母高密度发酵生产中。
| [1] | Simon C, Peter B, Thomas K, et al. Human chymotrypsinogen B production with Pichia pastoris by integrated development of fermentation and downstream processing. Part 1[J]. Fermentation Biotechnology Progress, 2001, 17(8):495-502. |
| [2] | Wei XX, Chen GQ. Applications of the VHb gene vgb for improved microbial fermentation processes[J]. Methodds in Enzymology, 2008, 436(5):273-287. |
| [3] | Zhang L, Li YJ, Wang ZN, et al. Recent developments and future prospects of Vitreoscilla hemoglobin application in metabolic engineering[J]. Biotechnol Adv, 2007, 25(2):123-136. |
| [4] | Chen HX, Chu J, Zhang SL, et, al. Intracellular expression of Vitreoscilla hemoglobin improves S-adenosylmethionine production in a recombinant Pichia pastoris[J]. Appl Microbiol Biotechnol, 2007, 74(6):1205-1212. |
| [5] | Khosravi M, Webster DA, Stark BC. Presence of the bacterial hemoglobin gene improves α-amylase production of a recombinant Escherichia coli strain[J]. Plasmid, 1990, 24:190-194. |
| [6] | 王清路, 张锐, 倪万潮. 透明颤菌血红蛋白基因vgb和腈水解酶基因bxn在毕赤酵母中的表达研究[J]. 生物工程学报, 2004, 20(5):730-735. |
| [7] | 李兵, 李术娜, 周艳芬. 透明颤菌血红蛋白基因在产黄青霉中的克隆与表达[J]. 中国抗生素杂志, 2006, 31(7):400-402. |
| [8] | 辛总秀. β-甘露聚糖酶在家禽饲料中应用的研究进展[J]. 畜牧与饲料料学, 2011, 32(5):28-30. |
| [9] | 余河斌, 余绍文, 等. 血红蛋白基因在产CBHⅡ毕赤酵母工程菌中的表达[J]. 生物技术, 2007, 17(4):25-29. |
| [10] | 林俊涵. 毕赤酵母高密度发酵工艺的研究[J]. 中国生物工程杂志, 2009, 29(5):120-125. |
| [11] | Zhang L, Li YJ, Wang ZN, et al. Recent developments and future prospects of Vitreoscilla hemoglobin application in metabolic engineering[J]. Biotechnology Advances, 2006, 11(3):123-136. |
| [12] | 孟志刚, 张锐, 陈毓荃, 等. 利用透明颤菌血红蛋白基因vgb改造毕赤酵母分泌性表达载体pPIC9K的研究[J]. 西北农业学报, 2005, 14(4):166-170. |
| [13] | 唐辉桂, 黄火清, 罗会颖, 等. 利用透明颤菌血红蛋白在低氧条件下提高毕赤酵母中植酸酶的表达[J]. 中国农业科技导报, 2008, 10(3):84-89. |
| [14] | Rinaldi AC, Bonamore A, Macone A, et al. Interaction of Vitreoscilla hemoglobin with membrane lipeds[J]. Biochemistry, 2006, 45(13):4069-4076. |
| [15] | Wu JM, Hsu TA, Lee CK. Expression of the gene coding for bacterial hemoglobin improves β-galactosidase production in a recombinant Pichia pastoris[J]. Biotechnol Lett, 2003, 25(17):1457-1462. |
| [16] | Chien LJ, Lee CK. Expression of bacterial hemoglobin in the yeast, Pichia pastoris, with a low O2-induced promoter[J]. Biotechnol Lett, 2005, 27(19):1591-1497. |
| [17] | 卢俊裕, 林影, 梁书利, 叶燕锐. 共表达透明颤菌血红蛋白提高脂肪酶在毕赤酵母中的表达[J]. 现代食品科技, 2014, 30(6):110-115. |
| [18] | Hu XQ, Chu J, Zhang SL, et al. A nobel feeding strategy during the production phase for enhancing the enzymatic synthesis of S-adenosyl-L-methionine by methylotrophic Pichia pastoris[J]. Enzyme Microb Techinol, 2007, 40(4):669-674. |
| [19] | Chen RZ, Bailey JE. Energetic Effect of Vitreoscilla hemoglobin expression in Escherichia coli:An online 31PNMR and a saturation transfer study[J]. Biotechnology Progress, 1994, 10(7):360-364. |
| [20] | Rinaldi AC, Bonamore A, Macone A, et al. Interaction of Vitreoscilla hemoglobin with membrane lipids[J]. Biochemistry, 2006, 45(13):4069-4076. |
| [21] | Gekil H, Stark BC, Webster DA. Cell growth and oxygen uptake of Escherichia coli and Pseudomonas aeruginosa aer differently effected by the genetically engineered Vitreoscilla hemoglobin gene[J]. J Biotechinol, 2001, 85(9):57-66. |
| [22] | Hikmet G, Salih G, Huseyin K, et al. Genetic engineering of Enterobacter aerogines with the Vireoscilla hemoglobin:Cell growth, survival, and antioxidant enzyme status under oxidative stress[J]. Research in Mirobiol, 2003, 154(6):425-431. |
| [23] | Mayson BE, Douglas G. Effects of methanol concentration on expression leves of recombinant protein in fed-batch cultures of Pichia methanolica[J]. Biotechnol Bioeng, 2003, 81(3):291-298. |
| [24] | Hong F, Meinander NQ, Joensson LJ. Fermentation strategies for improved heterologous expression of laccase in Pichia pastoris[J]. Biotechnol Bioeng, 2002, 79(4):438-449. |




