恶性黑色素瘤是发生在皮肤和黏膜之间且可转移的一种高度恶性肿瘤,其发病率和死亡率呈逐年上升趋势[1]。顺铂(Cislpatin,DDP)是临床上常用化疗药物,广泛用于治疗各种癌症[2],但具有耳毒性、肾毒性等毒副作用且肿瘤易对其产生耐药性[3, 4, 5],使其临床应用受到限制。
植物非特异性脂转移蛋白(Non-specific lipid transfer proteins,nsLTPs)是一类普遍存在于植物体内的小分子、多功能、碱性可溶性的蛋白[6],因对脂质分子具有广泛亲和力 [7],在体外可将磷脂等脂质体从表面转运至线粒体中而得名[8],具有转脂[9, 10, 11]、抗菌及抑制肿瘤[12]等作用。Lin等[13]从甘蓝中分离的LTP可抑制肝癌Hep G2细胞和乳腺癌MCF 7细胞的增殖,其IC50为5.8和1.6 μmol/L。此外,Tousheh等[14]研究发现水稻nsLTPs,在细胞内还可作为抗癌药物载体。脂转移蛋白所具有的多种生物活性,目前已受到科学界广泛关注。
骆驼蓬(Peganum harmala)是蒺藜科(Zygop-hyllaceae)骆驼蓬属(Peganum)的一种多年生草本植物,具有止咳平喘、消寒助阳的作用,其生物碱具有杀虫、抗菌、镇痛、抗癌的作用[15]。本课题组在前期研究中发现,从传统维药骆驼蓬种子中分离出的骆驼蓬脂转移蛋白(Peganum harmala Lipid transfer protein,PhLTP),在体外对多种肿瘤细胞具有抑制生长作用,且对正常细胞毒性较小[16]。通过基因工程手段获得的重组骆驼蓬脂转移蛋白(rPhLTP)在体内具抑瘤作用[17]。本研究旨在探讨重组PhLTP和DDP联合应用对黑色素瘤B16细胞增殖和凋亡是否有协同效应。
1 材料与方法 1.1 材料16细胞为鼠黑色素瘤细胞,为本实验室保存。重组骆驼蓬脂转移蛋白rPhLTP为本课题组诱导表达纯化。顺铂购自齐鲁制药有限公司,1640培养基及胎牛血清(美国Gibco公司),MTT及DMSO(美国sigma公司),Annexin V-FITC/PI apoptosis kit(联科生物公司),DCFH-DA、DiOC6(3)(美国Sigma公司),胰酶,3423型二氧化碳培养箱(美国Thermo公司),流式细胞仪(美国BD公司)。
1.2 方法 1.2.1 细胞培养和实验分组细胞培养于含质量分数为10 g/LFBS的1640培养基,37℃,5% CO2饱和湿度的恒温培养箱中孵育。实验分组为:空白对照组、rPhLTP组、DDP组、rPhLTP与DDP联合组。rPhLTP的终浓度梯度为10 μg/mL、20 μg/mL、40 μg/mL,80 μg/mL,DDP的终浓度梯度为2.5 μg/mL、5 μg/mL和10 μg/mL及两药协同(rPhLTP 10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL + DDP 2.5 μg/mL、5 μg/mL、10 μg/mL),rPhLTP及DDP用1640培养基配制。
1.2.2 MTT法检测药物对细胞生长的抑制作用将5×104个/ mL细胞接种于96孔板,每孔100 μL,待细胞贴壁后分别加入药物作用24 h后,吸弃废培养液,每孔加入20 μL的MTT(5 mg/mL)和80 μL培养基,作用4 h后吸弃上清,每孔加入150 μL DMSO,避光震荡15 min后在490 nm处检测吸光值。根据公式,细胞生长抑制率=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]× 100 %,计算抑制率。rPhLTP和DDP的联合作用效果根据两药作用系数(Coefficient of drug interaction,CDI)计算,CDI=AB/(A×B),AB为两药联合作用的OD值与对照组OD值的比值,A或B为单药处理组OD值与对照组OD值的比值。当CDI < 1时,表明两药具有协同作用,当CDI < 0.75时,表明协同作用极显著[18]。
1.2.3 流式细胞术检测细胞凋亡率将4×105个/mL细胞接种于6孔板中,总体积为2 mL。细胞贴壁后分别加入不同浓度的药物作用24 h后,收集各处理组细胞,分别按AnnexinV-FITC/PI apoptosis kit试剂盒说明书说明书操作,用FACSCalibur流式细胞仪检测。
1.2.4 胞内活性氧(ROS)的检测将4×105个/mL细胞接种于6孔板,每孔2 mL,待细胞贴壁后分别加入药物作用24 h后收集细胞,沉淀加1.5 μmol/L DCFH-DA,37℃孵育15 min。收集细胞使用流式细胞仪进行检测。
1.2.5 线粒体膜电位(Δψm)的检测将4×105个/mL细胞接种于6孔板,每孔2 mL,待细胞贴壁后分别加入药物作用24 h后,收集细胞,离心,沉淀加4 nmol/L的DiOC6(3),37℃避光15 min后离心,PBS重悬,流式细胞仪检测(激发波长484 nm,吸收波长501 nm)的荧光强度,Cell Quest软件分析结果。
1.3 统计学分析各组实验均重复3次,用Prism 5软件对数据进行统计处理,采用双因素方差分析进行检验分析,P<0.05为有显著性差异。
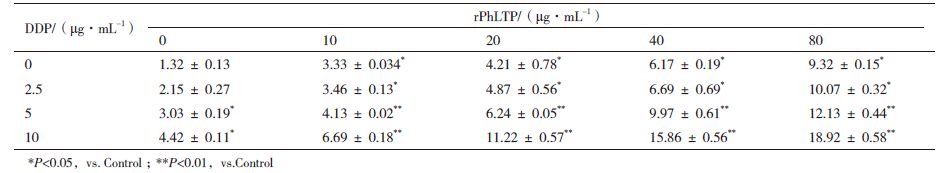
2 结果 2.1 rPhLTP、DDP单独或联用对细胞生长抑制的影响MTT结果显示(表 1),当用10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL的rPhLTP处理细胞后,检测到对B16细胞的增殖抑制率分别为(23.36 ± 0.043)%、(36.59 ± 0.076)%、(47.13 ± 0.059)%、(83.58 ± 0.062)%,2.5 μg/mL、5 μg/mL和10 μg/mL的DDP处理细胞后发现其对细胞的增殖抑制率分别为(16.68 ± 0.098)%、(29.46 ± 0.108)% 和(34.98 ± 0.044)%。结果表明不同浓度的rPhLTP或DDP单药处理B16细胞后,与空白对照组相比,浓度为20 μg/mL、40 μg/mL的rPhLTP以及浓度为5 μg/mL、10 μg/mL的DDP具有显著性差异(P < 0.05),浓度为80 μg/mL的rPhLTP具有极显著性差异(P < 0.01),rPhLTP和DDP单独作用对B16细胞的增殖抑制具浓度依赖性。当不同浓度的rPhLTP、DDP共同作用后对B16细胞的增殖抑制作用均高于单药处理组,且40 μg/mLrPhLTP与2.5 μg/mL DDP协同作用后,对B16细胞的增殖抑制率为(59.51 ± 0.185)%,显著高于高浓度的DDP(10 μg/mL)处理后细胞的增殖抑制率,同时也显著高于40 μg/mL rPhLTP处理后对细胞的增殖抑制率(P < 0.01)。通过计算两药联合作用指数CDI,发现不同浓度的 rPhLTP与不同浓度的DDP联合作用后,CDI均小于1,说明rPhLTP可增强DDP对B16细胞的增殖抑制作用,具有协同效应。
Annexin V-FITC/PI双染检测结果(图 1,表 2)显示,不同浓度的rPhLTP处理B16细胞24 h后,检测到凋亡率分别为(3.33 ± 0.034)%、(4.21 ± 0.78)%、(6.17 ± 0.19)%和(9.32 ± 0.15)%,与对照组相比均具有显著性差异(P < 0.05);不同浓度的DDP处理后检测到其凋亡率分别为(2.15 ± 0.27)%、(3.03 ± 0.19)%和(4.42 ± 0.11)%,与对照组相比浓度为5 μg/mL和10 μg/mL的DDP具有显著性差异(P < 0.05),表明不同浓度的rPhLTP与DDP可以浓度依赖性的方式诱导B16细胞发生凋亡。当rPhLTP与DDP联合作用作用B16细胞后,检测到其凋亡率均高于单药处理组细胞的凋亡率,且当不同浓度的rPhLTP与10 μg/mL的DDP联用后,检测到其凋亡率均显著高于高浓度的DDP(10 μg/mL)处理后细胞的凋亡率(4.42 ± 0.11)%(P < 0.05),当高浓度的rPhLTP(40 μg/mL)与2.5 μg/mL的DDP联合后其对细胞的凋亡率(6.69 ± 0.69)% 显著高于高浓度的DDP(10 μg/mL)处理后细胞的凋亡率(4.42 ± 0.11)%(P < 0.01)。

|
| 图 1 流式细胞术检测B16 细胞凋亡率 |
当细胞受到外界物质刺激而发生凋亡时,细胞内的ROS水平会发生变化。为了检测rPhLTP与DDP 单独及联合作用是否对B16细胞ROS产生影响,采用DCFH-DA荧光染料对处理的细胞进行染色。结果(表 3)表明,当用10 μg/mL、20 μg/mL、40 μg/mL和80 μg/mL的rPhLTP 处理细胞后,检测到ROS的平均荧光强度(MIF)分别为(143.66 ± 5.98)%、(230.44 ± 1.12)%、(290.05 ± 1.66)%、(310.55 ± 1.59)%,用2.5 μg/mL、5 μg/mL和10 μg/mL的DDP处理细胞后检测到ROS的MIF分别为(169.28 ± 4.01)%、(245.67 ± 3.09)%和(268.25 ± 3.80)%。说明随着rPhLTP或DDP浓度的增加,胞内ROS的水平也呈上升的趋势,与对照组相比浓度大于40 μg/mL的rPhLTP以及浓度大于5 μg/mL的DDP均具有显著性差异(P < 0.05)。rPhLTP与DDP联合作用后检测到ROS的MIF均高于rPhLTP、DDP单独处理细胞后胞内的ROS水平,且20 μg/mL rPhLTP与低浓度的DDP(2.5 μg/mL)联合作用胞内的ROS为(308.87 ± 8.92)%,显著高于高浓度的DDP(10 μg/mL)单独处理细胞后胞内的ROS(268.25 ± 3.8)% 水平,同时也显著高于20 μg/mL rPhLTP单独处理细胞后胞内ROS(230.44 ± 1.12)%的水平(P < 0.01)。结果提示rPhLTP与DDP联合作用B16细胞后,可使胞内的ROS水平发生变化,说明二者联合诱导细胞发生凋亡可能与ROS的升高相关。
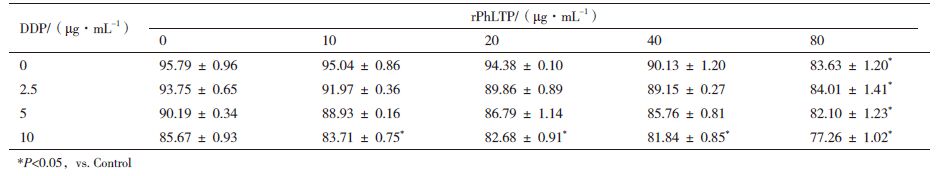
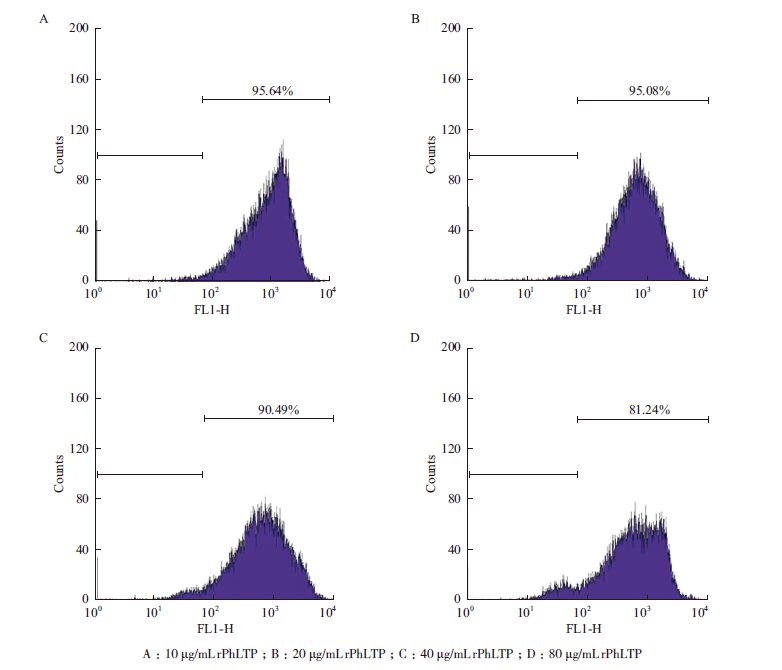
在凋亡的细胞中,由于线粒体会受到损失而使横跨线粒体的膜电位下降或消失。在本实验中,通过DiOC6(3)荧光染料检测rPhLTP、DDP 单独及联用后B16细胞中线粒体膜电位(Δψm)的变化。结果见图 2和表 4,当10 μg/mL、20 μg/mL、40 μg/mL和80 μg/mL的rPhLTP处理细胞后其胞内Δψm的MIF分别为(95.04±086)%、(94.38 ± 0.10)%、(90.13 ± 1.20)%和(83.63 ± 1.20)%,2.5 μg/mL、5 μg/mL及10 μg/mL的DDP处理后检测Δψm的MIF分别为(93.75 ± 0.65)%、(90.19 ± 0.34)%和(85.67 ± 0.93)%,表明rPhLTP、DDP单独作用B16细胞后,胞内Δψm的水平以浓度依赖性的方式降低。rPhLTP与DDP联用后,Δψm降低的水平较单药处理组细胞高。
|
| 图 2 不同浓度的rPhLTP 作用后B16 细胞线粒体膜电位的改变 |
恶性黑素瘤在体内的自然凋亡率比其它肿瘤要低,具有抵抗药物诱导凋亡特性,且其预后差[1],因此有必要研究探讨治疗恶性黑素瘤的有效方法。顺铂(DDP)被用于治疗多种肿瘤,其机制涉及DNA损伤和诱导线粒体凋亡从而激活肿瘤细胞凋亡信号发挥作用[2, 19],但DDP毒副作用大[3, 4, 5, 6, 7],因此需要寻找一种药物与其联用以减轻其不良反应。植物脂转移蛋白可以抑制癌细胞增殖,诱导癌细胞凋亡[12, 13, 14]。本课题组前期研究发现重组骆驼蓬脂转移蛋白及重组真核质粒均能抑制体内黑色素瘤细胞的生长[17, 20],预示骆驼蓬脂转移蛋白在治疗黑色素瘤中具有潜在应用价值。
本实验应用MTT法检测了rPhLTP合用DDP时对B16细胞增殖的影响,结果表明当40 μg/mL rPhLTP与2.5 μg/mL DDP共同作用后,对B16细胞的增殖抑制率显著高于单药处理组(P < 0.01),两药联合作用指数CDI均<1,说明rPhLTP可增强DDP对B16细胞的增殖抑制效应,对B16细胞有化疗增敏作用。用流式细胞仪检测二者合用对B16细胞凋亡的影响,结果发现不同浓度的rPhLTP与DDP可以浓度依赖性的方式诱导B16细胞发生凋亡,当rPhLTP与DDP联合作用B16细胞后,检测到其凋亡率均高于单药处理组细胞的凋亡率,且当40 μg/mL的rPhLTP与2.5 μg/mL的DDP联合后其对细胞的凋亡率显著高于高浓度的DDP(10 μg/mL)处理后细胞的凋亡率。推测rPhLTP协同 DDP对B16细胞的增殖抑制作用可能与诱导细胞凋亡有关。
据文献报道,ROS是细胞凋亡的早期信号,促使线粒体膜通透性改变,使线粒体膜电位下降,还能与caspase-9前体、ATP/dATP形成凋亡体,诱导细胞凋亡[21]。当细胞受到凋亡诱导信号的刺激后,胞内的ROS会升高,可上调自噬以杀伤肿瘤细胞[22]。梁晓松等[23]研究表明大黄素可提高肿瘤细胞内ROS水平,从而提高癌细胞对化疗药物的敏感性。本研究发现rPhLTP与DDP联用胞内的ROS水平均高于rPhLTP、DDP单独处理组,提示两药联用诱导B16细胞发生凋亡可能依赖于胞内ROS放大信号的作用,通过线粒体途径诱导细胞凋亡。
许多研究结果表明线粒体是细胞凋亡的核心,线粒体膜电位对维持线粒体正常功能是十分必要的,大多抗癌药物在诱导各种类型细胞凋亡均伴随线粒体膜电位的下降,一旦线粒体膜电位崩溃,细胞凋亡不可逆转[24]。如刘浩等[25]研究表明白藜芦醇可通过降低黑色素瘤细胞的线粒体膜电位,诱导细胞凋亡。本研究发现rPhLTP、DDP单独作用细胞后胞内Δψm随药物浓度的升高而降低,且两药联用后胞内Δψm水平均低于rPhLTP、DDP单独处理后胞内Δψm水平,但无显著性差异。提示rPhLTP与DDP可能协同作用于线粒体,通过降低线粒体膜电位,破坏线粒体稳定性,使诱导凋亡的因子释放到细胞质中诱导细胞凋亡,从而提高抗肿瘤效果。但二者联合应用诱导细胞凋亡的作用机制及可能的作用靶点有待于进一步研究。
4 结论rPhLTP与顺铂有协同作用,可增强顺铂对B16细胞的增殖抑制作用,并以浓度依赖性的方式促进B16细胞发生凋亡。
| [1] | Little EG, Eide MJ. Update on the current state of melanoma incide-nce[J]. Dermatol Clin, 2012, 30(3):355-361. |
| [2] | Galluzzi L, Senovilla L, Vitale I, et al. Molecular mechanisms of cisplatin resistance[J]. Oncogene, 2012, 31:1869-1883. |
| [3] | 张蕾, 陈露, 李蒙蒙, 等. 丹参酮I 抑制小鼠B16 黑色素瘤细胞研究[J]. 浙江林业科技, 2014, 3(34):14-18. |
| [4] | 王肇炎, 王尔兵. 奈达铂:一种铂类抗癌新药[J]. 药学进展, 2002, 26(4):223-226. |
| [5] | 丁大连, 亓卫东, 张梅, 等. 顺铂及其耳毒性[J]. 中华耳科学杂志, 2008, 6(2):125-133. |
| [6] | 刘芳, 卢长明. 植物非特异脂质转运蛋白研究现状与展望[J]. 遗传, 2013, 35(3):307-314. |
| [7] | 汪少芸, 叶秀云, 饶平凡. 植物非特异脂转移蛋白的研究[J]. 生物学通报, 2004, 39(9):11-12. |
| [8] | 金大伟, 杨军, 李锋, 等. 烟草非特异性脂质转移蛋白基因的克隆与表达分析[J]. 烟草科技, 2015, 48(1):12-20. |
| [9] | Gincel E, Simorre JP, Caille A. et al. Three dimensional structures in solution of a wheat lipid-transfer protein from multidimensional H-NMR date[J]. Eur Biochem, 1994, 226:413-422. |
| [10] | Borges JP, Jauneau A, Brulé C, et al. The lipid transfer proteins(LTP)essentially concentrate in the skin of Rosaceae fruits as cell surface exposed allergens[J]. Plant Physiology and Biochemistry, 2006, 44:535-542. |
| [11] | Kim TH, Kim MC, Park JH, et al. Differential expression of rice lipid transfer protein gene(LTP)classes in response to abscisic acid, salt, salicylic acid, and the fungal pathogen Magnaporthe grisea[J]. Journal of Plant Biology, 2006, 49(5):371-375. |
| [12] | Linda SM, Li T, Su MX, et al. Isolation, characterization, molecular cloning and modeling of a new lipid transfer protein with antiviral and anti-proliferative activities from Narcissus tazetta[J]. Peptides, 2008, 29:2101-2109. |
| [13] | Lin P, Xia LX, Wong JH, et al. Lipid transfer proteins from Brassica campestris and mung bean surpass mung bean chitinase in exploitability[J]. Journal of Peptide Science, 2007, 13:642-648. |
| [14] | Tousheh M, Darvishi FZ, Miroliaei M. A novel biological role for nsLTP2 from Oriza sativa:potential incorporation with anticancer agents, nucleosides and their analogues[J]. Computational Biology and Chemistry, 2015, 58:9-18. |
| [15] | 赵婷, 王长虹, 王峥涛. 骆驼蓬属植物中生物碱类化学成分及其药理活性研究进展[J]. 国际药学研究杂志, 2010, 37(5):333-345. |
| [16] | 马晓瑾, 吴婷, 罗晶晶, 等. 骆驼蓬种子中一种具抗肿瘤活性蛋白的分离纯化及鉴定[J]. 天然产物研究与开发, 2012, 24:1020-1025. |
| [17] | 赵晶, 吕慧, 段晓梅, 等. 重组骆驼蓬脂转移蛋白对B16实体瘤的抑制作用[J]. 生物技术, 2013, 23(6):86-89. . |
| [18] | 王军, 谭诗云, 陈建华, 等. 多肽Pll0结合顺铂对多种肿瘤细胞杀伤作用的研究[J]. 中国药理学通报, 2011, 27(12):1728-1731. |
| [19] | 万婷, 李连宏. 顺铂肾毒性机制及其防护的研究进展[J]. 中华临床医师杂志, 2013, 7(14):192-193. |
| [20] | 赵晶, 吕慧, 贾依娜古丽·朱玛拜, 等. 骆驼蓬脂转移蛋白基因真核表达载体的构建及其体内外抗瘤效应的研究[J]. 中国生物工程杂志, 2014, 34(8):7-13. |
| [21] | 蔡先彬, 荆绪斌, 胡辉, 等. 活性氧在顺铂诱导食管癌细胞EC-109凋亡中的作用[J]. 癌症, 2006, 25(4):427-431. |
| [22] | 尤寿江, 石际俊, 张艳林, 等. ROS介导的自噬及其在相关疾病中的作用[J]. 中国病理生理杂志, 2011, 27(1):187-190. |
| [23] | 梁晓松, 陈素钻, 俞晶, 等. 大黄素联合顺铂对食管癌EC9706细胞增殖的影响[J]. 广东医学, 2011, 32(14):1819-1821. |
| [24] | 孙建平, 谭竹钧, 韩雅莉. 细胞凋亡检测方法的研究进展[J]. 生物技术通报, 2012(1):54-59. |
| [25] | 刘浩, 蒋琛琛, 程秀, 等. 白藜芦醇对人黑色素瘤细胞增殖及凋亡的影响[J]. 中国药理学通报, 2011, 27(7):998-1002. |