2. 大连海洋大学海洋科技与环境学院,大连 116023;
3. 大连天正实业有限公司,大连 116011
2. College of Marine Science and Environment,Dalian Ocean University,Dalian 116023;
3. Dalian Tianzheng Industrial Corporation Limited,Dalian 116011
红鳍东方鲀(Takifugu rubripes)是近海底层肉食性鱼类,其生殖腺和肝脏等内脏中产生的河豚毒具有潜在的医药开发价值,在临床上具有广阔的前景[1]。红鳍东方鲀是一种重要的经济鱼类,但水环境中存在的大量细菌和病毒使鱼类的皮肤和黏膜不断受到侵袭,特别是弧菌、爱德华氏菌等的感染给红鳍东方鲀的大规模养殖造成严重损失。干扰素(Interferon,IFN)在1957年首次被Isaacs提出,干扰素系统是脊椎动物抵抗病原体侵害的天然防御系统之一,在先天性免疫应答中能够有效广泛地抑制感染的传播[2]。IFNs 是一个蛋白家族,由3种主要类型组成:Ⅰ型干扰素(IFN-α、-β和-ω),Ⅱ型干扰素(IFN-γ)和Ⅲ型干扰素(IFN-λ1、IFN-λ2和IFN-λ3,又分别被称为IL-29、IL-28A和IL-28B),IFNs 对很多生物反应有影响,包括对病原体的防御机制、对先天性和适应性免疫应答中效应细胞的管理和抗肿瘤效应[3]。IFNs 通过细胞表面受体作用使细胞产生抗病毒蛋白,抑制病毒在宿主细胞中的复制。另外,IFNs 还可增强自然杀伤细胞(NK细胞)、巨噬细胞和T淋巴细胞的活力,从而起到免疫调节作用,增强抗病毒能力,对细胞生长和细胞分化也有很重要的调节活性 [4, 5, 6]。
IFNγ主要由T细胞和NK细胞分泌,对抵抗病毒感染和胞内细菌感染至关重要,能够直接增强肿瘤细胞的免疫原性,激发对转化细胞的免疫应答[7, 8, 9]。IFNγ在免疫系统中的重要性除了其直接抑制病毒复制的能力外,更重要的是源于它对免疫刺激和免疫调节的影响,而且还能够直接或间接地上调主要组织相容性复合体(MHCⅠ和MHCⅡ)的抗原提呈作用[10]。IFNγ同时还是巨噬细胞的激活剂,能够增强巨噬细胞杀死细菌、原生动物和病毒性病原体的能力[11]。哺乳动物的IFNγ能够保护宿主抵抗胞内病原体,如利什曼原虫、李斯特单核细胞增生菌和结核分枝杆菌等的侵染,这使得IFNγ在调节巨噬细胞介导的抗菌反应中的作用更为明显[12]。IFNγ基因已经在许多鱼类中被克隆出来。斑点叉尾鮰(Channel catfish)能够产生两种IFNγ mRNAs(IFN-γ1和IFN-γ2),这两个mRNA在不同的组织和细胞类型中有不同的表达形式,牙鲆(Paralichthys olivaceus)同样有两种IFNγ转录本(IFN-γ1和IFN-γ2),这两个转录本非常相似,仅有3个核苷酸不同[13]。红鳍东方鲀的IFNγ基因在2004年首次被Zou [14]克隆出来。
在国内,应用于禽、猪、牛、犬等的基因工程干扰素抗病毒制剂已得到广泛发展[15]。徐正中等[16]通过原核表达得到的重组牛IFNγ蛋白,有较高的抵抗病毒的能力。代丽等[17]克隆了鸡IFNγ基因,并通过原核表达得到该重组蛋白,利用鸡成纤维细胞—新城疫(CEF-NDV)系统检测该重组蛋白的抗病毒活性发现,经过稀释后的重组蛋白能有效抵抗病毒的攻击。崔然[18]构建了猪IFNγ基因的原核表达载体,并纯化出该重组蛋白,进一步研究发现该蛋白具有抵抗猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndromt virus,PRRSV)和水泡性口炎病毒(Vesicular stomatitis virtes,VSV)的能力。张海玲等[19]构建了北极狐IFNγ的原核表达载体,并以包涵体的形式成功表达了该目的蛋白的成熟肽。活性测定表明,在非洲绿猴肾细胞(Vero)和犬肾细胞(MDCK)细胞中复性后的重组北极狐IFNγ蛋白能够抑制VSV病毒的繁殖。然而,有关鱼类基因工程干扰素制剂的研究并不是很多,本研究通过基因重组技术将红鳍东方鲀IFNγ基因连接到表达载体pET-32a(+),并转化到大肠杆菌中表达,得到重组红鳍东方鲀IFNγ蛋白,旨在为进一步深入研究重组红鳍东方鲀IFNγ蛋白活性及其在红鳍东方鲀健康养殖上的应用奠定基础。
1 材料与方法 1.1 材料实验用健康红鳍东方鲀采自大连天正实业有限公司。采集红鳍东方鲀肾脏组织并迅速冻存于液氮中,存于-80℃冰箱备用。
1.2 方法 1.2.1 总RNA的提取取-80℃冰箱中冻存的红鳍东方鲀肾脏组织约0.1 g,按照RNAiso Plus试剂盒(TaKaRa公司)的方法提取总RNA,经1%的琼脂糖凝胶电泳检测总RNA的质量,-80℃保存备用。
1.2.2 红鳍东方鲀干扰素γ基因的扩增根据已发表在GenBank上的红鳍东方鲀IFNγ基因(AJ616216.2)序列,利用生物信息学软件Primer Premier5.0 设计引物为:IFN-F:5'-CATGCCATGGGCTCCTACATCCCAGTAGAAATG-3'(下划线部分为NcoⅠ酶切位点);IFN-R:5'-CCGCTCGAGATGACCTCGAATCGACATCT-3'(下划线部分为XhoⅠ酶切位点)。
将实验提取的RNA利用PrimeScript RT reagent kit Perfect Real Time 反转录试剂盒进行反转录得到cDNA。以该cDNA为模板用引物IFN-F/IFN-R进行PCR扩增IFNγ基因。将扩增片段与pMD19-T载体相连并转化入大肠杆菌DH5α感受态细胞,涂平板(含100 μg/mL氨苄青霉素)筛选、挑取单克隆菌落,送生工生物工程(上海)股份有限公司测序。
1.2.3 IFNγ蛋白的生物信息学分析选取红鳍东方鲀(T. rubripes,CAE82301.2)、斜带石斑鱼(Epine-phelus coioides,AFM31242.1)、绿河鲀(Tetraodon nigroviridis,AHZ62714.1)、大西洋大比目鱼(Hipp-oglossus hippoglossus,ADP55200.1),大西洋鲑(Sa-lmo salar,NP_001165275.1)、虹鳟(Oncorhynchus mykiss,NP_001118092.1)、大西洋鳕鱼(Gadus mo-rhua,ACN41957.1)、原鸽(Columba livia,EMC77-410.1),美洲旱獭(Marmota monax,AAP80574.1)和马(Equus caballus,ABS28998.1)的IFNγ氨基酸序列,利用ClustalW和MEGA5.0软件进行多序列比对并构建系统进化树。
1.2.4 原核表达载体pET-32a-IFNγ的构建以重组质粒pMD19-T-IFNγ为模板进行PCR,扩增条件为:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,30个循环;72℃延伸10 min。产物经1%琼脂糖凝胶检测后进行胶回收,将PCR产物和表达载体pET-32a(+)(本实验室保存)分别进行NcoⅠ和XhoⅠ双酶切后用T4 DNA Ligase 连接,转化至E.coli DH5α感受态细胞,挑取单菌落扩大培养后提取质粒,质粒经PCR及双酶切鉴定为阳性后送生工生物工程(上海)股份有限公司测序,测序正确的阳性重组质粒命名为pET-32a-IFNγ。
1.2.5 原核表达载体的诱导表达测序鉴定正确的重组质粒pET-32a-IFNγ转化至BL21(DE3)感受态细胞(本实验室保存),37℃培养过夜,按1:100转接至100 mL LB培养基(含Amp)震荡培养。当菌液OD600=0.6左右时以1.0 mmol/L IPTG 37℃诱导4 h,取1 mL菌液离心弃上清,沉淀用100 μL PBS重悬,加入25 μL上样缓冲液煮沸10 min后SDS-PAGE电泳,鉴定目的蛋白的表达情况。
1.2.6 目的融合蛋白的分离纯化及Westernblotting鉴定 将100 mL经IPTG诱导后的菌液6 000×g 离心10 min,弃上清,用20 mL PBS重悬菌体;然后对其超声波破碎(工作9 s间歇9 s),12 000×g离心20 min;将上清和沉淀分别过ProteinIsoTM Ni-NTA Resin(全式金生物技术有限公司)纯化目的融合蛋白;将收集的洗脱液转入透析袋内,在 0.5 mol/L、pH为8.0 的Tris-HCl缓冲液中透析过夜;将透析产物进行SDS-PAGE凝胶电泳检测。
将纯化的融合蛋白经SDS-PAGE,100 mA、1.5 h转印至NC膜上。然后将NC膜置于封闭液中浸泡30 min,加入His-tag抗体(天根生化科技有限公司)孵育1 h,加入羊抗鼠IgG-HRP(天根生化科技有限公司)孵育30 min。以上各步骤之间用PBS缓冲液清洗3次,每次10 min。将NC膜放入避光处加显色液,10 min之后在凝胶成像系统观察结果并拍照。
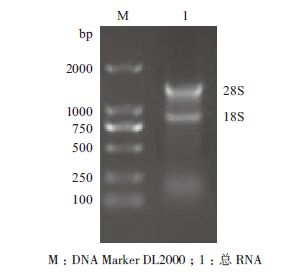
2 结果 2.1 RNA提取结果利用 RNAiso plus提取红鳍东方鲀肾脏总RNA,1%琼脂糖凝胶检测,在凝胶成像仪下观察,检测结果(图 1)显示,28S和18S条带清晰,可用于后续反转录实验。
|
| 图 1 红鳍东方鲀总RNA 琼脂糖凝胶电泳结果 |
将提取的总RNA反转录后用于IFNγ基因成熟肽序列的PCR扩增,结果(图 2)表明,在约522 bp处出现特异性条带,与预期大小一致,因此初步判断该基因的成熟肽序列已被扩增出来。

|
| 图 2 IFNγ 基因的PCR 扩增结果 |
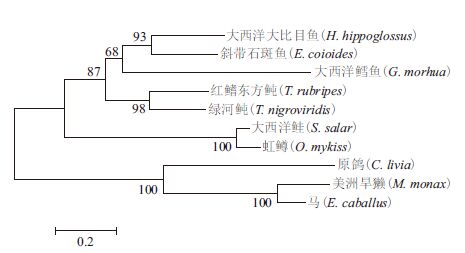
经多序列比对发现,T. rubripes IFNγ的氨基酸序列与T. nigroviridis一致性为62%,同源性较高,与E. coioides和H. hippoglossus的相似性分别为47%和43%,同源性较低。系统进化树分析(图 3)表明,T. rubripes与T. nigroviridis聚为一支,亲缘关系最近。
|
| 图 3 IFNγ 的系统进化树分析 |
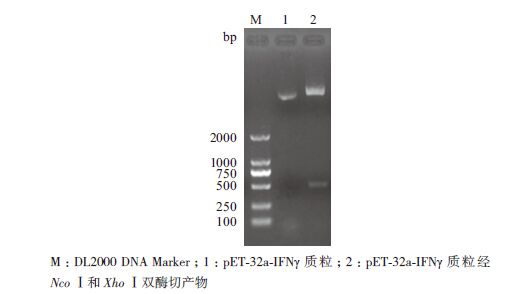
图 4显示,重组表达载体pET-32a-IFNγ经双酶切后在522 bp处出现单一条带,说明IFNγ基因已连入pET-32a(+)载体。将经过双酶切验证的重组质粒测序,结果表明已成功将IFNγ基因连接到原核表达载体pET-32a(+),重组表达载体构建成功。
|
| 图 4 pET-32a-IFNγ 质粒的双酶切鉴定结果 |
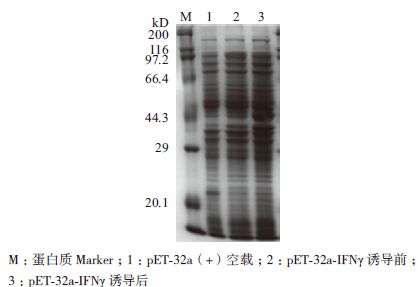
将构建好的重组表达载体pET-32a-IFNγ导入表达宿主菌BL21(DE3),经IPTG诱导表达后进行SDS-PAGE分析。结果(图 5)表明,与pET-32a空载相比重组质粒pET-32a-IFNγ在BL21(DE3)中表达的蛋白图谱中明显多出一条特异的诱导表达条带,大小在37.8 kD左右,与预期大小一致,故初步判断已诱导表达出目的蛋白。进一步优化表达条件发现pET-32a-IFNγ在IPTG浓度为1 mmol/L,诱导6 h,诱导温度为37℃时表达量最多(图 6),而诱导时间增加到8 h时相比6 h的表达量并无增加。
|
| 图 5 重组表达载体pET-32a-IFNγ 的表达分析 |
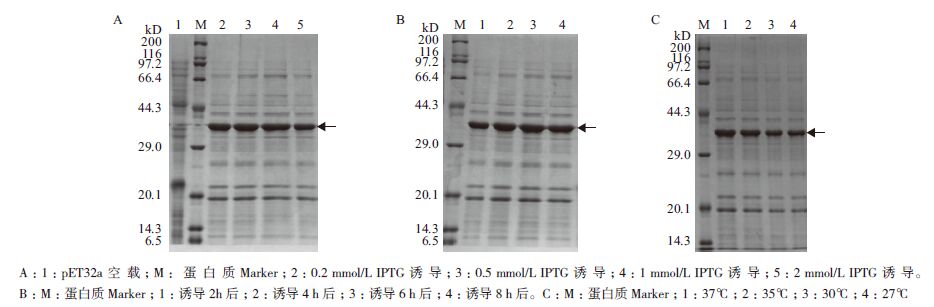
|
| 图 6 不同条件下pET-32a-IFNγ 在BL21(DE3)细胞中的表达情况 |
用Ni柱分别对IFNγ融合蛋白进行破碎后沉淀和上清的纯化发现,在破碎后的沉淀中纯化得到以包涵体形式存在的IFNγ融合蛋白。Western blotting检测(图 7)表明,在37.8 kD处出现一条单一条带,带有His标签的重组蛋白得到表达,进一步说明纯化得到的蛋白即为重组红鳍东方鲀IFNγ蛋白。

|
| 图 7 纯化的IFNγ 融合蛋白及Western blotting 检测结果 |
近年来,红鳍东方鲀的病害不断增多,对其病害的防治除了提供良好的养殖环境和进行药物治疗等措施外,还需提高鱼体自身的免疫能力。已有的研究表明,干扰素作为一种细胞因子在增强机体免疫力方面具有重要的作用。在哺乳动物和鸟类中,重组的IFN-α/β已被广泛用于肿瘤的治疗和病毒性疾病的研究,一些鱼类重组干扰素的活性已通过ZF4细胞进行了检测,该细胞来源于斑马鱼的胚胎细胞[20]。实验证明加入了重组IFN的ZF4细胞能够增强对黑鱼弹状病毒(Snakehead rhabdovirus,SHRV)的抵抗能力,重组的鲑鱼和鲶鱼IFNs能够保护TO细胞免受传染性胰脏坏死病毒(Infectious pancreatic necrosis virus,IPNV)的侵染和CCO细胞免受斑点叉尾鮰疱疹病毒(Channel catfish herpesvirus,CCV)的侵染[21, 22]。重组的牙鲆IFNγ能够增强牙鲆抵抗爱德华氏菌的能力[23]。
本研究通过克隆红鳍东方鲀干扰素γ基因,构建重组表达载体,在大肠杆菌细胞中得到了融合表达的IFNγ。但在对重组载体进行诱导表达时,发现未加IPTG诱导的菌体和含有pET-32a空载体的菌体均出现少量与目的蛋白大小相似的蛋白条带,这可能是由于菌体中含有与目的蛋白大小相似的其他蛋白造成的。另外,pET表达系统中存在目的蛋白的本底表达也会导致未加诱导剂的情况下同样有目的蛋白表达的情况。为了进一步证明目的蛋白得到正确表达,本研究进行了Western blotting检测。因为本实验选用的是pET-32a构建表达载体,所表达的目的蛋白是带有His标签的融合蛋白,因此采用His标签抗体对诱导表达的蛋白进行了Western blotting检测,表明该蛋白能够与抗His标签的单克隆抗体发生特异反应,His标签得到正确表达,同时也表明载体按照正确的翻译框架翻译并表达出目的蛋白。因此,本研究通过诱导表达并纯化得到的蛋白不仅大小与预期一致而且带有His标签,而这种情况只有目的蛋白具有,可以说明诱导表达的蛋白即为重组红鳍东方鲀IFNγ蛋白。在原核表达中除了目的基因本身序列对表达量有影响之外,诱导表达的条件对目的基因表达量同样具有重要影响。在本研究中通过调整诱导表达时的时间、温度和诱导剂的浓度,对重组载体的最佳表达条件进行了探索,最终确定了重组红鳍东方鲀IFNγ蛋白在IPTG为1 mmol/L,37℃条件下诱导6 h时达到最大表达量,为今后重组红鳍东方鲀IFNγ的产业化生产奠定基础。
4 结论本研究克隆并获得了红鳍东方鲀干扰素γ(IFNγ)成熟肽的基因序列,构建了重组表达载体pET-32a-IFNγ,经转化和诱导,重组体在大肠杆菌E. coli BL21(DE3)细胞中得以表达。利用Ni柱分离和纯化得到的融合蛋白经Western blotting分析,证明为重组的红鳍东方鲀IFNγ。
| [1] | 黄培卫, 张海发, 王云新, 等. 红鳍东方鲀人工育苗[J]. 海洋与渔业, 2006(4):19. |
| [2] | Schoenborn JR, Wilson CB. Regulation of interferon-gamma during innate and adaptive immune responses[J]. Adv Immunol, 2007, 96:41-101. |
| [3] | 田硕, 徐晨, 姚文兵. 长效干扰素研究进展[J]. 中国生物工程杂志, 2010, 30(5):122-127. |
| [4] | Stark GR, Kerr IM, Williams BR, et al. How cells respond to interferons[J]. Annu Rev Biochem, 1998(67):227-264. |
| [5] | Sen GC. Viruses and interferuns[J]. Annu Rev Microbiol, 2001(55):255-281. |
| [6] | 张义兵, 王铁辉, 李戈强, 等. 鲫鱼囊胚细胞干扰素的诱导及部分特性的研究[J]. 中国病毒学, 2000, 15(2):163-169. |
| [7] | 黄贝, 陈善楠, 黄文树, 等. 斜带石斑鱼IFN-γ基因的克隆与表达分析[J]. 中国水产科学, 2013, 20(2):269-275. |
| [8] | Langevin C, Aleksejeva E, Passoni G, et al. The antiviral innate immune response in fish: evolution and conservation of the IFN system[J]. J Mol Biol, 2013, 425(24):4904-4920. |
| [9] | Aggad D, Stein C, Sieger D, et al. In vivo analysis of Ifn-γ1 and Ifn-γ2 signaling in zebrafish[J]. J Immunol, 2010, 185(11):6774-6782. |
| [10] | Berenson LS, Gavrieli M, Farrar JD, et al. Distinct characteristics of murine STAT4 activation in response to IL-12 and IFN-alpha[J]. J Immunol, 2006, 177(8):5195-5203. |
| [11] | Schroder K, Hertzog PJ, Ravasi T, et al. Interferon-gamma:an ove-rview of signals, mechanisms and functions[J]. J Leukoc Biol, 2004, 75(2):163-189. |
| [12] | Savan R, Ravichandran S, Collins JR, et al. Structural conservation of interferon gamma among vertebrates[J]. Cytokine Growth Factor Rev, 2009, 20(2):115-124. |
| [13] | Zou J, Chang M, Nie P, et al. Origin and evolution of the RIG-I like RNA helicase gene family[J]. BMC Evol Biol, 2009, 9:85. |
| [14] | Zou J, Yoshiura Y, Dijkstra JM, et al. Identification of an interferon gamma homologue in Fugu, Takifugu rubripes[J]. Fish Shellfish Immunol, 2004, 17(4):403-409. |
| [15] | 吴晓莉. 干扰素的分类及其在兽医临床中的应用[J]. 养殖技术顾问, 2009, 11:128. |
| [16] | 徐正中, 陈祥, 单锋丽, 等. 牛γ干扰素的表达及其抗病毒活性测定[J]. 生物工程学报, 2011, 27(2):269-276. |
| [17] | 代丽, 单安山, 孙进华, 等. 鸡γ-干扰素的可溶性表达及纯化产物的抗NDV活性[J]. 东北农业大学学报, 2011, 42(9):37-42. |
| [18] | 崔然. 猪α、β、γ干扰素的表达及抗病毒活性的检测[D]. 泰安:山东农业大学, 2012. |
| [19] | 张海玲, 柴秀丽, 罗国良, 等. 北极狐γ-干扰素cDNA的克隆、表达及活性测定[J]. 生物工程学报, 2008, 24(9):1625-1630. |
| [20] | Li ZS, Xu XP, Huang LC, et al. Administration of recombinant IFN1 protects zebrafish (Danio rerio)from ISKNV infection[J]. Fish Shellfish Immunol, 2010, 29(3):399-406. |
| [21] | Aggad D, Mazel M, Boudinot P, et al. The two groups of zebrafish virus-induced interferons signal via distinct receptors with specific and shared chains[J]. J Immunol, 2009, 183(6):3924-3931. |
| [22] | Long S, Wilson M, Bengten E, et al. Identification of a cDNA encoding channel catfish interferon[J]. Dev Comp Immunol, 2004, 28(2):97-111. |
| [23] | 刘运龙, 程远国, 刘学龙. 干扰素研究进展[J]. 动物医学进展, 2008, 29(2):85-89. |




