2. 广东药学院生物制药研究所,广州 510006
2. Institute of Biopharmaceutics,Guangdong Pharmaceutical University,Guangzhou 510006
主要组织相容性复合体(Major histocompatibility complex,MHC)是染色体上紧密连锁的基因群组成具有高度多态性的区域,其编码产物在脊椎动物免疫系统中发挥重要功能[1]。自1990年Hashimoto等[2]首次克隆鲤(Cyprinus carpio)MHC基因以来,已对具有重要经济价值的鱼类MHC基因及其多态性开展了广泛研究,其中包括:鲤[3, 4]、虹鳟(Oncorh-ynchus mykiss)[5, 6, 7]、斑点叉尾鮰(Letalurus puneta-us)[8]、真鲷(Chrysophrys major)[9, 10]、牙鲆(Pa-ralichthys olivaceus)[11, 12]和海鲈(Dicentrarchus la-brax)[13]等。MHC I类分子基因不仅具有高度的多态性,而且存在一定程度的剪切异构现象。哺乳动物具有缺失跨膜区、α3结构域及同时缺失α2和α3结构域的不同MHC I剪切异构体,可以形成膜型和分泌型等MHC I分子从而执行不同生理功能[14, 15]。选择性剪切异构体是丰富蛋白质多样性的重要途径,免疫系统的选择性剪切增加了免疫系统调控的复杂性和多样性。鱼类MHC基因的分子结构、组成及多态性与哺乳动物MHC基因具有相似性,但是作为低等脊椎动物其MHC I类分子特征也存在一定的差异[16, 17, 18]。在硬骨鱼大眼鲈(Stizostedion vitreum)克隆一类MHC I cDNA序列,由于二核苷酸序列重复破坏了跨膜区的疏水性产生潜在分泌型MHC I分子[19],其在鱼类免疫系统中的功能尚未明确。哺乳动物膜型和分泌型MHC I分子表达形式不同,其功能差异显著[14]。硬骨鱼MHC I基因在多数组织中均有表达,其中在肾脏、胸腺、脾、心脏和肠中表达较强,在脑、肝脏和肌肉中表达较弱[5, 19]。然而,硬骨鱼类膜型和分泌型MHC I类分子的表达特征及其生物学功能还有待进一步探索。因此,对鱼类不同类型优势MHC I等位基因组成和功能进行研究,可为了解鱼类免疫系统的组成和免疫应答机制奠定基础。
乌鳢(Channa argus)属鲈形目(Perciformes)、鳢科(Channidae)、鳢属(Channa),其肉质细腻、营养价值颇高,是我国较为重要的淡水养殖鱼类之一,然而高密度集约化养殖引发的病害成为限制乌鳢养殖业发展的瓶颈[20]。本研究对乌鳢MHC I基因进行克隆和序列分析,检测MHC I在乌鳢组织中的表达情况,并进一步分析Char-Ia和Char-Ib两类MHC I基因在组织中表达的差异,旨在探究其MHC基因的分子特征、表达方式及多态性。
1 材料与方法 1.1 材料乌鳢购买自湖北武汉水果湖水产市场,个体约250 g,实验室控温养殖一周。新鲜的组织材料放入液氮中保存。
1.2 方法 1.2.1 MHCI cDNA序列 取乌鳢新鲜头肾组织材料100 mg,Trizol试剂盒提取组织总RNA(Invitrogen),mRNA纯化试剂盒制备mRNA(Promega)。以poly I:C诱导乌鳢为Tester,对照为Driver,利用差减杂交技术构建头肾差减cDNA文库(Clontech)。通过对文库序列的筛选、克隆与测序,得到834 bp的cDNA序列,经NCBI数据库比对显示其与已知MHC I基因同源。
1.2.2 RACE-PCR获得MHCI基因全长 5'端RA-CE扩增,按BD SMARTTM RACE cDNA Amplification Kit合成全长cDNA(Clontech)。引物设计,见表 1。RACE-PCR使用热启动和降落PCR程序:94℃预变性2 min;94℃变性30 s,65℃退火30 s(每轮循环降1℃),72℃延伸1 min,10个循环;94℃变性30 s,55℃退火30 s,72℃延伸1 min,25个循环;72℃延伸6 min。第二轮巢式PCR使用5' nested primer和MHC-I-R2,以1 μL第一轮PCR产物为模板进行第二轮PCR反应。5' RACE测序结果显示,获得显著差异的MHC I cDNA序列,在开放阅读框起始位置分别设计引物MHC-Ia-F和 MHC-Ib-F。使用接头引物3' Adapter与基因特异性引物MHC-Ia-F和 MHC-Ib-F分别扩增MHC I基因3'末端,循环原理:94℃变性30 s,57℃退火30 s,72℃延伸2 min;72℃延伸6 min。
PCR扩增产物经琼脂糖凝胶电泳分离,目的片段切胶回收(Omega)。纯化后PCR产物与pMD18-T 载体(TaKaRa)相连接,转化制备的DH5α 感受态细胞。挑选单克隆进行菌落PCR鉴定,阳性克隆测序。通过NCBI网站(http://www.ncbi.nlm.nib.gov/blast)BLAST程序进行序列相似性比对,ExPASy网站(http://au.expasy.org)翻译软件获得氨基酸序列。由Cluatal W 1.8程序完成氨基酸序列的同源性比较分析,并通过MEGA 5.1构建系统进化树。
1.2.4 MHCI 组织表达分析 取乌鳢头肾、后肾、肠、肌肉、心脏、脾、肝脏、脑、鳃和外周血等组织材料,液氮研磨,提取组织总RNA,经过DNase I 消化(TaKaRa)后,使用逆转录酶合成cDNA一链(TaKaRa)。设计3对特异性引物MHC-I-TF/TR、MHC-Ia-F/MHC-I-R2和MHC-Ib-F/MHC-I-R2分别扩增203 bp MHC I、648 bp Char-Ia和651 bp Char-Ib。选择β-actin为内参。用上述4对引物分别进行PCR反应:94℃ 2 min;94℃ 30 s,57℃ 30 s,72℃ Char-Ia 和 Char-Ib延伸1 min,MHC I和 β-actin延伸30 s,26个循环;最后72℃ 6 min。
2 结果 2.1 MHC I基因克隆根据筛选获得的MHC I cDNA序列,通过基因专一性引物及接头引物进行5' 端RACE-PCR和3'端 RACE-PCR,3条全长MHC I cDNA序列(Char-Ia-1、Char-Ia-2和Char-Ib)被分别克隆、鉴定(Gen-Bank登录号:EU864508、EU864509和EU864510)。Char-Ia-1 cDNA全长为1 826 bp,包含1 167 bp的开放阅读框,编码388 aa。3' 端非编码区具有多个mRNA不稳定信号(ATTTA)和一个加尾信号(AATAAA)。Char-Ia-2 cDNA全长为1 868 bp,包含1 083 bp的开放阅读框,编码360 aa。3' 非编码区存在6个mRNA不稳定信号和一个加尾信号。分子特征表明Char-Ia-1和Char-Ia-2编码MHC I 包含跨膜去,是一类膜型MHC I分子。Char-Ib cDNA全长为1 179 bp,包含978 bp的开放阅读框,编码325 aa,显著截短的羧基末端显示Char-Ib为潜在的分泌型Ⅰ类分子。
2.2 MHC I蛋白质序列分析根据MHC I cDNA 全长序列及由此推测的蛋白质序列,乌鳢MHC I 蛋白质序列与已知同源的蛋白质均具有较高的相似性,在多个位点均具有保守的氨基酸残基(图 1)。一个潜在的N糖基化位点位于胞外结构域α1区,参与二硫键形成的4个保守半胱氨酸分布于胞外结构域α2和α3。Char-Ia-1、Char-Ia-2和Char-Ib推测的氨基酸序列均具有保守的多肽结合区和B2m结合位点。虽然硬骨鱼类位于胞外结构域α3区的CD8作用位点不完全保守,但是Char-Ia-1、Char-Ia-2和Char-Ib CD8作用位点富含酸性氨基酸,其中8个氨基酸中有4个为酸性氨基酸。与HLA-A氨基酸序列相比,乌鳢与其他硬骨鱼MHC I在α1(54-55)区和α3(189-190)存在明显的氨基酸序列缺失。Char-Ia-1与Char-Ia-2的氨基酸相似性75%,但是Char-Ia-1和Char-Ia-2具有完全不同的细胞质区。Char-Ib与Char-Ia-1和Char-Ia-2的相似性较低,其中羧基末端差异显著。

|
| 图 1 乌鳢Char-Ia-1、Char-Ia-2 和Char-Ib 与其他脊椎动物MHC I 基因编码的氨基酸序列比较 |
系统进化树分析(图 2)显示,Char-Ia-1、Char-Ia-2和Char-Ib处于进化树上不同的分支。Char-Ia-1和Char-Ia-2集成一簇,其亲缘关系较近。Char-Ib单独形成一个进化分支,与Char-Ia-1和Char-Ia-2关系较远。

|
| 图 2 脊椎动物MHC I 氨基酸序列构建的系统进化树 |
RT-PCR检测乌鳢MHC I mRNA在头肾、后肾、肠、肌肉、心脏、脾、肝脏、脑、鳃和外周血组织中的表达水平。结果(图 3)显示,乌鳢MHC I组成型表达于所有组织中,Char-Ia则以较低的浓度表达于所有组织,而Char-Ib主要表达于脾、肠、鳃和外周血,呈现明显的组织表达特异性。
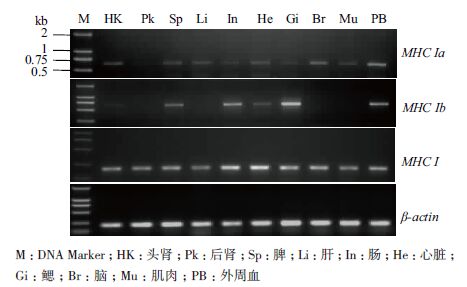
|
| 图 3 乌鳢MHC I 在组织中的表达情况 |
应用抑制差减杂交(SHH)和快速扩增cDNA末端(RACE)技术克隆并鉴定了乌鳢3条全长MHC I cDNA 序列Char-Ia-1、Char-Ia-2和Char-Ib,编码的MHC I分子均包括导肽、胞外结构域(α1、α2和α3)、跨膜区和细胞质区。Char-Ia-1和Char-Ia-2在α1结构域呈现高度的序列相似性,然而在跨膜区和细胞质区的显著差异表明二者应来源于MHC I基因的重组[17]。Char-Ia和Char-Ib在3' UTR呈现较小的序列相似性,在胞外结构域、跨膜区和细胞质区同源性均较低;系统进化树分析显示Char-Ia-1和Char-Ia-2聚为一类,与Char-Ib处于不同的进化分支上,因此当前的数据支持Char-Ia和Char-Ib分别由不同MHC I基因座编码。氨基酸序列比对显示乌鳢MHC I分子与抗原肽结合的关键氨基酸残基较保守,与其他硬骨鱼MHC I分子一样在α1和α3结构域均出现明显的氨基酸残基缺失[19]。MHC I细胞质区存在丝氨酸磷酸化位点[4],然而乌鳢Char-Ia-1和Char-Ia-2编码MHC I的细胞质区分别包含4个和9个丝氨酸残基,氨基酸序列的相似性尚不能确定发挥磷酸化作用的丝氨酸残基。与Char-Ia-1和Char-Ia-2相比,Char-Ib具有较短的跨膜区和细胞质区,显著截短的羧基末端推测Char-Ib为一类潜在的分泌型MHC I分子。在大眼鲈中发现由于二核苷酸序列多次重复插入MHC I α3 结构域末端,破坏了跨膜区阅读框从而产生分泌型MHC I分子[19]。虽然乌鳢Char-Ib多肽的羧基末端存在3个丝氨酸残基,然而分泌型与膜型MHC I分子的丝氨酸残基可能执行不同的生理功能。
对虹鳟和大眼狮鲈的Northern blot检测结果显示,MHC I基因主要表达于肾脏、胸腺、脾、心脏和肠[5, 19]。通过半定量RT-PCR检测显示乌鳢MHC I基因组成型表达于被检测组织,其中在肠、鳃和心脏的表达量略高。值得注意的是Char-Ia和Char-Ib在检测组织中的表达水平存在显著差异。Char-Ia以较低的浓度表达于所有被检测组织,而Char-Ib主要表达于脾、肠、鳃和外周血,提示Char-Ib的表达具有组织特异性。在硬骨鱼类,检测斑点叉尾鮰MHC I基因也发现差异表达的现象[8]。哺乳类H-2 mRNA在肝脏限制性表达,其翻译的MHC I分子仅具有细胞外区域,推测为一类分泌型MHC I分子[21, 22]。组织特异性表达与蛋白质序列特征表明乌鳢Char-Ib编码多肽具备分泌型MHC I分子特征。这类MHC分子在调控T细胞与抗原呈递细胞相互作用以及控制自然杀伤细胞的功能中发挥重要作用[15, 22]。乌鳢MHC I的克隆与表达研究有助于探讨鱼类MHC I基因的多态性。
4 结论利用RACE 技术从乌鳢中克隆并鉴定了MHC I cDNA序列Char-Ia-1、Char-Ia-2和Char-Ib,并对蛋白质序列进行了详细的位点分析和结构域预测。其中,Char-Ib 具有显著截短的羧基末端呈现分泌型MHC I类分子特征。进化树分析表明Char-Ia与Char-Ib处于不同的进化分支上,应由不同MHC I基因座编码。RT-PCR分析显示Char-Ia与Char-Ib组织表达差异显著,提示两类MHC I分子在鱼类免疫反应中发挥不同的生理作用。
| [1] | Grimholt U, Tsukamoto K, Azuma T, et al. A comprehensive analysis of teleost MHC class I sequences[J]. BMC Evolutionary Biology, 2015, 15:32. |
| [2] | Hashimoto K, Nakanishi T, Kurosawa Y. Isolation of carp genes encoding major histocompatibility complex antigens[J]. Proceedings of the National Academy of Sciences USA, 1990, 87(17):6863-6867. |
| [3] | Rodrigues PNS, Hermsen TT, Tombout JH, et al. Detection of MHC class II transcripts in lymphoid tissues of the common carp(Cyprinus carpio L. )[J]. Developemental and Comparative Immunology, 1995, 19(6):483-495. |
| [4] | van Erp SHM, Dixon B, Figueroa F, et al. Identification and characterization of a new major histocompatibility complex class I gene from carp(Cyprinus carpio L. )[J]. Immunogenetics, 1996, 44(1):49-61. |
| [5] | Hansen JD, Strassburger P, Du Pasquier L. Conservation of an alpha 2 domain within the teleostean world, MHC class I from the rainbow trout Oncorhynchus mykiss[J]. Developemental and Comparative Immunology, 1996, 20(6):417-425. |
| [6] | Hansen JD, Strassburger P, Thorgaard GH, et al. Expression, linkage, and polymorphism of MHC-related genes in rainbow trout, Oncorhynchus mykiss[J]. The Journal of Immunology, 1999, 163(2):774-786. |
| [7] | 胡丹丹, 刘哲, 邵淑娟, 等. 虹鳟MHC-UBA基因遗传多样性分析[J]. 生物技术通报, 2013(7):99-106. |
| [8] | Antao AB, Wilson M, Wang J, et al. Genomic organization and differential expression of channel catfish MHC class I genes[J]. Developemental and Comparative Immunology, 2001, 25(7):579-595. |
| [9] | Chen SL, Xu MY, Hu SN, et al. Analysis of immune- relevant genes expressed in red sea bream(Chrysophrys major)spleen[J]. Aquaculture, 2004, 240:115-130. |
| [10] | Chen SL, Zhang YX, Xu MY. Molecular polymorphism and expression analysis of MHC class II B gene from red sea bream(Chrysophrys major)[J]. Developemental and Comparative Immunology, 2006, 30(4):407-418. |
| [11] | Prapansak S, Tsuyoshi O, Ikuo H, et al. Cloning, characterization and expression of cDNA containing major histocompatibility complex class I, IIa and IIb genes of Japanese flounder Paralichthys olivaceus[J]. Fisheries Science, 2004, 70(2):264-276. |
| [12] | 徐建勇, 陈松林, 毕金贞. 野生抗病牙鲆MHC IIB内含子1和外显子2序列多态性[J]. 中国水产科学, 2008, 15:593-599. |
| [13] | Pinto RD, Randelli E, Buonocore F, et al. Molecular cloning and characterization of sea bass(Dicentrarchus labrax L.)MHC class I heavy chain and β2-microglobulin[J]. Developmental and Comparative Immunology, 2013, 39(3):234-254. |
| [14] | Bontrop RE. Comparative genetics of MHC polymorphisms in different primate species:duplications and deletions[J]. Human Immunology, 2006, 67(6):388-397. |
| [15] | Dai ZX, Zhang GH, Zhang XH, et al. Identification and characterization of a novel splice variant of rhesus macaque MHC I A[J]. Molecular Immunology, 2013, 53:206-213. |
| [16] | Dijkstra JM, Katagiri T, Hosomichi K, et al. A third broad lineage of major histocompatibility complex(MHC)class I in teleost fish;MHC class II linkage and processed genes[J]. Immunogenetics, 2007, 59(4):305-321. |
| [17] | Shum BP, Guethlein L, Flodin LR, et al. Modes of salmonid MHC class I and II evolution differ from the primate paradigm[J]. The Journal of Immunology, 2001, 166(5):3297-3308. |
| [18] | Dirscherl H, McConnell SC, Yoder JA, et al. The MHC class I genes of zebrafish[J]. Developmental and Comparative Immunology, 2014, 46(1):11-23. |
| [19] | Fujiki K, Booman M, Chin-Dixon E, et al. Cloning and characteriz-ation of cDNA clones encoding membrane-bound and secreted major histocompatibility class I receptors from walleye(Stizostedion vitreum)[J]. Immunogenetics, 2001, 53(9):760-769. |
| [20] | 郭琼林, 贾伟章, 孙晓凤, 等. 养殖乌鳢类立克次体感染的组织病理学研究[J]. 水生生物学报, 2007, 31:45-52. |
| [21] | Cosman D, Kress M, Khoury G, et al. Tissue-specific expression of an unusual H-2(class I)-related gene[J]. Proceedings of the National Academy of Sciences USA, 1982, 79(16):4947-4951. |
| [22] | McConnell SC, Restaino AC, de Jong JL. Multiple divergent haplotypes express completely distinct sets of class I MHC genes in zebrafish[J]. Immunogenetics, 2014, 66(3):199-213. |





