低温会严重影响高纬度地区生活的热带和亚热带水生动物[1]。渔业养殖中,低温往往会影响和限制不耐寒鱼类的饲养,甚至造成喜温鱼类大量死亡而带来巨大的经济损失。此外,热带观赏鱼养殖过程中需要消耗大量热能,这不仅提高了饲养成本,还不利于节能减排。如果经过分子水平育种,能够降低热带观赏鱼类生活水温要求,无疑对实现绿色养殖、降低饲养成本具有重要的意义。目前鱼类抗冻相关研究主要集中在抗冻蛋白、神经系统,如脑AchE活力等方面。然而喜温鱼类,如罗非鱼在15℃就会处于休眠状态,远未到达血液冰点。因此,如何提高鱼类抗冻能力,除了上述抗冻蛋白等因素外,可能还需要寻找更多的突破口。
当环境温度降低时,细胞膜脂会倾向于凝固,而淡水鱼类往往通过合成高不饱和脂肪酸(Highly unsaturated fatty acids,HUFAs)来维持质膜的有效流动。HUFAs是指碳链长度≥20个原子且含有≥3个双键的多不饱和脂肪酸,如二十二碳六烯酸(Docosahexaenoicacids,DHA)和二十碳五烯酸(Eicosapentaenoicacid,EPA)等。研究发现HUFAs不仅是细胞膜的重要组成部分,同时在维持机体的正常机能、促进生长发育和繁殖,以及提高成活率和抵御低温环境等方面都发挥着重要的作用[2, 3]。动物HUFAs是在去饱和酶与碳链延伸酶的催化作用下,在单烯分子或从植物获得的多烯衍生物的近双键端(即从所在双键至羧基),插入另外的双键,通过缩合、还原、脱水、再还原4个步骤完成碳链的去饱和及延伸[4, 5, 6]。在三类去饱和酶中,Δ6脂肪酸去饱和酶(Δ6 fatty acyl desaturase,Fad6)属于酰基-CoA去饱和酶类,是HUFAs合成过程中的限速酶,主要催化第一步的去饱和反应,将18:3n-3(α-亚麻酸,LNA)和18:2n-6(亚油酸,LA)分别转化成18:4n-3和18:3n-6[7, 8]。此外该酶还参与了20:5n-3(EPA)到22:6n-3的合成[9, 10]。在不同鱼类物种中Fad6的活性和底物特异性存在较大差异,迄今为止只从少数几种鱼类克隆了脂肪酸去饱和酶cDNA,且主要集中在海水鱼类,淡水鱼类也仅在斑马鱼、建鲤和草鱼中开展了相关研究[11, 12, 13]。
锦鲤(Cyprinus carpiokoi)属鲤形目(Cyprinifo-rmes)、鲤科(Cyprinidae)、鲤属(Cyprinus),因色彩鲜艳丰富深受人们喜爱[14],具有重要的经济价值和观赏价值[15, 16]。作为变温淡水鱼,锦鲤可以耐受4℃的低温而不会冻死。本研究对锦鲤Fad6基因的结构和表达进行分析,旨在为研究变温鱼类耐寒能力,探索其高不饱和脂肪酸的合成机制,以及抗冻鱼类育种提供参考。
1 材料与方法 1.1 材料锦鲤购于武汉元宝山花鸟市场,按照形态、解剖进行物种鉴定。
1.2 方法 1.2.1 锦鲤组织的获取和总RNA的提取随机选取锦鲤幼鱼6尾(4-5 g)。解剖后分别迅速取少量肝、心、脑、肌肉、肠和鳃组织,编号后放入液氮中速冻,然后置于-80℃冰箱中备用。另随机选取锦鲤幼鱼18尾(4-5 g),分成3组,分别饲养于带有冷却设备的鱼缸中。3组鱼缸温度分别为20℃、14℃和8℃。幼鱼在各自水温条件下适应96 h后,分别解剖,迅速取出肝、心、脑、肌肉、肠和鳃等组织,用TRIZOL® Reagent试剂盒快速提取3组幼鱼各组织总RNA。
1.2.2 锦鲤Fad6cDNA片段的扩增、克隆和分析 取-80℃保存的锦鲤肝脏30-50 mg,迅速转入预冷的玻璃匀浆器中充分匀浆,然后使用TRIZOL® Reagent试剂盒提取肝脏总RNA,再用紫外分光光度计检测A260/A280值,最后用M-MLV Reverse Transcriptase试剂盒进行反转录合成第一链cDNA。
在NCBI(http://www.ncbi.nlm.nih.gov)数据库中参考斑马鱼(Danio rerio AF309556)、鲤鱼(Cyprinus carpio AF309557.1)和南亚野鲮(Labeo rohita EF63-4246.2)的Fad6基因保守序列,应用primer 5.0和DNAman序列分析软件进行分析,并设计如下PCR引物:正向引物5'-TTAATCGGGGAGCTTGAG-3',反向引物5'-TTGAGGTGTCCGCTGAAC-3'。以上述反转录产物为模板,通过PCR反应扩增获得锦鲤Fad6 cDNA片段。扩增程序为:预变性95℃ 5 min;变性95℃ 45 s,复性54℃ 45 s,延伸72℃ 1 min,共30个循环;最后72℃延伸8 min。用DNA Gel Extraction Kit纯化回收PCR产物,连接至pMD18-T Vector载体,转化感受态大肠杆菌细胞DHα,蓝白斑筛选阳性克隆,用Plasmid Miniprep Kit提取纯化重组质粒后,委托武汉天一辉远生物技术有限公司进行序列测定。
1.2.3 常温及不同水温培养下锦鲤幼鱼6种组织中Fad6的表达情况的检测分别取-80℃条件下保存的常温饲养锦鲤幼鱼的肝脏、心、脑、肌肉、肠和鳃组织各约50 mg,迅速转入预冷的玻璃匀浆器中充分匀浆后,用TRIZOL® Reagent分别提取不同组织的总RNA。各取5 μg总RNA为模板,采用M-MLV Reverse Transcriptase反转录合成第一链cDNA。根据上述克隆获得的Fad6 cDNA片段设计定量PCR正向引物5'-ATCGGACACCTGAAGGGAGCG-3'和反向引物5'-CGCGTTGAGCATGTTGACATCCG-3';以鲤鱼β-actin为内参基因(GenBank登录号M24113),设计正向引物5'-GCACTGCTGCTTCCTCCTCCTC-3'和反向引物5'-ACCGCAAGACTCCATACCC-3'。使用SYBR premix Ex Taq II试剂盒,对锦鲤6种组织的Fad6 cDNA样品进行荧光定量PCR,每个样品重复做3次,以空模板为阴性对照。PCR 扩增程序为:95℃预变性15 s;95℃变性20 s,56℃复性20 s,72℃延伸15 s,共39个循环;最后72℃延伸30 s。其公式为2-ΔΔC t[17]。
1.2.4 生物信息学分析利用NCBI数据库查询人、家鼠和各鱼类基因和蛋白序列;运用Vector NIT 7.0软件进行蛋白序列比对;系统进化分析采用MEGA5.1和Clustal X软件。
1.2.5 分析和统计实时荧光定量PCR结果先采用SPSS17. 0 中单因素方差法进行分析(one-way ANOVA)[18],再用Tukey’s法进行多重比较,设定分析显著差异水平为P<0.05,差异极显著水平为P<0. 01,数据采用平均值±标准误(x±s)表示。
2 结果 2.1 锦鲤Fad6 cDNA片段及氨基酸同源性分析DNA测序表明克隆获得的锦鲤Fad6 cDNA片段长度为854 bp,编码284个氨基酸片段。氨基酸分析表明,该片段包含2个组氨酸富集区(HDFGH和HFQHH)和2个跨膜结构域,与其他鱼类Fad6氨基酸序列的相似性如图 1所示。锦鲤与南亚野鲮(Labeo rohita EF634246.2)、斑马鱼(Danio rerio AF309556)、鲤鱼(Cyprinus carpio AF309557.1)、军曹鱼(Rachycentron canadum FJ440238.1)、长鳍篮子鱼(Siganus canaliculatus EF424276.2)、金枪鱼(Thunnus thynnus HQ214238.1)、虹鳟(Oncorhynchus mykiss AF301910)、金头鲷(Sparus aurata AY0557-49)和大西洋鲑(Salmo salar AY458652)等9种鱼类和人(Homo sapiens AF126799)Fad6保守片段的同源相似性,见表 1。

|
| 图 1 用Vector NIT 7.0 对锦鲤和其他鱼类Fad6 氨基酸序列的同源性比对 |
对锦鲤和人(Homo sapiens AF126799)、家鼠(Mus musculus AF126798)、南亚野鲮(Labeo rohita EF634246.2)、鲤鱼(Cyprinus carpio AF309557.1)、斑马鱼(Danio rerio AF309556)、金枪鱼(Thunnus thynnus HQ214238.1)、军曹鱼(Rachycentron canad-um FJ440238.1)、长鳍篮子鱼(Siganus canaliculatus EF424276.2)、虹鳟(Oncorhynchus mykiss AF3019-10)、金头鲷(Sparus aurata AY055749)和大西洋鲑(Salmo salar AY458652)12种动物的Fad6序列进行了比较分析,并以此构建了NJ系统进化树。结果(图 2)表明,锦鲤Fad6与南亚野鲮和鲤鱼的进化关系最近,系统进化树分析结果与传统分类学结果基本一致。

|
| 图 2 锦鲤、其他部分鱼类、人和家鼠的Fad6 系统进化关系图 |
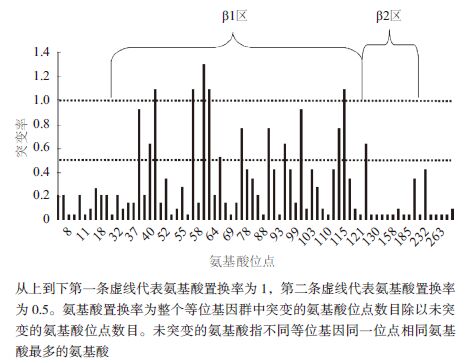
实时荧光定量PCR分析了锦鲤Fad6在肝、心、脑、肌肉、肠和鳃6种组织中的表达情况。结果(图 3)表明,Fad6在肝脏中的表达量最高,在肠、脑和心脏表达量依次降低,而在肌肉和鳃的表达量相对较低。
|
| 图 3 Δ6 去饱和酶基因在锦鲤6 种组织中的相对表达量 |
实时荧光定量PCR(图 4)表明,锦鲤肝、心、脑、肠、肌肉和鳃中Fad6在20℃、14℃和8℃下的表达量均随水温的下降而升高。

|
| 图 4 锦鲤6 种组织中Δ6 去饱和酶基因在水温20℃、14℃和8℃的相对表达量 |
Fad6是一种膜结合脂肪酸去饱和酶(Membrane-bound fatty acid desaturase),它以NADH、细胞色素b5氧化还原酶作为电子供体,催化甘油脂中的脂肪酸脱氢,是HUFAs生物合成的限速酶,在生物合成HUFAs的n-6或n-3途径中起关键作用[19]。
分析显示,本研究得到的锦鲤Fad6基因片段长854 bp,编码284个氨基酸,具有典型的Fad6结构,包含2个组氨酸富集区(HDFGH、HFQHH)和2个跨膜结构域。对锦鲤和其他9种鱼类比较研究发现,与南亚野鲮和斑马鱼的同源性达到了91.9%和90.8%。即使进化地位相差甚远的鱼类,其组氨酸富集区和跨膜结构域等功能结构区也都具有高度的相似性。相关研究文献表明,2个跨膜区对于它们的细胞定位和形成适合的空间结构十分重要,而2个保守的组氨酸簇与铁离子结合形成脂肪酸去饱和酶的催化中心,任何一个组氨酸的突变或缺失均可能导致脂肪酸去饱和酶的失活[11]。这两个组氨酸富集区和跨膜结构域中每个氨基酸对其功能都极为重要,故表现出高度的保守性。
对锦鲤、人、家鼠和其他鱼类Fad6构建系统进化树发现,锦鲤与南亚野鲮的Fad6进化关系最近,其次是鲤鱼和斑马鱼,并与南亚野鲮、鲤鱼和斑马鱼形成进化单独小分支,再与海水鱼(军曹鱼、金枪鱼、金头鲷、长鳍篮子鱼)和溯河洄游型鱼(虹鳟、大西洋鲑)形成鱼类进化较大分支,最后与人、家鼠形成脊椎动物最大进化分支。系统进化树分析结果与根据传统分类学结果基本一致。因此,今后对鱼类的Fad6序列的分析可以作为物种系统进化分析的一个参考依据。
关于锦鲤和斑马鱼等热带鱼的Fad6氨基酸序列存在的差异,究竟仅仅是因为物种差异,还是同其生活环境相关,我们后续不仅要进一步在更多变温鱼类、冷水鱼类、热带鱼类之间进行对比研究,而且要在Fad6基因全序列基础上进行对比研究。此外,如果通过基因重组,将锦鲤的Fad6基因转入斑马鱼受精卵中,能否引起斑马鱼对低温耐受能力的提升,我们也正在做相关的实验探索。
3.2 Fad6在锦鲤各组织中的表达Fad6是脂肪酸生物合成途径的限速酶,其表达受到多种因素的调控[20, 21, 22, 23, 24]。Zheng等[25]和Bell等[26]研究认为,Fad6基因在肝脏中大量表达与肝脏参与脂肪酸的新陈代谢有关,而在肠道中高表达则与肠道中的食物所含脂肪酸的类型相关;此外在脑中表达量也相对较高。而Tocher等[27]发现Fad6基因在大西洋鳕鱼的脑中表达量最高,Seiliez等[12]发现该酶在虹鳟的脑、肝脏和肠中表达量较高,推测高不饱和脂肪酸在幼鱼神经组织发育过程中起着重要的作用。在幼鱼生长发育的关键阶段,鱼体内神经组织,特别在脑和视网膜中含有高浓度的DHA,n-3类高不饱和脂肪酸和DHA总含量均高于其他组织,故需要合成或摄取大量的高不饱和脂肪酸,以维持其正常的功能和代谢[28]。本研究中发现锦鲤Fad6基因在肝脏中表达量最高,其次是肠和脑,而在心脏、肌肉和鳃中表达量较低,这与上述研究者的发现基本一致。至于在脑中的表达量较低,这可能与鱼类自身合成高不饱和脂肪酸的能力有关[29],锦鲤可能具有较强合成高不饱和脂肪酸的能力,能够通过肝脏和肠合成高不饱和脂肪酸来满足脑的需求。
3.3 锦鲤各组织中Fad6的表达同水温的关系温度是Fad6表达的重要影响因素。Bell等[30]和Tocher等[22, 31]认为,水温的降低能提高硬骨鱼类Fad6基因的表达和酶的活性,而Tocher等[22]和Hagar等[32]认为,在一些淡水鱼体内,Fad6的活性会随着水温的升高而降低,在虹鳟肠上皮细胞和肝细胞中Fad6的活性在5℃或7℃时要高于15℃或20℃。同样,Ninno等[33]研究认为,在肝细胞微粒体中,Fad6在16℃时的活性是30℃时的两倍。在本研究中,锦鲤各组织中Fad6表达量随水温的降低而增高,结果与上述文献一致。
细胞膜的流动性受到温度、分子组成等多种因素的调节。从分子结构角度看,当外界温度降低时,细胞为保持质膜应有的流动性,往往通过以下3种形式来进行调节,脂肪酸碳链的缩短、碳链分支增加和提高不饱和度[34, 35, 36]。肽链的缩短和分支只能在脂肪酸生物合成过程中实现[37],而引入双键提高不饱和度既可以发生于生物合成过程中[34, 38],也可以通过去饱和酶对已有的脂肪酸进行催化实现[39, 40]。膜脂中不饱和脂肪酸含量增高,则膜脂相变温度会降低,膜的流动性增强,从而使细胞乃至整个机体的抗寒性相应提高[2]。
鱼类为了耐受低温从神经系统脑AchE活力的变化到同工酶的多型性[41, 42],从抗冻蛋白类的适时转录和翻译到代谢途径的转换[43, 44],以及从膜脂的组成到结构改变等都发生着深刻的变化。本研究揭示低温能够诱导Fad6基因的表达,进而增加膜脂中脂肪酸的不饱和度,为深入研究鱼类抗寒机理提供了依据。
4 结论在锦鲤物种中研究了Fad6保守片段序列。该片段长854 bp,编码284个氨基酸,与已报道的其他鱼类Fad6序列具有较高同源性。其中与南亚野鲮氨基酸具有91.9%的同源性,该序列具有典型的脂肪酸去饱和酶的结构特性。Fad6基因在锦鲤各组织中均有表达,其中在肝脏表达量最高,其次是肠和脑,而在心、肌肉和鳃的表达量相对较低。锦鲤各组织中Fad6表达量均随水温的降低而增高,即低温可以促进Fad6基因的表达。
| [1] | Stoner AW, Ottmar ML, Copeman LA. Temperature effects on the molting, growth, and lipid composition of newly-settled red king crab[J]. Journal of Experimental Marine Biology and Ecology, 2010, 393(1-2):138-147. |
| [2] | Xu YQ, Zhang YM, Ding ZK. Cloning and gene expression of delta 6 fatty acid desaturase cDNA of cobia(Rachycentron canadum)[J]. Journal of Fishery Sciences of China, 2010, 17(6):1183-1191. |
| [3] | Lin P, Qi LW, Wang YD, et al. A review of advances in fatty acid desaturase on cold-resistance in plants[J]. Molecular Plant Breeding, 2006, 4(3):404-410. |
| [4] | Wen SH, Li XF, Ju B, Wang CH. Sutdies on polyunsaturated fatty acid in microalgae[J]. Marine Science Bulletin, 2000, 19(4):86-91. |
| [5] | Tang H, Pan ZX, Lu LZ, Wang JW. The function and expression regulation of elongases of very long chain fatty acids[J]. Chemistry of Life, 2009, 29(6):898-902. |
| [6] | Tocher DR, Bell JG, McGhee F, et al. Effects of dietary lipid level and vegetable oil on fatty acid metabolism in Atlantic salmon(Salmo salar)over the entire production cycle[J]. Fish Physiology and Biochemistry, 2003, 29(3):193-209. |
| [7] | Zeng SS, Jiang LM, Yuan DJ. Research and development of fatty acid desaturase[J]. Chinese Bulletin of Life Sciences, 2008, 20(5):816-821. |
| [8] | Ren HT, Zhang GQ, Li JL, et al. Two Δ6-desaturase-like genes in common carp(Cyprinus carpio var. Jian):Structure characteriza-tion, mRNA expression, temperature and nutritional regulation[J]. Gene, 2013, 525:11-17. |
| [9] | Brenner RR, Garda H, de Gómez Dumm IN, Pezzano H. Early effects of essential fatty acid deficiency on structure and enzymatic activity of rat liver microsomes[J]. Progress in Lipid Research, 1981, 20:315-321. |
| [10] | Brenner RR. Nutritional and hormonal factors influencing desaturation of essential fatty acids in animals[J]. Progress in Lipid Research, 1981, 20:41-47. |
| [11] | Zheng X, Seiliez I, Hastings N, et al. Characterization and comparison of fatty acyl △6 desaturase cDNAs from freshwater and marine teleost fish species[J]. Comp Biochem Physiol Part B, 2004, 139:269-279. |
| [12] | Seiliez I, Panserat S, Kaushik S, et al. Cloning, tissue distribution and nutritional regulation of a △6-desaturase-like enzyme in rainbow trout[J]. Comp Biochem Physiol Part B, 2001, 130:83-93. |
| [13] | Seiliez I, Panserat S, Corraze G, et al. Cloning and nutritional regulation of a △6-desaturase-like enzyme in the marine teleost gilthead seabream(Sparus aurata)[J]. Comp Biochem Physiol Part B, 2003, 135:449-460. |
| [14] | Watson CA, Hill JE, Pouder DB. Species profile:Koi and goldfish[J]. Southern Regional Aquaculture Center, SRAC Publication, 2004, 7201:1-6. |
| [15] | Tamadachi M. The cult of the Koi[M]. Neptune City:TFH Publications Inc, 1990:288-289. |
| [16] | 苏建通. 锦鲤的养殖与鉴赏[M]. 北京:中国农业出版社, 2011. |
| [17] | Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9):2003-2007. |
| [18] | Steel R, Torrie J. Principles and procedures of statistics:A biometrical approach[M]. New York:McGraw-Hill, 1980. |
| [19] | Sprecher H, Luthria DL, Mohammed BS, et al. Reevaluation of the pathways for the biosynthesis of polyunsaturated fatty acids[J]. Journal of Lipid Research, 1995, 36(12):2471-2477. |
| [20] | Francis DS, Peters DJ, Turchini GM. Apparent in vivo delta-6 desaturase activity, efficiency, and affinity are affected by total dietary C18 PUFA in the freshwater fish Murray cod[J]. Journal of Agricultural and Food Chemistry, 2009, 57(10):4381-4390. |
| [21] | Izquierdo MS, Robaina L, Juárez-Carrillo E, et al. Regulation of growth, fatty acid composition and delta-6 desaturase expression by dietary lipids in gilthead seabream larvae(Sparus aurata)[J]. Fish Physiology and Biochemistry, 2008, 34(2):117-127. |
| [22] | Tocher DR, Fonseca-Madrigal J, Dick JR, et al. Effects of water temperature and diet containing palm oil on fatty acid desaturation and oxidation in hepatocytes and intestinal enterocytes of rainbow trout(Oncorhynchus mykiss)[J]. Comp Biochem Physiol Part B, 2004, 137:49-63. |
| [23] | Vagner M, Robin JH, Zambonino Infante JL, Person-Le Ruyet J. Combined effect of dietary HUFA level and temperature on sea bass(D. labrax)larvae development[J]. Aquaculture, 2007, 266:179-190. |
| [24] | Vagner M, Zambonino Infante JL, Robin JH, Person-Le Ruyet J. Is it possible to influence European sea bass(Dicentrarchus labrax)juvenile metabolism by a nutritional conditioning during larval stage?[J]. Aquaculture, 2007, 267:165-174. |
| [25] | Zheng X, King Z, Xu Y, et al. Physiological roles of fatty acyl desaturases and elongases in marine fish:characterisation of cDNAs of fatty acyl △6 desaturase and elovl5 elongase of cobia(Rachycentron canadum)[J]. Aquaculture, 2009, 290(1-2):122-131. |
| [26] | Bell MV, Dick JR, Porter AE. Pyloric ceca are significant sites of newly synthesized 22:6n-3 in rainbow trout(Oncorhynchus mykiss)[J]. Lipids, 2003, 38(1):39-44. |
| [27] | Tocher DR, Mourente G, Sargent JR. Metabolism of[1-14C]docosahexaenoate(22:6n-3), [1-14C]eicosapentaenoate(20:5n-3)and[1-14C]linolenate(18:3n-3)in brain cells from juvenile turbot Scophthalmus maximus[J]. Lipids, 1992, 27(7):494-499. |
| [28] | Naughton JM. Supply of polyenoic fatty acids to the mammalian brain:the ease of conversion of the short-chain essential fatty acids to their longer chain polyunsaturated metabolites in liver, brain, placenta and blood[J]. International Journal of Biochemistry, 1981, 13(1):21-32. |
| [29] | Ren HT, Yu JH, Xu P, et al. Cloning and expression of full length gene recoding for two △6 fatty acyl desaturases of common carp(Cyprinus carpio var. Jian)[J]. Chinese Journal of Biochemistry and Molecular Biology, 2012, 28(7):677-684. |
| [30] | Bell JG, Tocher DR, Farndale BM, et al. The effect of dietary lipid on polyunsaturated fatty acid metabolism in Atlantic salmon(Sal-mo salar)undergoing parr-smolt transformation[J]. Lipids, 1997, 32:515-525. |
| [31] | Tocher DR, Bell JG, Henderson RJ, et al. The effect of dietary linseed and rapeseed oils on polyunsaturated fatty acid metabolismin Atlantic salmon(Salmo salar)undergoing parr-smolt transformation[J]. Fish Physiology and Biochemistry, 2000, 23:59-73. |
| [32] | Hagar AF, Hazel JR. Changes in desaturase activity and the fatty acid composition of microsomal membranes from liver tissue of thermally-acclimating rainbow trout[J]. Comp Biochem Physiol Part B, 1985, 156:35-42. |
| [33] | Ninno RE, de Torrengo MAP, Castuma JC, Brenner RR. Specificity of 5- and 6-fatty acid desaturases in rat and fish[J]. Biochim Biophys Acta, 1974, 360:124-133. |
| [34] | de Mendoza D, Cronan JE. Thermal regulation of membrane fluidity in bacteria[J]. Trends in Biochemical Sciences, 1983, 8:49-52. |
| [35] | de Mendoza D, Grau R, Cronan JE, et al. Biosynthesis and function of membrane lipids[M]// Losick R, Sonenshein AL, Hoch JA. Bacillus subtilis and other ram-positive bacteria:physiology, biochemistry and molecular biology. Washington:American Society for Microbiology Press, 1993:411-425. |
| [36] | Russell NJ. Mechanisms of thermal adaptation in bacteria:bluep-rints for survival[J]. Trends in Biochemical Sciences, 1984, 3:108-112. |
| [37] | Suutari M, Laakso S. Microbial fatty acids and thermal adaptation[J]. Critical Reviews in Microbiology, 1994, 20(4):285-328. |
| [38] | de Mendoza D, Klages UA, Cronan JE, et al. Thermal regulation of membrane fluidity in Escherichia coli effects of overproduction of beta-ketoacyl-acyl carrier protein synthase I[J]. Journal of Biological Chemistry, 1983, 258(4):2098-2101. |
| [39] | Fujii DK, Fulco AJ. Biosynthesis of unsaturated fatty acids in bacilli:hyperinduction and modulation of desaturase synthesis[J]. Journal of Biological Chemistry, 1977, 252:3660-3670. |
| [40] | Fulco AJ. The biosynthesis of unsaturated fatty acids by bacilli, temperature induction of the desaturation reaction[J]. Journal of Biological Chemistry, 1969, 244:889-895. |
| [41] | Boldwim J, Hochachra PW. Functional significance of isoenzymes in thermal acclimatization-acetylcholimesterase from trout brain[J]. Journal of Biological Chemistry, 1970, 116:883-887. |
| [42] | Beneden R, Cashon RE, Powers DA. Inheritance of isocitrate dehy-drogenzse(Idh-A and Idlh-B), 6 phosphogluconate dehydrogen-ase(6 padh-A)and serum caterase polymorphisme[J]. Bioche-mical Genetics, 1981, 19:701-714. |
| [43] | Davies PL, Hew CL. Biochemistry of fish antifreeze proteins[J]. The FASEB Journal, 1990, 4:2460-2468. |
| [44] | Goldstein J, Pollite NS, Inouy M, et al. Major cold shock protein of Escherchia coli[J]. Proceedings of the National Academy of Sciences of the USA, 1990, 87:283-287. |