肌动蛋白(Actin)作为一类高度保守的蛋白质,在不同生物间肌动蛋白氨基酸序列的同源性高达70%-100%[1]。根据其等电点的不同分为α、β、γ三种形态。该蛋白在维持细胞结构、细胞运动和细胞分裂等生理活动中发挥着重要作用[2]。β-actin因具有分布广泛、mRNA表达量高而且不同物种内表达稳定的特点,因此也被称为管家基因(House-keeping gene),广泛应用于生物进化、基因表达规律等方面的研究[3]。
在基因表达差异的研究中,转录水平可以通过基因芯片、Northern印迹(Northern blotting)和反转录聚合酶链式反应(RT-PCR)等技术测定,蛋白水平可以通过Western印迹(Western blotting)等技术检测。但是,对基因在转录水平和蛋白水平表达差异的研究中,为了准确测定基因的表达量,都需要一个稳定表达的管家基因标准化未知总RNA和总蛋白的量[4]。在上百种管家基因中,最常用的管家基因有甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GADPH)、β-actin、28S RNA和19S RNA[5]。
棉铃虫(Helicoverpa amigera)是一种世界性的农作物害虫,目前棉铃虫已表现出对多种杀虫剂的抗性[6],造成农作物大面积的减产。随着棉铃虫抗药性的增强及其带来的环境污染问题[7],化学防治的局限性也随之显现,基于分子生物学的迅猛发展,人们对棉铃虫抗药性的研究更加深入。Western印迹作为分子生物学中常用的技术之一,是检测蛋白表达水平最快捷的方法之一,在用Western印迹比较不同条件下或者不同组织中目的蛋白表达量,上样量的微小差别可能对结果产生较大影响。由于内参基因的表达量在不同组织和细胞中相对恒定,因此常常用内参校正实验结果,使结果更为可信。同时内参也可以作为空白对照,检测蛋白转膜情况是否完全、整个Western印迹显色或者发光体系等是否正常[8]。
β-actin在维持细胞结构、细胞运动和细胞分裂等生理活动中发挥着重要作用,是检测基因转录水平和蛋白水平实验中最常用的内参之一。因此棉铃虫β-actin抗体在棉铃虫分子生物学的研究中发挥重要的作用。但市面上的β-actin抗体不仅价格昂贵,而且与棉铃虫蛋白的结合特异性较弱,因此本研究通过对棉铃虫β-actin基因的克隆与异源表达、纯化棉铃虫β-actin融合蛋白,获得特异性较强的棉铃虫β-actin多克隆抗体抗,旨在为制备价格低廉和特异性较强的β-actin多克隆抗体提供前提条件,为棉铃虫不同基因蛋白表达水平的研究提供素材,为深入探究棉铃虫β-actin及棉铃虫体内不同基因的表达规律提供前提条件。
1 材料与方法 1.1 材料 1.1.1 实验昆虫与质粒棉铃虫来源于中国农业大学,于室内用人工饲料长期饲养,饲养条件为:25℃,相对湿度为75%,光周期(L:D)为16 h:8 h。表达载体pET-28a质粒由本实验室保藏,为原核表达载体,卡那霉素(Kana)抗性;ICR小鼠购买于新疆医科大第一附属医院。
1.1.2 试剂与仪器pMD18-T(simple)、T4 DNA连接酶、限制性内切酶、Taq DNA聚合酶、DNA Mar-ker、Oligo d(T)15 Primers、Reverse Transcriptase M-MLV(RNase H-)、Recombinant Ribonuclease Inhibitor和dNTP(10 mmol/L)购于宝生物工程(大连)有限公司;RNA-Solv Reagent提取液为Omega Bio-tek公司产品,蛋白Marker购于Thermo Scientific、全式金公司;SanPrep柱式DNA胶回收试剂盒、PCR产物回收试剂盒、SanPrep柱式质粒DNA小量提取试剂盒购自生工生物工程(上海)股份有限公司;大肠杆菌 DH5α、BL21感受态细胞购自北京全式金生物技术有限公司;一抗鼠抗His-Tag单克隆抗体、辣根过氧化物酶标记的山羊抗鼠IgG购自中衫金桥公司;醋酸纤维素膜购自Millipore公司产品;实验引物合成来自上海生工生物有限公司;其余所用的化学试剂均为国产分析纯试剂。美国紫外/可见分光光度计(NanoDrop ND-1000 Spectrophotometer)。
1.2 方法 1.2.1 棉铃虫总RNA提取及cDNA的合成使用RNA-Solv Reagent提取液提取棉铃虫6龄幼虫的总RNA。经1%琼脂糖凝胶电泳检测RNA的完整性,紫外/可见分光光度计检测总RNA的浓度(ng/µL)和纯度(OD260/280)。当制备的RNA较纯且无蛋白质污染时,取1 μg总RNA作为逆转录反应的模板,Oligo d(T)15为引物逆转录合成cDNA。
1.2.2 棉铃虫β-actin基因的克隆根据前期筛选得到的β-actin全长序列(登录号:HM629442.1),设计合成了β-actin PCR扩增所需的两个引物β-actin-F和β-actin-R(表 1),预期片段约为1 121 bp。以棉铃虫cDNA为模板扩增β-actin基因全长序列。PCR扩增反应条件为:94℃变性4 min;94℃变性30 s,59℃退火30 s,72℃延伸40 s,反应35个循环;最后72℃延伸5 min。1%琼脂糖凝胶电泳检测PCR产物。PCR产物经PCR回收试剂盒回收后与pMD18-T(Simple)载体16℃过夜连接,连接产物转化DH5α感受态,筛选阳性重组子,正确的重组质粒命名为pMD18-T-β-actin,送至华大基因进行测序。
对获得的棉铃虫β-actin进行生物信息学分析,利用DNAMAN软件翻译氨基酸顺序,进行蛋白质分子量、等电点预测;应用ExPASy ScanProsite(http://prosite.expasy.org/scanprosite/)软件进行蛋白质签名序列预测;在NCBI网站上BLAST分析棉铃虫β-actin与不同物种氨基酸序列的相似性;利用MEGA 5软件对不同物种β-actin氨基酸序列进行多重比对,通过NJ(Neighbor-Joining)法构建氨基酸的系统进化树;利用DNAstar软件进行亲水性结构分析,抗原指数、表面概率结构分析免疫原性;同时利用在线预测网站(http://www.cbs.dtu.dk/services/BepiPred/)进行抗原决定簇位点分析。
1.2.4 原核表达质粒pET28a-β-actin的构建将pMD18-T-β-actin和pET-28a载体分别用EcoRⅠ和NotⅠ进行双酶切,目的片段与载体经切胶回收试剂盒回收后16℃过夜连接,连接产物转化DH5α感受态,筛选阳性重组子,提取质粒进行酶切鉴定,正确的重组质粒命名为pET28a-β-actin,送至华大基因进行测序。
1.2.5 融合蛋白pET28a-β-actin的表达及Western-blot鉴定将测序结果正确的阳性克隆转化到BL21感受态,将菌液PCR鉴定正确的阳性克隆活化到对数期后,加入终浓度为0.5 mmol/L的 IPTG,37℃振荡培养4 h后超声破碎至相对透亮,并将上清和沉淀分开处理,以未诱导的菌液作对照,12%的SDS聚丙烯酰胺凝胶电泳检测重组蛋白的表达及可溶性。
通过Western-blot检验目的蛋白在BL21菌株中的正确表达。将未经诱导剂IPTG诱导和诱导的融合蛋白pET28a-β-actin经12%的SDS聚丙烯酰胺凝胶电泳分离后,使用Mini-PROTEAN 3 Trans-Blot系统将融合蛋白转移至醋酸纤维素膜上。用5%脱脂奶粉4℃过夜封闭;TBST冲洗3次,加入1:5 000稀释的抗His标签的抗体(一抗),室温孵育2 h;TBST冲洗3次后加入1:5 000稀释的辣根过氧化物酶标记的羊抗鼠IgG抗体(二抗),室温孵育1 h;TBST冲洗3次后采用DAB法显色后观察。
1.2.6 抗原制备将诱导后的蛋白与5×电泳加样缓冲液混合,沸水浴煮沸10 min后12 000 r/min离心10 min,取上清进行SDS聚丙烯酰胺凝胶电泳。电泳后用0.25 mol/L氯化钾染色,在分子量约为42 kD处可见较宽条带,切取该条带进行研磨,用磷酸盐缓冲液溶解出蛋白后12 000 r/min离心10 min,取上清并-20℃冻存。
1.2.7 动物免疫将棉铃虫β-actin蛋白与完全弗氏佐剂充分乳化,采用皮下免疫方法,以每只50 μg剂量免疫4只ICR小鼠。2周后将棉铃虫β-actin蛋白与不完全弗氏佐剂充分乳化,以相同剂量免疫小鼠。2周和4周后再以β-actin蛋白与不完全弗氏佐剂乳化后相同的方法免疫小鼠。每次免疫后对小鼠进行眼眶采血法收集血清。
1.2.8 ELISA检测小鼠抗β-actin抗体效价及其特异性结合用浓度为10 μg/mL融合蛋白His-β-actin于4℃过夜包被ELISA板,次日用PBST缓冲液洗涤3次,5%的脱脂奶粉37℃封闭1.5 h。再用PBST缓冲液洗涤3次后加入不同稀释浓度的小鼠血清,37℃孵育2 h。洗涤后以1:2 000的稀释比例加入辣根过氧化物酶标记的山羊抗鼠IgG,37℃孵育1.5 h。PBST洗3次后加TMB底物显色,避光显色15 min后,加入2 mol/L的硫酸终止反应,用酶标仪检测A450/655。未免疫前的血清为对照,其A450/655值为N;免疫后的A450/655值为P,以P/N>2.1判断为阳性。
将6龄棉铃虫总蛋白进行12%的SDS-PAGE,使用Mini-PROTEAN 3 Trans-Blot系统将融合蛋白转移至醋酸纤维素膜上。用5%脱脂奶粉4℃过夜封闭后,经过小鼠抗棉铃虫β-actin血清和辣根过氧化物酶标记的山羊抗鼠IgG孵育后加DAB显色5 min,显色结果用扫描仪进行扫描。
2 结果 2.1 棉铃虫β-actin的克隆及cDNA序列特征用设计的特异性引物,以棉铃虫cDNA为模板PCR扩增后获得1 131 bp左右的片段,经PCR产物回收试剂盒回收后与pMD18-T(simple)载体连接转化大肠杆菌DH5α感受态,菌液PCR筛选阳性重组子(图 1),经华大基因测序后用DNAMAN软件与棉铃虫β-actin序列比对,结果一致,说明获得正确的目的基因。该基因全长1 121 bp,有完整的开放阅读框及起始密码子ATG,共编码376个氨基酸(图 2-A)。理论分子量为41.767 kD,等电点为5.16。从氨基酸组成上分析,棉铃虫β-actin富含Ala(7.9%)、Glu(7.39%)、Gly(7.39%)和Leu(7.39%)。BLA-ST分析为肌动蛋白超家族,氨基酸序列与其他物种肌动蛋白比较一致性达98%-99%。
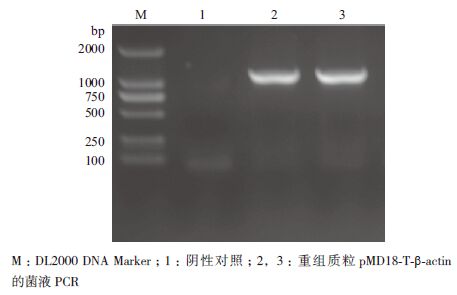
|
| 图 1 重组质粒pMD18-T-β-actin 的菌液PCR |

|
| 图 2 棉铃虫β-actin 基因的cDNA 核苷酸序列、推导的氨基酸序列(A)及肌动蛋白超家族系统进化树(B) |
在NCBI上用BLAST分析发现棉铃虫β-actin与家蚕(Bombyx mori)、斑马鱼(Danio rerio)、黑腹果蝇(Drosophila melanogaster)、人类(Homo sapiens)、小家鼠 (Mus musculus)、意蜂(Apis mellifera)的氨基酸序列一致性达到98%以上。利用MEGA5软件对不同物种的β-actin氨基酸序列构建系统进化树,通过NJ法重复1 000次,其他参数设置均采用默认设置。分析结果(图 2-B)表明,不同物种间β-actin保守性较好,其中棉铃虫与家蚕β-actin的氨基酸保守性最为接近,达到99%。鳞翅目的昆虫与双翅目、膜翅目的昆虫分为两个小分支,表明三者起源于共同的祖先。同时昆虫β-actin又与哺乳动物人类和小家鼠分为两个大分支。
2.3 棉铃虫β-actin亲水性分析利用DNAstar软件的Protean程序的Plot-kyte-doolittle法预测棉铃虫β-actin的亲水性。结果(图 3)显示,膜蛋白的大部分区域处于正高分区域(坐标正值越大,代表其亲水性越强),说该蛋白有较好的亲水性,为亲水性蛋白。

|
| 图 3 棉铃虫β-actin 的亲疏水性预测 |
利用DNAstar软件Protean程序的Jomeson-Wolf法和Emini法预测分析棉铃虫β-actin与小家鼠β-actin的免疫原性,结果(图 4)显示大部分的抗原峰值大于临界值0,处于正分处(纵坐标值越大,免疫原性越强),理论上有较好的免疫原性。表面概率预测结果显示,棉铃虫β-actin与小家鼠β-actin蛋白质上的氨基酸序列同时在116-122、336-340和361-368区域的表面概率最高,为最优抗原决定簇位点。
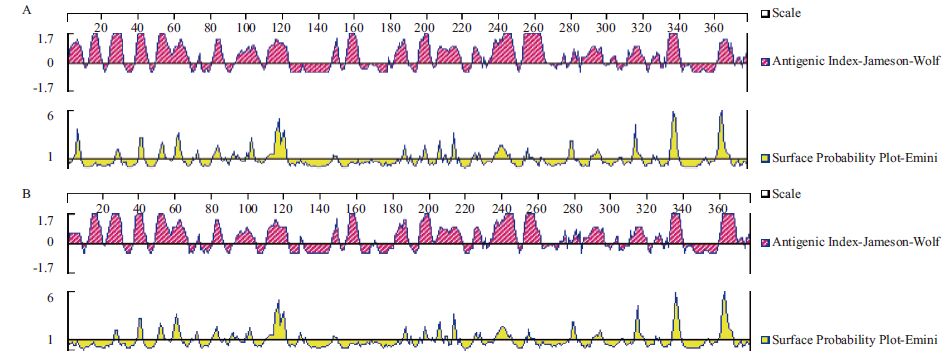
|
| 图 4 棉铃虫(A)及小家鼠(B)β-actin 抗原指数及表面概率 |
利用在线预测网站(http://www.cbs.dtu.dk/services/BepiPred/)分析棉铃虫和小家鼠β-actin抗原决定簇位点,发现棉铃虫β-actin和小家鼠β-actin分别有126个和118个抗原表位,并且有89个抗原表位在棉铃虫和小家鼠β-actin中都存在,分别占棉铃虫和小家鼠抗原表位总数的70.63%和75.42%。说明两者在蛋白序列和抗原决定簇位点两方面都具有较高的一致性。
2.5 原核表达质粒pET28a-β-actin的构建将经EcoRⅠ和NotⅠ双酶切后的pMD18-T-β-actin的目的基因与原核表达载体pET28a连接转化DH5α感受态,提取重组质粒再用EcoRⅠ和NotⅠ双酶切鉴定,获得约1 100 bp的目的条带(图 5-A)。双酶切鉴定正确的重组质粒经华大基因测序后用DNAMAN软件对氨基酸序列进行分析表明,测序结果与棉铃虫β-actin氨基酸序列一致,说明原核表达载体构建成功。
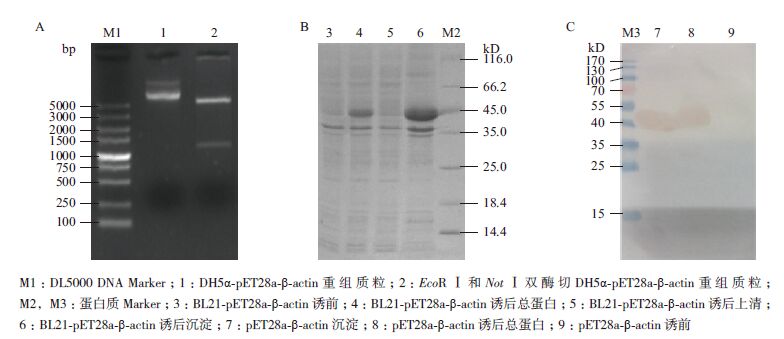
|
| 图 5 重组质粒DH5α-pET28a-β-actin 双酶切鉴定(A)、融合蛋白pET28a-β-actin 的诱导表达(B) 及Western-blot 鉴定(C) |
通过12%的SDS-PAGE检测融合蛋白pET28a-β-actin的表达(图 5-B)显示,重组pET28a-β-actin质粒转化到表达菌BL21经IPTG诱导表达后与诱导表达前相比,诱导表达后有一条明显的蛋白质增强条带,表达载体分子量为45 kD左右,与预期的β-actin蛋白相对分子量相似,初步说明目的蛋白诱导表达成功。超声破碎后的菌体将上清和沉淀分别处理后经12%的SDS-PAGE检测显示,表达的融合蛋白主要存在于沉淀中,说明该蛋白以包涵体形式存在。
对诱导表达的融合蛋白进行Western-blot验证,检测结果(图 5-C)显示,经IPTG诱导表达、超声后沉淀与诱导表达前相比,诱导表达、超声沉淀均有一条45 kD明显的条带,说明目的蛋白表达正确。
2.7 抗原制备通过12%的SDS-PAGE检测融合蛋白pET28a-β-actin切胶回收,结果(图 6-A)显示回收的pET28a-β-actin蛋白稀释5倍后在分子量45 kD左右有一条明显且单一的蛋白质条带。利用Bradford法蛋白浓度定量经标准曲线计算后,蛋白含量为0.6 mg/mL,说明该蛋白可用于免疫小鼠。
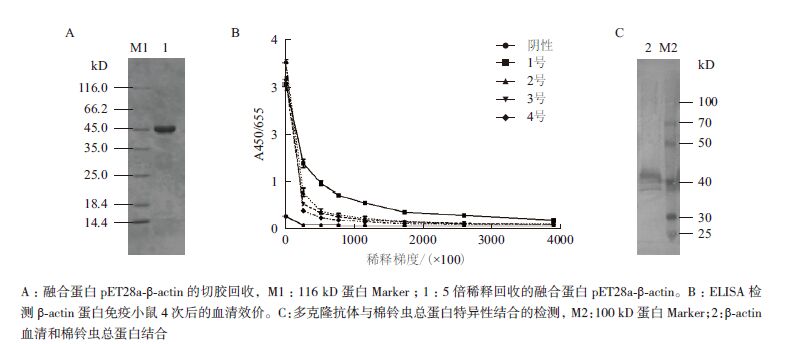
|
| 图 6 融合蛋白pET28a-β-actin 的切胶回收(A)、多克隆抗血清效价(B)及特异性检测(C) |
在β-actin蛋白单独免疫4次后,用ELISA测定小鼠的血清效价。4只小鼠抗血清ELISA检测的A450/655值与阴性对照相比均>2.1,1号- 4号小鼠分别为7.1、3.2、2.7和2.1,由图 6-B可知,4次蛋白免疫后4只小鼠的血清效价均达到1:76 800,其中1号小鼠血清效价达到1:388 800,说明4只小鼠的抗体滴度均达到预期目标。继而用Western-blot检测抗体的特异性,结果(图 6-C)显示,6龄棉铃虫总蛋白经过小鼠抗棉铃虫β-actin血清和辣根过氧化物酶标记的山羊抗鼠IgG孵育显色后,在理论大小(41.77 kD)处有较明显的条带,说明蛋白免疫制备小鼠抗棉铃虫β-actin血清能与天然棉铃虫β-actin特异结合。
3 讨论实时荧光定量PCR和Western印迹已经成为研究基因在转录水平和蛋白水平的重要方法。为了能够准确地测定基因在不同水平的表达量需要选取稳定表达的管家基因作为内参对照,借以矫正RNA产量、质量、反转录效率、蛋白上样量等带来的实验误差[4, 9]。
鉴于肌动蛋白的特点及其在分子生物学研究中的作用,同时也为今后进一步研究肌动蛋白基因的结构、功能和表达分析提供基础资料,克隆得到了棉铃虫β-actin基因,并将其构建到pET28a载体上,诱导表达得到了棉铃虫β-actin蛋白,为制备棉铃虫β-actin抗体提供了前提条件。棉铃虫β-actin基因生物学分析结果显示,基因序列长1 131 bp,编码376个氨基酸,理论分子量为41.77 kD,理论等电点5.16。棉铃虫β-actin与小家鼠β-actin蛋白质在理论上有较好的免疫原性,在线预测分析两者抗原决定簇位点,发现棉铃虫β-actin和小家鼠β-actin的抗原表中,有89个抗原表位在棉铃虫β-actin和小家鼠β-actin中都存在,分别占棉铃虫和小家鼠抗原表位总数的70.63%和75.42%。
用切胶回收的蛋白对4只ICR小鼠进行蛋白免疫,获得了棉铃虫β-actin的鼠抗血清,用前期纯化的His-β-actin融合蛋白作为抗原,经ELISA实验验证免疫4次后抗体效价均达到76 800以上,其中1号小鼠血清效价达到388 800。Western blot检测结果显示该血清能与天然棉铃虫总蛋白结合,表明此血清有较好的特异性。
本课题组前期运用电脉冲基因导入法已获得特异性较好的棉铃虫相关蛋白抗血清[10, 11],但是将棉铃虫β-actin重组质粒pCDNA3-β-actin注射到昆明白和Balb/c小鼠中制备β-actin多克隆抗体,都未获得特异性较好的多克隆抗体。而通过体外异源表达纯化的β-actin融合蛋白佐以弗氏佐剂来免疫小鼠,获得了效价高、特异性强的棉铃虫β-actin多克隆抗体。可能由于棉铃虫与小鼠β-actin氨基酸序列和抗原决定簇位点间具较高的一致性,致使重组质粒pCDNA3-β-actin免疫激起的免疫反应较低甚至不能激起免疫反应。而异源表达纯化的β-actin融合蛋白在佐剂的协助下可在小鼠体内激起较强的免疫反应,最高的可达38万多。覃林花等[12]在制备抗血清中发现抗体滴度水平上基因免疫制备明显低于蛋白免疫。由于基因免疫激起的抗血清滴度低[13, 14],有时甚至需要通过蛋白免疫加强抗体滴度水平[15]。因此,蛋白免疫与基因免疫制备抗血清相比,虽然过程相对复杂,成本相对较高,但是具有免疫应答快速[16]、血清滴度高的优点。
β-actin作为应用最广泛的内参基因,在分子生物学的实验中仍存在障碍。市面上几乎没有售卖棉铃虫β-actin抗体,本课题组选择同源性较高的小鼠β-actin单克隆抗体检测棉铃虫总蛋白,但未能与棉铃虫蛋白特异性的结合。而肌动蛋白作为研究基因蛋白水平上表达规律的重要内参之一,获得β-actin多克隆抗体是检测棉铃虫不同蛋白表达规律的前提条件。
4 结论本研究克隆得到棉铃虫 β-actin 基因,并在大肠杆菌中进行表达获得其融合蛋白。利用表达的融合蛋白免疫小鼠获得针对棉铃虫β-actin特异性较高的多克隆抗体。
| [1] | 王洪振, 程焉平. 细胞核内肌动蛋白参与基因转录的研究进展[J]. 吉林师范大学学报:自然科学版, 2005, 26(2):34-36. |
| [2] | Pederson T. Half a century of “the nuclear matrix”[J]. Molecular Biology of the Cell, 2000, 11(3):799-805. |
| [3] | Suzuki T, Higgins PJ, Crawford DR. Control selection for RNA quantitation[J]. Biotechniques, 2000, 29(2):332-337. |
| [4] | 关波, 张富春. 植物基因表达转录分析中内参基因的选择与应用[J]. 生物技术通报, 2011(7):7-11. |
| [5] | 张艳君, 朱志峰, 陆融, 等. 基因表达转录分析中内参基因的选择[J]. 生物化学与生物物理进展, 2007, 34(5):546-550. |
| [6] | Zhang H, Tang T, Cheng YR, et al. Cloning and expression of cytochrome P450 CYP6B7 in fenvalerate-resistant and susceptible Helicoverpa armigera(Hübner)from China[J]. Journal of Applied Entomology, 2010, 134(9-10):754-761. |
| [7] | 赵建周, 范云六. 转双基因抗虫烟草延缓棉铃虫抗性的作用评价[J]. 科学通报, 1999, 44(15):1635-1639. |
| [8] | 李晓明. 水稻内参蛋白质的选择及鉴定[D]. 保定:河北农业大学, 2010. |
| [9] | 唐婷, 柳峰松, 任国栋. 谢氏宽漠王 β-actin 基因 cDNA 克隆, 序列分析及表达量检测[J]. 昆虫学报, 2009, 51(11):1210-1215. |
| [10] | 朱燕, 张富春, 马纪, 等. 核酸免疫制备鼠抗棉铃虫FK506结合蛋白的多克隆抗体[J]. 生物技术通报, 2014(12):141-146. |
| [11] | 赵洁, 赵文博, 朱燕, 等. 活体电穿孔法辅助核酸免疫制备小鼠抗棉铃虫精氨酸激酶的抗体[J]. 细胞与分子免疫学杂志, 2014, 30(10):1054-1057. |
| [12] | 覃林花, 黄长晖. 基因免疫和蛋白免疫制备抗 P16 抗血清[J]. 生物化学与生物物理学报:英文版, 1998, 30(4):347-351. |
| [13] | Leinonen J. Characterization of monoclonal antibodies against prostate specific antigen produced by genetic immunization[J]. Journal of Immunological Methods, 2004, 289(1-2):157-167. |
| [14] | Gurunathan S, Klinman DM, Seder RA. DNA vaccines:immunology, application, and optimization[J]. Annual Review of Immunology, 2000, 18(1):927-974. |
| [15] | 彭海林, 宋凯, 叶赛, 等. 利用基因免疫进行日本血吸虫Sj22蛋白抗体制备的研究[J]. 中国生物工程杂志, 2007, 27(1):6-10. |
| [16] | 季玉红. DNA免疫制备单克隆抗体的研究进展[J]. 医学分子生物学杂志, 2000, 22(5):304-307. |





