2. 大连海洋大学水产与生命学院,大连 116023
2. College of Life Science, Dalian Ocean University,Dalian 116023
樟芝(Taiwanofungus camphoratus)又称牛樟菇、牛樟芝、樟内菇和红樟菰等,属于多孔菌科、台芝属,为台湾特有珍贵药用真菌[1],具有保肝、抗肿瘤、抗氧化、调节免疫、解毒等功效[2, 3]。近年来,研究表明樟芝子实体和菌丝体对不同种类的癌细胞均具有显著的抗癌活性[4, 5, 6, 7],樟芝的液体发酵培养、子实体或菌丝体中的多糖和三萜化合物等有效成分受到研究者的广泛关注,而樟芝挥发油组分的提取和分析研究相对较少。目前,挥发油组分的定性定量分析主要采用指纹图谱色谱法、气相色谱-质谱联用仪(GC-MS)和高效液相色谱(HPLC)法[8, 9, 10]。研究表明,樟芝菌丝体中含有的挥发油成分十分复杂,主要为醇类、醛类、酯类、酮类和酸类,且不同菌株或同一菌株采用不同的碳源、氮源进行发酵,获得的挥发油成分及各组分的相对含量也显著不同。白岩岩等[11]发现以葡萄糖为碳源樟芝发酵液中醛类百分含量最高,约为21.90%,以蛋白胨为氮源樟芝发酵液中醛类相对含量达到41.60%。Liu等[12]以葡萄糖为碳源、黄豆粉为氮源,获得的樟芝发酵液中主要有酯类、醇类、酮类和酸类,而其中乙酸乙酯、丁位十一内酯和3-羟基-2-丁酮含量最多。陈菲等[13]的研究表明,台湾樟芝发酵菌粉中的挥发油组分以醛类为主,而广东的樟芝发酵菌粉中以酮类为主。Lu等[14]采用顶空固相微萃取技术提取樟芝发酵液和菌丝体中的挥发油,获得了55种挥发油成分,其中醇类和酮类含量较高。以往大量研究表明,挥发油对细菌和真菌均具有不同程度的抑制作用[15, 16, 17, 18]。目前,仅有马刚等[19]报道了从樟芝发酵液中提取的挥发油对棉花枯萎病菌和沙门氏菌具有显著的抑制活性。
常用的挥发油提取方法有水蒸气蒸馏法、CO2超临界萃取法和有机溶剂提取法[20, 21, 22, 23]。水蒸气蒸馏法提取率较低且费时;CO2超临界萃取法设备投资大、成本高;有机溶剂提取法直接使用石油醚、乙醚等低沸点溶剂进行回流提取,得到的挥发油组分含杂质较多。微波辅助提取具有操作时间短、溶剂消耗量少、适于热不稳定成分等优点,被广泛地应用于挥发油的提取[24, 25, 26]。液-液萃取是广泛应用于提取香气物质的方法之一,大量实验结果表明,其具有较高的分配系数,且能够萃取的香气物质种类范围宽、数量多[27, 28]。本实验将微波辅助提取与液-液萃取结合,提出微波辅助石油醚/乙醇双液相萃取技术,并将其应用于樟芝液体发酵液中挥发油的提取,考察微波辅助双液相萃取樟芝挥发油的影响因素,确定挥发油的最佳提取工艺,并进一步研究挥发油对几种常见皮肤癣菌的抑制作用。
1 材料与方法 1.1 材料 1.1.1 菌种樟芝(Taiwanofungus camphoratus)购于BCRC生物资源保存及研发中心(Bioresource Collection and Research Center),编号为37848。红色毛癣菌、须癣毛癣菌、絮状表皮毛癣菌、紫色毛癣菌、断发毛癣菌、石膏样小孢子菌和许兰氏毛癣菌由温州医科大学提供。
1.1.2 培养基及发酵培养樟芝菌种活化培养基:马铃薯葡萄糖琼脂培养基。
种子培养基(W/V):葡萄糖2%,蛋白胨0.2%,KH2PO4 0.1%,MgSO4·7H2O 0.05%,pH自然,250 mL锥形瓶装液量为100 mL。
发酵培养基(W/V):麸皮 1%,麦芽糖2%,葡萄糖3%,酵母膏0.4%,蛋白胨0.5%,KH2PO4 0.1%,MgSO4·7H2O 0.05%组成,250 mL锥形瓶装液量为100 mL。
摇瓶发酵培养:取适量菌丝接种于菌种活化培养基平板28℃培养7-10 d,当菌丝覆盖整个平板后,用打孔器取3个菌块接种于种子培养基,28℃,150 r/min,培养4 d后,以10%(V/V)接种于发酵培养基,28℃,150 r/min,培养8 d。
1.2 方法 1.2.1 微波辅助双液相萃取发酵结束后,将发酵液于5 000 r/min离心5 min,分离上清和菌丝体沉淀。将1 g干重菌丝体获得的发酵液上清,转移入分液漏斗,加入适量石油醚(60-90℃),混匀,静置30 min,反复萃取3次,分离石油醚相,备用。将菌丝体(相当1 g干重)放入150 mL圆底烧瓶中,加入萃取上清后的石油醚、适量的乙醇和水组成双液相体系,进行微波辅助提取。提取结束后,室温静置30 min,收集石油醚相,加入适量无水硫酸钠,冷冻(-18℃)过夜,过滤,旋转蒸发去除石油醚获得樟芝挥发油。

将发酵液于5 000 r/min离心5 min,分离上清和菌丝体沉淀。用滤纸将菌丝体(相当于1 g干重)包成小包放入索氏提取器中,加入石油醚(60-90℃)50 mL,置于恒温水浴锅中,90℃提取6 h。取出提取液,与分离的上清混合,分层后静置30 min,反复萃取3次,取上相,加入适量无水硫酸钠,冷冻(-18℃)过夜,过滤,旋转蒸发挥去滤液中的石油醚,收集挥发油并称重。
水蒸气蒸馏法:发酵液转移入250 mL圆底烧瓶中,连接精油测定器和回流冷凝管。向精油测定器中加水直至充满刻度部分,并溢流入烧瓶中为止。置电炉上缓缓加热至沸,并保持微沸约4 h,停止加热,放置1 h以上,读取挥发油量。
1.2.2.2 微波辅助提取法将发酵液于5 000 r/min离心5 min,分离上清和菌丝体沉淀。菌丝体(相当于1 g干重)置于圆底烧瓶中,加入50 mL的石油醚(60-90℃)作为萃取剂,用微波炉中火处理90 s,滤出萃取液,与上清混合,分层后室温静置30 min,反复萃取3次,萃取液加入适量无水硫酸钠冷冻(-18℃)过夜,过滤,旋转蒸发去石油醚,收集挥发油并称重。
1.2.3 挥发油中石油醚和乙醇残留量的检测采用Agilent 6890N气相色谱(Agilent科技有限公司,美国)检测挥发油组分中乙醇和石油醚的残留量。色谱柱为DB-WAX毛细管柱(30 m×250 μm×0.25 μm);升温程序:30℃保持25 min,以20℃/min升温至220℃,保持20 min;进样口温度为200℃;检测器温度为300℃;进样量为1 μL;载气为氦气(>99.999%);流速1.0 mL/min;分流比为3:1。将待测挥发油以适量二甲基亚砜稀释并定容。精密称取乙醇和石油醚(60-90℃)适量,用二甲基亚砜稀释配制成每1 mL中含乙醇250 μg、石油醚15 μg的对照溶液。
1.2.3.1 乙醇体积浓度对挥发油提取率的影响挥发油组分在石油醚和乙醇中均具有较好的溶解性。实验中首先用石油醚萃取樟芝发酵液上清中的挥发油,然后利用石油醚/乙醇双液相体系作为萃取剂,微波辅助提取樟芝菌丝体中的挥发油。取1 g干重菌丝体获得的发酵液上清,加入15 mL石油醚萃取。将菌丝体(相当于1 g干重)加入适量乙醇、水以及萃取上清后的石油醚,配制成含有不同乙醇体积浓度的双液相体系,体系总体积为50 mL,石油醚体积浓度为30%。在380 W下,微波提取60 s,考察乙醇浓度对挥发油提取率的影响。
1.2.3.2 石油醚体积浓度对挥发油提取率的影响取1 g干重菌丝体获得的发酵液上清,分别加入10、15、20和25 mL石油醚萃取。将菌丝体(相当于1 g干重)与萃取发酵液后的石油醚混合,配制成总体积为50 mL的双液相体系,体系中石油醚体积浓度分别为20%、30%、40%和50%,乙醇和水的用量比例同乙醇体积浓度为56%的双液相体系。在380 W下,微波作用60 s,考察石油醚体积浓度对挥发油提取率的影响。
1.2.3.3 固液比对挥发油提取率的影响取1 g干重菌丝体获得的发酵液上清,加入石油醚萃取。将菌丝体(相当于1 g干重)加入到不同体积的双液相体系中,体系中石油醚和乙醇的体积浓度分别为30%和56%。在380 W下,微波作用60 s提取挥发油,考察固液比对挥发油提取率的影响。
1.2.3.4 微波功率对挥发油提取率的影响取菌丝体(相当于1 g干重),按固液比1:50配制双液相体系,体系中乙醇体积浓度为56%,石油醚体积浓度为30%石油醚(萃取3次发酵液后的),在不同的微波功率下作用60 s提取挥发油,考察微波功率对挥发油提取率的影响。
1.2.3.5 微波时间对挥发油提取率的影响将以上确定的双液相体系与菌丝体(相当于1 g干重)混合,在380 W微波功率下分别作用不同时间,考察微波时间对挥发油提取率的影响。
1.2.4 抑制真菌试验菌种的活化:将保藏于4℃冰箱的7种皮肤癣菌,接种到沙氏琼脂培养基斜面,28℃培养14 d。沙氏琼脂培养基(Sabouraud agar medium,简称SDA):葡萄糖40 g,蛋白胨10 g,琼脂20 g,用蒸馏水定容至1 000 mL,充分搅拌后,调pH7.0,高压蒸汽灭菌(115℃,15 min)。
采用沙氏培养基试管内药基法测定挥发油对真菌的抑制效果。培养基经 115℃灭菌 15 min,冷却至50℃,趁培养基未凝固,用培养基将挥发油稀释成不同的浓度,充分搅拌均匀后,分装试管摆成斜面。菌种活化后,用0.85%的无菌生理盐水将孢子洗下,血球计数板调整孢子浓度,制备成孢子浓度为105个/mL的菌悬液。然后将各种皮肤癣菌的菌悬液(105/mL)接种于每个试管,接种量为50 μL,并接种药基不含挥发油的试管沙氏培养基作为空白对照,将接种后的试管放入28℃恒温箱中连续培养14 d,观察各种真菌的生长情况,并刮取菌丝体称重,测定生物量。若14 d内无菌落生长或菌落明显生长但明显小于对照菌落者为有抑菌作用。“-”表示菌落未生长,“+”表示菌落有生长,以“+”的个数表示菌体的长势,个数越多,长势越好。“+++”表示空白对照的菌体生物量为100%;“++”表示菌体生物量为空白对照的60%-80%;“+”表示菌体生物量为空白对照的20%-50%。
克霉唑抑菌实验:将市售克霉唑溶液(广州白云山何济公制药厂)通过微孔滤膜过滤除菌,用灭过菌的沙氏培养基将克霉唑稀释成不同浓度,分装试管摆成斜面,以试管培养基中不含有克霉唑的沙氏培养基作为空白对照。将7种皮肤癣菌接种于含不同浓度克霉唑的试管斜面中,菌种活化、接种方法、生物量测定以及菌体生长情况表示方法同挥发油对真菌抑制效果检测。
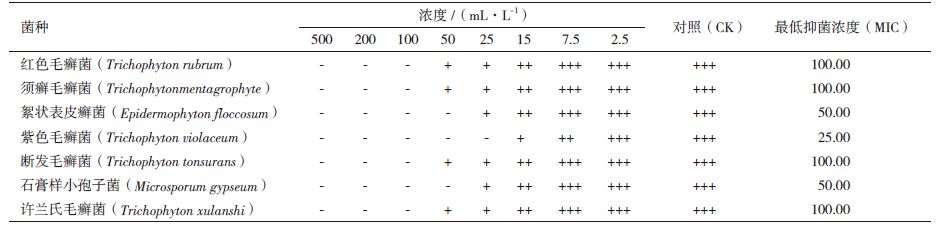
2 结果 2.1 微波辅助石油醚/乙醇双液相萃取 2.1.1 乙醇体积浓度对挥发油提取率的影响结果(图 1)表明,挥发油提取率随着乙醇浓度的增加,先增加后减少。当体系中乙醇体积浓度为35%-42%时,挥发油提取率较低。当乙醇体积浓度为56%时,挥发油提取率最大为0.63%。乙醇体积浓度为63%时,挥发油提取仅为0.53%。实验结果表明,石油醚能够实现樟芝发酵液上清中的挥发油和乙醇溶液中菌丝体挥发油的有效萃取,而白岩岩等[11]利用石油醚萃取樟芝发酵液上清中的挥发油,获得的挥发油组分仅有4种。这主要是由于发酵菌株、培养基中营养物质的差异造成挥发油组分及其相对含量的不同,从而导致挥发油整体极性的变化,而呈现不同的萃取效果。石油醚/乙醇双液相体系能够有效提取樟芝发酵液中的挥发油,最适的乙醇体积浓度为56%。
|
| 图 1 乙醇体积浓度对挥发油提取率的影响 |
结果(图 2)表明,当石油醚体积浓度由20%增加至30%时,挥发油提取率显著增加,继续增加石油醚浓度,挥发油提取率变化不大。这表明体积浓度为30%的石油醚能够同时实现发酵液上清和菌丝体中挥发油的萃取,因此,确定最佳的石油醚体积浓度为30%。

|
| 图 2 石油醚浓度对挥发油提取率的影响 |
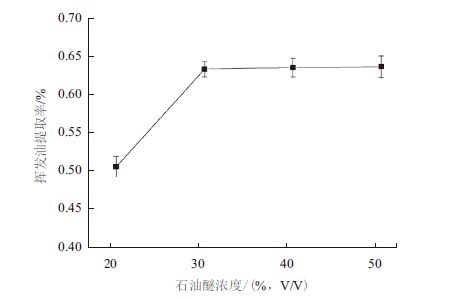
结果(图 3)显示,当固液比由1:40增加至1:50时,挥发油提取率显著增加,继续增加固液比至1:60,提取率几乎不变,当固液比为1:70时,挥发油提取率较1:60时降低了14.44%。因此,确定最佳的固液比为1:50。
|
| 图 3 固液比对挥发油提取率的影响 |
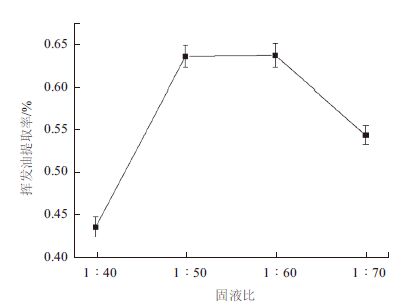
结果(图 4)表明,随着微波功率的增加,挥发油提取率先增加后减少,当微波功率为380 W时,提取率最高。因此,最适的微波提取功率为380 W。
|
| 图 4 微波功率对挥发油提取率的影响 |
结果(图 5)显示,微波作用时间从30 s增加至90 s时,挥发油提取率显著增加,而当提取时间由90 s增加至150 s时,提取率变化不大。因此,确定90 s为最佳提取时间,此时挥发油提取率为0.69%。
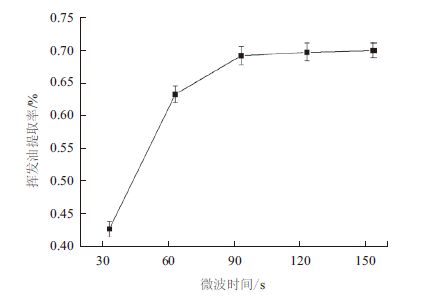
|
| 图 5 微波时间对挥发油提取率的影响 |
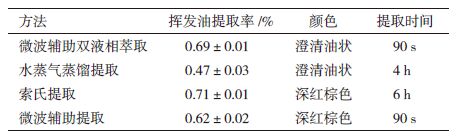
考察不同提取方法获得的樟芝挥发油提取率,结果(表 1)表明,索氏提取>微波辅助双液相萃取>微波辅助提取>水蒸气蒸馏提取。微波辅助双液相萃取获得的挥发油提取率与索氏提取相差不大,可见该法能够实现樟芝发酵液中挥发油的有效提取。微波辅助双液相萃取和传统水蒸气蒸馏获得的挥发油颜色澄清。索氏提取和微波辅助提取使用石油醚作为提取剂导致挥发油中混有脂溶性杂质,而呈深红棕色。
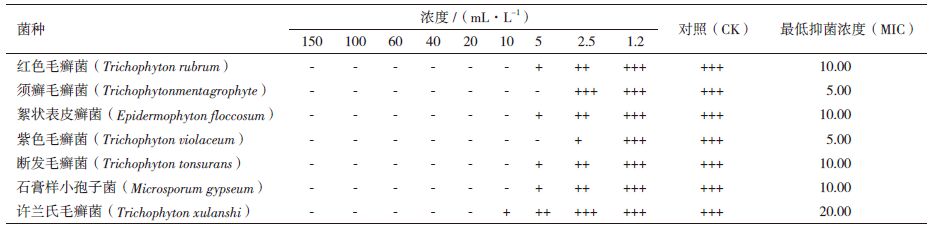
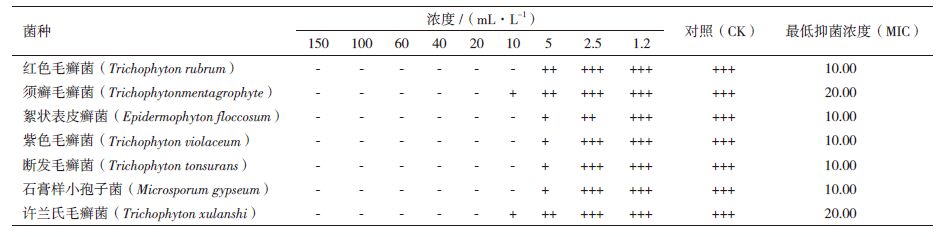
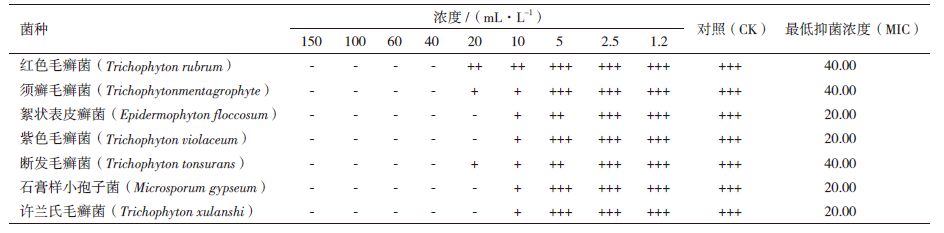
检测获得的挥发油组分中乙醇和石油醚的残留量(石油醚检出限0.5 μg/mL、乙醇检出限为0.8 μg/mL),结果表明微波辅助双液相萃取得到的挥发油无乙醇残留,石油醚残留量为7.13 μg/mL;索氏提取法和微波辅助提取法获得挥发油的石油醚残留量分别为7.06 μg/mL和7.17 μg/mL。不同方法得到的挥发油石油醚残留量相差不大,且该浓度下的石油醚对微生物菌体的生长没有影响。樟芝挥发油对几种常见皮肤癣菌的抑制活性,结果(表 2-表 5)表明,樟芝挥发油对考察的几种真菌均具有一定的抑制作用,但不同提取方法获得的挥发油,其抑菌效果不同。索氏提取得到的挥发油抑制各种真菌的最低抑制浓度(MIC)为10-60 mL/L,微波辅助提取为20-40 mL/L,水蒸气蒸馏为10-20 mL/L,微波辅助双液相萃取为5-20 mL/L。克霉唑对考察真菌的MIC为25-100 mL/L(表 6)。微波辅助双液相萃取和水蒸气蒸馏法获得的挥发油对真菌的抑制效果均优于克霉唑。
微波辅助石油醚/乙醇双液相体系,能够有效地提取樟芝发酵液中的挥发油组分,获得较高的挥发油提取率。在微波的交变电磁场作用下,菌体细胞内的水分子引起强烈的电磁振荡,导致细胞分子间氢键松弛,细胞膜结构破裂,加速了溶剂分子对基体的渗透和挥发油组分的溶剂化[29]。由于存在分相行为,提取过程中挥发油组分不断地被萃取到石油醚相。边提取边分离,降低了菌丝体周围挥发油的浓度,加快了传质速率,有利于提取的进行。同时,石油醚对乙醇相中挥发油组分的萃取,去除了挥发油外的部分杂质,实现了挥发油的初步纯化。
双液相体系中,当乙醇体积浓度为56%时,挥发油的提取率最高。体系中乙醇浓度过高会导致乙醇相和石油醚相的极性差距缩小,不利于挥发油组分向石油醚相转移,部分挥发油组分仍然保留在乙醇相中。因此,当体系中乙醇体积浓度为63%时,挥发油提取率较56%时降低了15.53%。挥发油组分多为非极性物质,当乙醇浓度较低时,提取剂的极性相对较大,不利于挥发油的溶解,所以乙醇体积浓度为35%-42%时,获得的挥发油提取率较低。固液比影响固相主体和液相主体的浓度差,即传质动力,从而直接影响提取效果[30]。固液比由1:40增加到1:50,挥发油提取率提高了1.46倍,这是由于提取剂的增加促进了固液物料之间的传质,有利于挥发油的提取。然而,过多的提取剂会吸收大量的热量,造成热量损失,影响菌丝体对热的吸收,降低提取效率[31],因此,当固液比为1:70时,挥发油提取率仅为0.54%,较1:60时降低了14.44%。微波功率越大,分子运动越剧烈,细胞破壁效果越好,提取效率相对越高[32]。当微波功率低于380 W时,菌体细胞获得的能量较少,细胞由于不能被充分加热而导致提取率较低。但当微波功率过大时,活性分子运动过于剧烈,活性物质间容易发生副作用,或者变质[33, 34],而导致提取率下降。微波提取过程中,在固定功率下,提取剂的温度与提取时间成正相关。因此,提取时间由30 s延长至90 s,挥发油提取率显著升高。当提取时间达到一定范围后,有效成分萃取完全,溶液内部达到萃取平衡,再次延长时间对提取效果没有显著影响。因此,90 s后继续延长提取时间,提取率几乎不变。
大量研究表明,挥发油具有一定的抑菌作用。马刚等[19]报道樟芝发酵液提取的挥发油对棉花枯萎病菌和沙门氏菌具有一定的抑制活性。本实验表明,樟芝挥发油对考察的几种常见皮肤癣菌均具有一定的抑制作用。然而,挥发油成分复杂多样,不同方法获得的挥发油因组分不同,而表现不同的生理活性。因此,不同提取方法获得的挥发油,抑制几种真菌的MIC不同。其中,微波辅助双液相萃取的挥发油MIC最低,为5-20 mL/L,抑菌活性优于市售克霉唑。索氏提取得到的挥发油提取率最高,但由于直接使用石油醚为提取剂,挥发油中含有脂溶性杂质,导致抑制真菌有效浓度高,且该法耗时长。与其它提取方法相比,微波辅助双液相萃取不仅提取率高,挥发油抑制真菌有效浓度低,而且耗时短。
4 结论微波辅助石油醚/乙醇双液相萃取技术提取樟芝挥发油的最适条件为:乙醇体积浓度56%,石油醚体积浓度30%,固液比1:50,微波功率380 W,微波时间90 s。此条件下,挥发油提取率为0.69%,对红色毛癣菌等7种常见皮肤癣菌的MIC为5-20 mL/L,抑菌效果优于市售克霉唑。微波辅助双液相萃取挥发油耗时短,提取率高,且获得的挥发油对几种常见皮肤癣菌抑制效果显著。
| [1] | 戴玉成, 李玉. 中国六中重要药用真菌名称的说明[J]. 菌物学报, 2011, 30(4):515-518. |
| [2] | Geethangili M, Tzeng YM. Review of pharmacological effects of Antrodia camphorata and its bioactive compounds[J]. Evidence-Based Complementary and Alternative Medicine, 2009, 2011:1-17. |
| [3] | Huang GJ, Deng JS, Huang SS, et al. Protective effect of antrosterol from Antrodia camphorata submerged whole broth against carbon tetrachloride-induced acute liver injury in mice[J]. Food Chemistry, 2012, 132(2):709-716. |
| [4] | Yeh CT, Rao YK, Yao CJ, et al. Cytotoxic triterpenes from Antrodia camphorata and their mode of action in HT-29 human colon cancer cells[J]. Cancer Letters, 2009, 285(1):73-79. |
| [5] | Geethangili M, Fang SH, Lai CH, et al. Inhibitory effect of Antrodia camphorata constituents on the Helicobacter pylori-associated gastric inflammation[J]. Food Chemistry, 2010, 119(1):149-153. |
| [6] | Hattori M, El-Halawany A, Mizuno M, et al. Compounds from Antrodia cinnamomea and use thereof:U. S. Patent 8, 703, 968[P]. 2014-4-22. |
| [7] | Yang HL, Lin KY, Juan YC, et al. The anti-cancer activity of Antrodia camphorata against human ovarian carcinoma(SKOV-3)cells via modulation of HER-2/neu signaling pathway[J]. Journal of Ethnopharmacology, 2013, 148(1):254-265. |
| [8] | 吴芳, 郭增军, 罗定强, 等. 五苓系列制剂中挥发油的GC指纹图谱研究[J]. 药物分析杂志, 2013, 33(8):1355-1358. |
| [9] | Li B, Zhang C, Peng L, et al. Comparison of essential oil composition and phenolic acid content of selected Salvia species measured by GC-MS and HPLC methods[J]. Industrial Crops and Products, 2015, 69:329-334. |
| [10] | Shao L, Bao MH, Ouyang DS, et al. Unstable simple volatiles and gas chromatography-tandem mass spectrometry analysis of essential oil from the roots bark of Oplopanax horridus extracted bysupercritical fluid extraction[J]. Molecules, 2014, 19(12):19708-19717. |
| [11] | 白岩岩, 贾薇, 张劲松. 樟芝发酵液挥发性物质提取方法及成分比较[J]. 食品科学, 2013, 34(24):163-167 . |
| [12] | Liu H, Jia W, Zhang JS, et al. GC-MS and GC-olfactometry analysis of aroma compounds extracted from culture fluids of Antrodia camphorata[J]. World Journal Microbiol Biotechnol, 2015, 24:1599-1602. |
| [13] | 陈菲, 张奉苏, 杨念云, 等. 樟芝菌粉挥发性成分的HSGC/MS 分析及其指纹图谱研究[J]. 质谱学报, 2014, 35(2):149-157. |
| [14] | Lu ZM, Tao WY, Xu HY, et al. Analysis of volatile compounds of Antrodia camphorata in submerged culture using headspace solid-phase microextraction[J]. Food Chemistry, 2011, 127:662-668. |
| [15] | Diao WR, Hu QP, Zhang H, et al. Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel(Foeniculum vulgare Mill.)[J]. Food Control, 2014, 35(1):109-116. |
| [16] | Sousa RMF, de Morais SAL, Vieira RBK, et al. Chemical composition, cytotoxic, and antibacterial activity of the essential oil from Eugenia calycina Cambess. leaves against oral bacteria[J]. Industrial Crops and Products, 2015, 65:71-78. |
| [17] | Behmanesh F, Pasha H, Sefidgar SAA, et al. A comparative study of antifungal activity of Lavender brew, Lavender essential Oil, and Clotrimazole:an in vitro study[J]. Caspian Journal of Reproductive Medicine, 2015, 1(1):26-30. |
| [18] | Cavaleiro C, Salgueiro L, Gonçalves MJ, et al. Antifungal activity of the essential oil of Angelica major against Candida, Cryptococcus, Aspergillus and Dermatophyte species[J]. Journal of Natural Medicines, 2015:1-8. |
| [19] | 马刚, 田雪梅, 张振宇, 等. 樟芝挥发油的提取及其GC-MS分析与抑菌作用的研究[J]. 西南农业学报, 2011, 3:970-973. |
| [20] | Boutekedjiret C, Bentahar F, Belabbes R, et al. Extraction of rose-mary essential oil by steam distillation and hydrodistillation[J]. Flavour and Fragrance Journal, 2003, 18(6):481-484. |
| [21] | Arranz E, Jaime L, de las Hazas MCL, et al. Supercritical fluid extraction as an alternative process to obtain essential oils with anti-inflammatory properties from marjoram and sweet basil[J]. Industrial Crops and Products, 2015, 67:121-129. |
| [22] | García-Abarrio SM, Martin L, Burillo J, et al. Supercritical fluid extraction of volatile oil from Lippia alba(Mill. )cultivated in Aragón(Spain)[J]. The Journal of Supercritical Fluids, 2014, 94:206-211. |
| [23] | Lago S, Rodríguez H, Arce A, et al. Improved concentration of citrus essential oil by solvent extraction with acetate ionic liquids[J]. Fluid Phase Equilibria, 2014, 361:37-44. |
| [24] | Filly A, Fernandez X, Minuti M, et al. Solvent-free microwave extraction of essential oil from aromatic herbs:from laboratory to pilot and industrial scale[J]. Food Chemistry, 2014, 150:193-198. |
| [25] | Karakaya S, El SN, Karagozlu N, et al. Microwave-assisted hydrodistillation of essential oil from rosemary[J]. Journal of Food Science and Technology, 2014, 51(6):1056-1065. |
| [26] | Ma C, Liu T, Yang L, et al. Ionic liquid-based microwave-assisted extraction of essential oil and biphenyl cyclooctene lignans from Schisandra chinensis Baill fruits[J]. Journal of Chromatography A, 2011, 1218(48):8573-8580. |
| [27] | 何喆, 陆震鸣, 许泓瑜, 等. 顶空固相微萃取-气质联用法测定樟芝菌丝体中挥发性化合物[J]. 中药材, 2011, 11:1722-1725. |
| [28] | 侯敏, 李华, 王华. 3种萃取溶剂对赤霞珠葡萄酒香气成分GC-MS分析的影响[J]. 西北农业学报, 2011, 20(10):90-96. |
| [29] | Letellier M, Budzinski H. Microwave assisted extraction of organic compounds[J]. Analusis, 1999, 27(3):259-270. |
| [30] | 李敏晶. 微波辅助萃取中药有效成分的研究[D]. 长春:吉林大学, 2004. |
| [31] | Zhang DY, Zu YG, Fu YJ, et al. Aqueous two-phase extraction and enrichment of two main flavonoids from pigeon pea roots and the antioxidant activity[J]. Seperation Purification Technology, 2013, 102:26-33. |
| [32] | Chemat S, Aït-Amar H, Lagha A, et al. Microwave-assisted extraction kinetics of terpenes from caraway seeds[J]. Chemical Engineering and Processing:Process Intensification, 2005, 44(12):1320-1326. |
| [33] | Ma FY, Gu CB, Zhao CJ, et al. Microwave-assisted aqueous two-phase extraction of isoflavonoids from Dalbergia odorifera T. Chen leaves[J]. Seperation Purification Technology, 2013, 115:136-144. |
| [34] | Vongsangnak W, Gua J, Chauvatcharin S, et al. Towards efficient extraction of notoginseng saponins from cultured cells of Panax notoginseng[J]. Biochemical Engoneering Journal, 2004, 18:115-120. |