2.中国农业科学院生物技术研究所,北京 100081;
3.中国农业科学院植物保护研究所,北京 100193;
4.农业部科技发展中心,北京 100122
2. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081;
3. Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing 100193;
4. Development Center of Science and Technology,Ministry of Agriculture,Beijing 100122
随着转基因技术的兴起和快速发展,转基因产品的安全性问题逐渐成为国际社会普遍关注的热点和焦点[1, 2]。为促进转基因产业的健康发展,保障消费者的知情权和选择权,世界上许多国家和地区颁布了相关的转基因生物安全管理与标识制度[3, 4, 5]。其中,欧盟是世界上转基因生物安全管理与标识管理制度较为严格和完善的地区,也是第一个提出进行阈值管理的地区[6]。为了给转基因生物安全管理与标识制度提供技术支撑,欧盟花费庞大人力、物力和财力进行转基因检测技术研究。构建了完善的转基因检测方法循环研制实验室网络和转基因检测标准物质研制机构[7, 8]。在欧洲,执行转基因检测的机构组成了欧洲转基因检测网络实验室(European Network of GMO Laboratories,ENGL)。ENGL除了进行日常检测,还对欧盟设置在欧盟联合研究中心(Joint Research Centre,JRC)下属健康与消费者保护研究所(Institute for Health and Consumer Protection,IHCP)的欧盟转基因食物与饲料基准实验室(European Union Reference Laboratory for GM Food & Feed,EURL-GMFF)研制和提供的转基因检测方法进行验证[9, 10]。目前国际上研制的转基因检测标准物质和发布的转基因检测标准方法有一半以上来自欧盟,因此有必要对欧盟的转基因检测技术平台进行分析研究。
根据在欧盟联合研究中心健康及消费者保护研究所下属欧盟转基因食品和饲料基准实验室、意大利拉齐奥大区和托斯卡纳大区动物预防性实验研究院下属转基因检测国家基准实验室、翁布里亚区食品科技园(3A-PTA)内第三方食品安全检测实验室(Analysis)、洛迪省Tavazzano种子检测实验室等8家转基因检测相关机构(实验室)和单位进行的调研和考察,本文重点阐述了转基因检测过程中的关键技术要点以及欧盟的实施情况。并结合我国转基因生物安全检测发展现状提出相应建议,旨为我国转基因检测技术的发展提供参考。
1 抽样与制样抽样是转基因成分检测的第一个环节,也是非常复杂和重要的环节。抽样要有代表性,要能准确反映出样品的总体情况[11]。欧盟国家转基因安全管理主要遵循预防原则,与我国采取的源头控制理念类似。以意大利为例,目前意大利尚未批准转基因作物的商业化种植,在转基因生物监控计划实施过程中,边境检查站、国家宪兵队和地区卫生部门等执法机构负责抽样工作,样品主要来自进口等环节;农业部执法机构抽检样品则主要来源于种子企业的种子库,基本不对市场上销售的产品进行检测。因此,意大利转基因检测抽样主要是针对批次货物,不涉及田间种植样品。
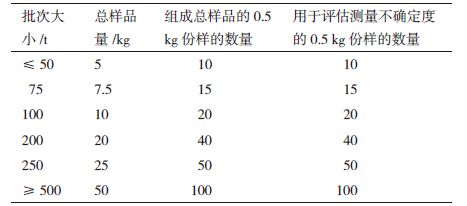
在典型情况下,欧盟国家执法机构的抽样工作参照《Rec. 2004/787/EC Technical guidance for sampl-ing and detection of GMOs》进行[12],可以对多至109粒的样品进行抽样。多个取样点至少可以获得105粒种子,将多个取样点的样品混匀,从中取出3份各3 000粒种子交给转基因检测机构进行检测。转基因检测机构将其中一份3 000粒种子粉碎,取少量(至少包含105个粉碎的颗粒)粉末提取DNA,用于转基因检测(批次样品量大小及其组成,见表 1)。
通过了国际种子协会(International Seed Testing Association,ISTA)认证的检测机构,在收样时遵从ISTA规范的规定,每份检测样品至少含有3 000粒种子。种子检测机构一般将样品分为5份,并研磨其中2份用于转基因检测,因此,总收样量至少15 000粒。
在我国转基因检测工作中,种子类样品一般至少检测3 000粒。对比来看,我国标准和欧盟的规范均能在95%的置信度下保证0.1%的检测灵敏度,我国做法是符合国际规范的。
在计算种子数量方面,Tavazzano种子检测实验室的做法有自己的特色,在我国标准中,规定了不同作物种子的千粒重,而Tavazzano种子检测实验室采用了实测的值。在现实情况中,相同作物不同品种种子千粒重可能有翻番的差别,因此采取一个固定值有较大误差。在可能情况下,在相关标准制定和修订时应考虑这个因素。
欧盟从事转基因检测的第三方检测机构也采用了经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)的标准通过了良好实验室管理规范(Good Laboratory Practice,GLP)认证,与政府实验室类似,其样品也来源于委托方送样,并仅对来样负责。
2 转基因检测方法的认定转基因检测方法的标准化是获得准确可靠、具有可比性检测结果的基础[13]。JRC下属欧盟转基因检测基准实验室的主要任务是为欧盟的立法提供技术支持,工作的重点在检测方法的研究和验证上,不从事一般的日常检测工作。
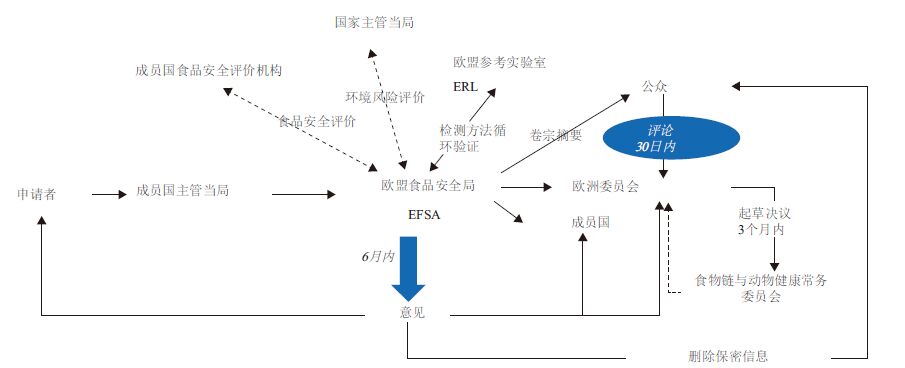
依据欧盟法规,申请在欧洲释放的转基因生物,需要通过某一成员国主管当局申请。成员国主管当局在确认收到申请的同时,应在90 d内作成一份评估报告。若同意申请,成员国主管当局应尽快将评估报告和相关的信息发送给欧盟委员会和其他欧盟成员国。欧盟委员委托欧盟食品安全局(European Food Safety Authority,EFSA)在医学、营养学、毒理学、生物学、化学和其他相关学科方面的专家进行评估。如果欧盟食品安全局和其他欧盟成员国没有提出反对意见,则应以书面形式批准转基因生物投放市场。
与此同时,申请者需向欧盟转基因检测基准实验室(或称参考实验室)提交检测方法和对照材料,由欧盟参考实验室组织12家欧盟实验室网络成员,对检测方法进行循环验证。检测方法达到欧盟相关法规要求的,方可依据安全评价结果,给予授权。欧盟转基因生物授权程序,见图 1。
|
| 图 1 欧盟转基因生物授权程序 |
由于欧盟要求对转基因食品进行标识,并设置了标识阈值,因此提交给欧盟参考实验室的转基因检测分析方法均为实时荧光定量PCR检测方法,依据欧盟对转基因检测分析方法最低性能要求的定义,欧盟对检测方法认定分为两个阶段,第一阶段为申请者提交方法文本的检查,第二阶段为检测方法的循环验证。
在第一阶段,主要考察申请者提交检测方法的如下性能特性:(1)适用性;(2)可操作性;(3)特异性;(4)动态范围,即检测的精确性和准确性在线性范围内的转基因成分浓度区间;(5)准确性,±25%范围内;(6)扩增效率,标准曲线斜率在-3.6至-3.1之间;(7)相关系数,R2≥0.98;(8)重复性标准偏差,线性范围内RSDr<25%;(9)定量极限,RSDr<25%前提下小于法规要求的标识阈值0.9%的1/10,即0.09%或50拷贝;(10)检测极限,在95%置信度下,小于法规要求的标识阈值的1/20,即0.045%;(11)稳健性,即可以忍受检测实验条件的小的变化,在此变化下检测结果偏差不会超过±30%。
在第二阶段,主要通过多实验室联合测试,确保申请者所提交方法符合欧盟要求,并且在不同实验室有同样性能表现。考察的主要指标为动态范围、再现性标准偏差和准确性。实验室联合验证中,在精确度方面,所有浓度样品的RSDr均应低于35%。当浓度小于0.2%时,RSDr在小于50%的范围内都是可以接受的。在准确度方面,所有浓度样品的偏差不得超过±30%。
3 样品检测欧盟转基因检测机构无论采用何种技术规范,参加何种体系的认证,出具的定性或定量报告,基本都采用荧光定量PCR进行检测。与常规PCR相比,荧光定量PCR显著减少了实验室PCR产物污染的可能性。这是因为PCR产物是转基因检测实验室最主要的污染来源之一,而荧光定量PCR不需要电泳,因此反应结束后不需要开盖,避免了反应产物泄漏造成的污染。此外,与常规PCR相比,荧光定量PCR具有检测灵敏度更高、检测速度更快的优点。在意大利转基因检测国家基准实验室定性判断也是基于荧光定量PCR的结果进行,这种做法减少了实验室污染,提高了检测结果的可靠性。因此,我国应在制定和修订的转基因检测相关标准时考虑增加采用荧光定量PCR检测的内容。
EURL-GMFF 是欧盟主要转基因检测方法的研制机构之一,核心检测室都有独立的温度、湿度和气压控制系统。实验室内的气压分为+20 mbar、+10 mbar、0 mbar、-10 mbar及-20 mbar 等5个等级,EURL-GMFF采用的不仅是简单的正负压控制,还根据实验要求的洁净程度和污染程度的不同进行了细分。气压的多级控制事实上形成了实验室内部的连续稳定气流方向,进一步提高了实验室洁净程度,从而保证了欧洲基准实验室方法研究和评价的准确性,这一点值得我国未来的基准实验室参考。除了拥有实验室正负压控制系统外,欧洲基准实验室大量使用了100%外排生物安全柜。同时,所有的PCR准备工作都在生物安全柜等专门的隔离的设施设备内进行。成本增加不多,但极大减少了污染的可能性。
意大利转基因检测国家基准实验室虽然面积紧张,但仍然采用了DNA自动提取设备,自动分液机械臂,高通量自动进样荧光定量PCR仪等高端设备,以减少人员的操作误差和提高工作效率,这是未来转基因检测工作的发展方向之一,值得国内跟踪。
根据意大利转基因检测国家基准实验室介绍,其在DNA提取过程中除了使用传统的CTAB法,也采取了3种不同的商品化试剂盒。由于利用不同方法从不同原料中提取DNA的效率不同,因此在定量时必须采用与标准相同的DNA提取方法。欧洲基准实验室公布的方法均是基于CTAB的方法,特别是IRMM提供标准物质在质量百分比换算到拷贝数百分比时需要一个矫正系数,这个系数的获得与CTAB法的提取效率相关联[14, 15]。如果实验室贸然使用了非标准方法,而没有考虑以上这些因素,可能造成较大的定量误差。非标准方法的使用不仅在政府检测实验室中存在,而且在企业转基因检测机构也同样存在,如意大利的一些第三方食品安全检测实验室等在样品量大时为了加快检测速度,使用了快速荧光定量PCR技术。
欧洲基准实验室公布的转基因检测方法都公开发布在网站并不断更新(http://gmo-crl.jr-c.ec.europa.eu/StatusOfDossiers.aspx)。如果成员国在检测过程中需要使用的方法欧洲基准实验室没有公布,则该国可以组织验证,并由该国国家基准实验室发布。在突发事件的检测中,立法机构可以临时发布新的检测方法,并直接授权检测机构采用。这一点与我国做法类似,但具有更高的灵活性。
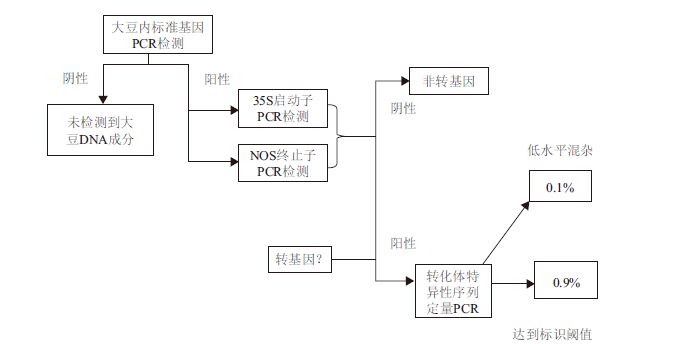
理论上转基因检测技术可分为通用元件筛查、目标基因检测、载体特异性检测和转化事件特异性检测4个水平。但绝大多数检测机构均只进行通用元件筛查和转化事件特异性检测,而且以上检测均是以通用元件筛查为基础,在通用元件筛查结果呈阳性的基础上,再根据通用元件的信息进行所有可能的转化事件的检测,如果筛查结果均为阴性,则不再进行事件特异性检测。检测流程如图 2所示。
|
| 图 2 转基因产品检测流程(以大豆为例) |
从以上分析可知,通用元件筛查的结果是欧盟转基因检测机构判断样品是否含转基因成分的关键。同时,不同机构筛查的转基因元件有所不同,转基因检测国家基准实验室筛查的元件最多,共筛查CaMV 35S启动子、NOS终止子、PAT基因、NPTII基因和CP4-EPSPS等5个元件,而Tavazzano种子检测实验室仅检测CaMV 35S启动子,选检NOS终止子。根据公开信息可知,这种策略有较大的漏检风险。
在欧盟采用的定量标识中,如果采用相对定量PCR技术,仅能标识标准曲线最高和最低浓度范围内的含量,如采用5%的标准物质,连续稀释至0.1%,那么仅能给出5%-0.1%范围内的值。超过标准曲线最高点的测定值仅能标识为>5%,低于标准曲线最低点的测定值仅能标识为<0.1%。在没有扩增信号的情况下,结果表述为<LOD,在有扩增但含量低于定量极限的情况下,结果表述为<LOQ。
根据以上所述,我国与欧盟在转基因检测技术方面的对比,如表 2所示。
任何定量的结果,均应提供测定值及测定值的不确定度,转基因含量的定量也不例外[16]。不确定度的计算大体可以分为Bottom up和Top down两种方式,分别适用于不确定度来源清晰、可分别测量的工作和来源复杂不可分拆的情况。
在欧盟转基因检测工作中,转基因检测标准物质的研制事实上采用的是Bottom up方式,分别测定各测量、加工步骤产生的不确定度,并最终合成到总的不确定度中。
而转基因检测方法的不确定度的来源则非常复杂,包括了标准物质的不确定度、不同仪器设备产生的不确定度、不同试剂产生的不确定度,不同操作人员引起的不确定度等(图 3)。这些不确定度有些来源于系统误差,有些则是随机因素引起。在系统误差难以测量的情况下,可以将所有的不确定度当作随机误差引起的B类不确定度进行计算。

|
| 图 3 利用Real-time PCR 对DNA 中转基因含量检测时不确定度的来源 |
JRC在《Guidance document on measurement uncertainty for GMO testing laboratories》中推荐了两种转基因检测不确定度测定方法[17],分别适合单个实验室内部确定和利用检测方法循环验证数据测定。在采用没有多家实验室循环验证数据的方法的情况下,可以由单一实验室的历史数据来确定该实验室采用该方法的不确定度。但由于欧盟基准实验室公布的方法均经过多家实验室的循环验证,代表了该方法在一般实验室使用的情况,并公布了包括检测方法在各实验室使用结果的验证报告,因此可以直接计算出该方法在一般转基因检测实验室使用的不确定度。多数转基因检测实验室选择了利用循环验证报告直接计算本实验室数据的不确定度。事实上,参照《Guidance document on measurement uncertainty for GMO testing laboratories》还可以利用检测方法的验证报告计算该检测方法的LOD和LOQ。因此,这个指南解决了转基因定量检测的主要数据处理问题。
置信区间事实上是根据t分布计算的。根据《Guidance document on measurement uncertainty for GMO testing laboratories》可知,在扩展系数取2时,利用这种方法测定的不确定度事实上是测定值的双尾95%置信区间。这个计算方法本身并没有问题。但当该区间的下限超过0.9%时,实际上是有97.5%的概率大于0.9%的欧盟标识阈值,这种做法实际上比法律要求的更高,欧盟的转基因检测实验室工作人员实际上也承认这个缺陷,但由于这个方法来源于欧盟推荐的文献,因此他们必须采用。我国将来如采用定量检测和标识,应重新考虑这个问题。
5 对我国转基因生物安全检测的启示和建议 5.1 建立我国转基因检测方法的实验室循环验证制度科学、有效的转基因检测方法是转基因生物安全监管的重要前提和基础。欧盟在转基因产品授权程序中,突出强调检测方法的审查与循环验证,制定了专门的文件对检测方法性能要求、认定及验证程序进行规定,并将检测方法是否符合欧盟监管要求作为是否给予授权的必要条件。我国对转基因生物实施全程监管并要求对列入标识目录的进行标识,检测方法是我国安全监管和标识制度实施的基础。目前,我国对于申请安全评价的转基因生物没有明确法规要求研发机构提供阳性样品,对其提供的检测方法,仅进行文字材料审查。这些无法保证提供的方法满足我国转基因检测机构的使用和安全监管需求。建议将提供阳性样品和检测方法作为申报安全证书的必要条件,并开展提供的检测方法的实验室循环验证。
5.2 提高我国农业转基因检测能力建设水平通过几年来的建设,我国转基因检测体系基本完善,技术水平也有了很大提高,但与欧盟检测实验室及化学类检测实验室相比较,整体自动化水平还比较低,检测通量还很小,检测成本偏高。因此有必要参考欧盟检测实验室的发展经验,进一步提高我国转基因检测能力水平,同时加快推荐配套的标准体系和管理体系的建设。
我国目前尚未设置转基因产品标识阈值,现今生物技术产业迅速发展,零阈值的定性标识导致实际操作困难。因此,有必要参考欧盟经验及考虑我国的具体情况调整标识制度。同时对各检测机构的检测能力和水平进行进一步提升,大力加强转基因定量检测支撑体系建设。
在检测技术方面,我国主要采用定性PCR检测方法,此方法具有对设备技术要求简单,检测成本低等优点,在我国转基因生物安全监管中发挥了重要作用,但随着检测技术水平和监管要求的提高,其不足之处也有所体现。一是与普遍采用定量检测方法的欧盟等国家或地区检测结果无法比较、互认,不利于贸易争端的解决;二是进行凝胶电泳增加了检测步骤,易产生气溶胶污染;三是在检测的灵敏度、准确性方面与定量PCR有差距。另外,我国大部分检测机构都配备了定量PCR仪,掌握了实时荧光PCR检测操作技术。因此,建议推进定量PCR在我国检测机构中的应用并逐步替代定性PCR,推进转基因检测与国际接轨。此外,由于转基因检测标准物质既是保障转基因定量检测准确可靠的基本前提,也是转基因检测工作的核心。因此,建议加强转基因检测标准物质的研制,研发具有自主知识产权的标准物质,以促进转基因检测技术和方法研究的发展,为我国转基因生物安全监管和安全评价提供更好的物质保障。
| [1] | James C. 2014年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2015(1):1-14. |
| [2] | 盛耀, 许文涛, 罗云波. 转基因生物产业化情况[J]. 农业生物技术学报, 2013, 12:1479-1487. |
| [3] | 刘培磊, 李宁, 周云龙. 美国转基因生物安全管理体系及其对我国的启示[J]. 中国农业科技导报, 2009(5):49-53. |
| [4] | 卓勤. 各国转基因食品标识制度概况分析[J]. 中国食品学报, 2014(8):16-20. |
| [5] | Twardowski T, Malyska A. Uninformed and disinformed society and the GMO market[J]. Trends Biotechnol, 2015(1):1-3. |
| [6] | 韩永明, 翟广谦, 徐俊锋. 欧盟转基因生物管理法规体系的演变及对我国的启示[J]. 浙江农业科学, 2013(11):1482-1485. |
| [7] | 佘丽娜, 李志明, 潘荣翠. 美国与欧盟的转基因食品安全性政策演变比对[J]. 生物技术通报, 2011(10):1-6. |
| [8] | 孙彩霞, 刘信, 徐俊锋, 等. 欧盟转基因食品溯源管理体系[J]. 浙江农业学报, 2009(6):645-648. |
| [9] | Barbau-Piednoir E, Stragier P, Roosens N, et al. Inter-laboratory testing of GMO detection by combinatory SYBR®green PCR screening(CoSYPS)[J]. Food Analytical Methods, 2014(8):1719-1728. |
| [10] | Angers-Loustau A, Petrillo M, Bonfini L, et al. JRC GMO-Matrix:a web application to support Genetically Modified Organisms detection strategies[J]. BMC Bioinformatics, 2014, 15:417. |
| [11] | Emslie KR, Whaites L, Griffiths KR, et al. Sampling plan and test protocol for the semiquantitative detection of genetically modified canola(Brassica napus)seed in bulk canola seed[J]. J Agric Food Chem, 2007, 11:4414-4421. |
| [12] | Regulation EC. 787/2004. Technical guidance for sampling and detection of GMOs[S]. Off J Eur Commun, 2004, L348:18-24. |
| [13] | Zhang D, Guo J. The development and standardization of testing methods for genetically modified organisms and their derived products[J]. J Integr Plant Biol, 2011, 7:539-551. |
| [14] | Turkec A, Kazan H, Karacanli B, et al. DNA extraction techniques compared for accurate detection of genetically modified organisms(GMOs)in maize food and feed products[J]. J Food Sci Technol, 2015, 52(8):5164-5171. |
| [15] | Turkec A, Kazan H, Baykut A, et al. Evalution of DNA extraction methods in order to monitor genetically modified materials in soy foodstuffs and feeds commercialised in Turkey by multiplex real-time PCR[J]. J Sci Food Agr, 2015, 2:386-392. |
| [16] | Burns M, Valdivia H. A procedural approach for the identification of sources of uncertainty associated with GM quantification and real-time quantitative PCR measurements[J]. Eur Food Res Technol, 2007, 1:7-18. |
| [17] | Trapman S, Burns M, Broll H, et al. Guidance Document on Measurement Uncertainty for GMO Testing Laboratories[J]. European Commission, 2009. doi:10. 2787/18988. |