诱导胚胎干细胞体外分化为生殖细胞对于临床医学实践和人类生殖细胞发育机理的理论研究两方面都具有重要意义。近年来,有多篇研究报道诱道小鼠或人的胚胎干细胞分化可以观察到类原始生殖细胞、类精子和类卵细胞的结构形成。早在2006年,Nayernia 等[1]就将小鼠胚胎干细胞诱导形成完全成熟并具有生理功能的精子,可使小鼠卵细胞受精,此受精卵植入小鼠卵巢可产下后代。但迄今仍未能从人类胚胎干细胞诱导出完全成熟并具有一定生理功能的卵细胞。要想获得这样的卵细胞,目前还有很多问题尚未解决,其中之一就是如何能有效检测胚胎干细胞分化的阶段。解决这一问题的有效手段之一是建立人胚胎干细胞向卵细胞分化的报告系统,将在卵细胞中特异表达基因的启动子与荧光蛋白相连接,通过荧光蛋白的表达来指示胚胎干细胞体外分化的卵细胞阶段。2009年,Kee等[2]在诱导人胚胎细胞分化的过程中就使用了VASA-eGFP检测系统,将VASA基因启动子与eGFP蛋白的序列相连接,慢病毒感染人的胚胎干细胞,成功检测并分离出分化的人胚胎干细胞中的原始生殖细胞群体。
ZP2(Zona pellucida 2)是组成卵细胞透明带的重要蛋白之一。透明带由哺乳动物分泌的糖蛋白组成,包围在卵母细胞周围,对于哺乳动物受精过程中的精卵识别、精卵结合以及避免多次受精现象有非常重要的作用[3]。ZP2和另一种组成透明带的重要蛋白ZP3是已知的为数不多的仅在卵细胞中表达的蛋白,表达具有很高的组织特异性[4]。ZP2蛋白在表达后受到多种糖基化修饰[5],与ZP3蛋白形成异源二聚体结构[6],最终形成透明带。在功能上,ZP2与已发生顶体反应的精子直接结合,是结合精子的第二受体[7]。Zp2敲除的小鼠卵母细胞透明带变薄,无法正常排卵,即便取出这样的小鼠的卵细胞在体外培养成熟并受精,得到的胚胎也无法正常发育[8]。人和小鼠的ZP2基因非常保守,在它们的5'末端有一段575 bp的片段,其中有超过70%的碱基是一致的[9]。重组表达人ZP2蛋白的Zp2敲除小鼠,其透明带的缺陷能得到部分修复[10]。ZP2的转录始于原始卵泡期之后,受到原始卵泡阶段重要的转录因子Figlα的调控[11]。此后,随着卵泡发育迅速上升,在卵细胞发育到半径为50-60 μm时达到最高值,在卵子成熟及排卵开始时迅速降至最高值的5%以下[12]。ZP2的表达特异性使得其很适合作为指示卵母细胞发育阶段的标志基因。
本研究利用不同长度的ZP2启动子片段与荧光蛋白eGFP相连接构建出荧光报告质粒。由于人类胚胎干细胞有不易被转染的特点,因此报告系统采用慢病毒感染的方式植入ZP2报告系统[13]。同时用人成纤维细胞WI38进一步检验该报告系统的组织特异性。由于人卵母细胞样本珍贵、不易取得,本实验暂采用小鼠卵母细胞,通过体外培养和荧光观察筛选出能特异指示卵母细胞的报告系统,旨为人类胚胎干细胞分化、卵母细胞的鉴定及卵母细胞的分离提供良好的工具和手段。
1 材料与方法 1.1 材料293FT细胞培养液成分:DMEM(Dulbecco’s modified eagle medium),胎牛血清(Fetal bovine serum,FBS),Glutamax,非必需氨基酸(Non-essential amino acid,NEAA),Pen/strip,Sodium Pyruvate,G418(Geneticin,遗传霉素)。H9细胞培养液成分:Knockout DMEM(Knockout dulbecco’s modified eagle medium),血清替代物(Knockout Serum Replacer,KSR),Glutamax,NEAA,Pen/Strep,人基础成纤维细胞生长因子(Human Basic Fibroblast Growth Factor,hbFGF)。WI38细胞培养液成分:最低基础培养液(Minimum essential medium,MEM),FBS,NEAA,Pen/Strep。以上试剂均购自Gibco公司。小鼠卵母细胞培养和显微操作用试剂:M2培养液(迈晨),M16培养液(迈晨),矿物油(Sigma)。构建重组质粒所用试剂盒pENTR 5'-TOPO TA cloning Kit(Invitrogen),pENTR Directional TOPO cloning Kit(Invitrogen),Gateway LR ClonaseⅡPlus Enzyme Mix Kit(Invitrogen)。质粒转染所用试剂:opti-MEM(Gibco),Lipofectamin 2000(Invitrogen)。
1.2 方法 1.2.1 人ZP2启动子300 bp和2 500 bp片段的克隆人ZP2启动子片段根据已知序列(Enrez Gene ID:7783)进行引物设计(表 1),模板为人WI38细胞的基因组DNA(基因组的提取按照DNeasy Blood & Tissue Kit(QIAGEN)使用说明进行)。利用Taq聚合酶(Invitrogen)进行PCR反应,反应总体积为50 μL,其中5 μL 10×buffer-MgCl2,1 μL 10 mmol/L dNTP,1 μL10 μmol/L hZP2-300-F primer/ hZP2-2 500-F primer,1 μL 10 μmol/L hZP2-R primer,4 μL 57 ng/mL WI38 genome,0.2 μL Taq Polymerase,38.3 μL ddH2O。反应程序:94℃ 5 min;94℃ 30 s,60℃/65℃ 30 s,72℃ 30 s(300 bp片段)/2 min 30 s(2 500 bp片段),共35个循环;72℃ 10 min。PCR产物经Invitrogen公司测序确认。
所有病毒包装用质粒使用 QIAGEN Plasmid Maxi Kit(QIAGEN)进行去内毒素质粒大提。病毒包装用293FT细胞铺在175 cm2培养瓶中,待细胞密度约90%时可用于病毒包装。病毒包装液A:120 μL Lipofectamine + 5 mL Opti-MEM,包装液B:10 µg病毒包装质粒 Vsvg+ 15 µg 病毒包装质粒∆8.9 + 10 µg ZP2报告载体 + 10 mL Opti-MEM. 室温静置混合液A和B 5 min,将A和B振荡混合,室温静置20 min。之后移除293FT细胞中原有培养液,将AB混合溶液均匀铺在细胞表面,37℃恒温箱中培养6 h后弃掉培养瓶中的AB混合液,加入18 mL 293FT细胞培养液(不含G418和PEN/STRIP)。将培养瓶转入慢病毒培养室中37℃恒温培养72 h。之后收集培养瓶中的悬浮液入50 mL离心管中,2 000 r/min离心5 min,上清用Millex-HV 0.45 μm的滤器过滤。产物在-80℃条件下保存。
1.2.3 未分化H9细胞的病毒感染用于感染的H9细胞铺在经matrigel(BD)预处理的6孔板中至密度50%时用于病毒感染。移除细胞中原有的培养液,每孔加入1 mL病毒原液。37℃恒温培养6 h后每孔补充2 mL完全培养液,37℃恒温培养过夜。24 h后弃去细胞中病毒溶液,每个孔加入2 mL完全培养液,37℃培养过夜后弃去培养液,用含blasticidin的培养液筛选出已被成功感染的细胞,连续筛选3-5 d,每天更换一次培养液。
1.2.4 细胞DAPI染色和荧光显微观察细胞弃去原有培养液,磷酸盐缓冲液(Phosphate buffered saline,PBS)清洗两次后,加入适量4%多聚甲醛(完全覆盖细胞表面即可),室温固定15 min。去除多聚甲醛,PBS清洗后,加入含1 μg/mL DAPI染料的PBS,避光染色20 min。弃去染液,PBS清洗后在荧光显微镜下观察。
1.2.5 小鼠卵母细胞的显微注射和体外培养小鼠卵母细胞从12周龄B6D2F1小鼠卵巢中获得,置于在M2培养液中。利用Eppendof NK2显微操作仪,将吸卵针连接到控制器上,调整到合适位置。向注射针中加入待注射质粒,质粒需用去内毒素质粒大提方法提取,并溶解在分子生物学级H2O中,再将注射针连接控制器。向培养皿盖上滴加一滴M2培养液(5-10 μL),并用矿物油封住液滴后,将之移至载物台上。调整两操作臂,使两针均浸入M2液滴中,使之接近培养皿底部,但不能触底。将准备好的卵母细胞移入该液滴,吸卵针保持卵母细胞位置,注射针将一定量报告质粒注射入卵母细胞细胞核中。注射完毕的小鼠卵母细胞转移至M16培养液中,37℃ CO2 培养箱内培养过夜,再荧光观察。
2 结果 2.1 人ZP2启动子300 bp和2 500 bp片段报告载体的构建根据人ZP2基因启动子序列设计相应上下游引物(表 1),以WI38细胞系基因组为模板,PCR反应后将产物通过DNA电泳检测,在预期片段大小位置有特异条带(图 1)。回收该条带并通过酶切连接到pENTR-5'-TOPO载体,产物经测序确定序列和插入方向无误。将带有ZP2基因启动子的重组质粒pENTR-5'-ZP2 promoter与带有报告基因eGPF的质粒pENTR-D-eGFP和2k7bsd质粒混合,其上带有的同源重组的位点发生重组得到ZP2-300-eGFP和ZP2-2500-eGFP重组质粒,经测序检验插入位点和序列无误。

|
| M:DNA Marker;1:退火温度为60℃时的PCR产物条带;2:退火温度为65℃时的PCR产物条带 图 1 人ZP2启动子300 bp(A)和2 500 bp(B)片段PCR结果 |
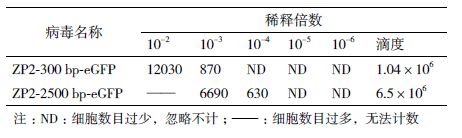
重组质粒经过去内毒素质粒大提后用于病毒的包装,用于包装病毒的293FT细胞在转染带有人ZP2启动子报告载体的重组质粒和包装病毒的辅助质粒72 h后可以观察到预期的细胞凋亡现象,此时收集到的细胞上清液中含有大量带人ZP2报告载体的慢病毒(图 2)。
|
| A:正常生长的293FT细胞; B:转染病毒包装质粒72 h后的293FT细胞 图 2 带有人ZP2启动子报告载体的慢病毒包装结果 |
病毒滴度用单位体积的病毒悬液所能感染的细胞数目表示。将获取的病毒悬液稀释到不同浓度后感染WI38细胞,用含2 μg/mL blasticidin的细胞培养液筛选4 d,计算筛选后的剩余细胞数,计算得出病毒滴度(表 2)。滴度在104及以上的病毒可用于后续实验。
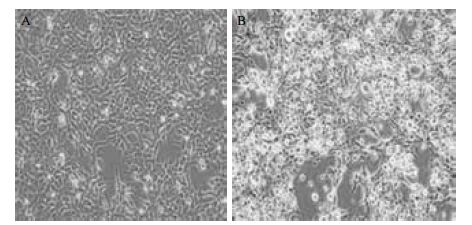
将带有人ZP2启动子300 bp和2 500 bp片段报告载体的慢病毒感染WI38(人成纤维细胞)和未分化H9(人胚胎干细胞系)细胞,阳性对照使用EF1α-eGFP病毒感染293FT细胞,一定浓度的blasticidin筛选4 d后进行荧光显微观察,结果(图 3)显示两种报告载体慢病毒在感染WI38和未经分化的H9细胞后都无绿色荧光蛋白表达,而阳性对照细胞中可以观察到明显的绿色荧光。
|
| A:ZP2-300 bp-eGFP病毒感染后的WI38细胞;B:ZP2-2500 bp-eGFP病毒感染后的WI38细胞;C:ZP2-300 bp-eGFP病毒感染后的未分化H9细胞;D:ZP2-2500 bp-eGFP病毒感染后的未分化H9细胞;E:EF1α-eGFP病毒感染后的293FT细胞 图 3 ZP2-300-eGFP和ZP2-2500-eGFP病毒分别感染WI38细胞和未分化的H9细胞后荧光观察结果 |
从12周大小的B2D6F1雌性小鼠的卵巢中取得小鼠GV(Germinal vesicle)期卵母细胞,放入M2培养液培养,将带有人ZP2启动子片段的报告载体显微注射入GV期卵母细胞的细胞核中,注射后卵母细胞转入M16培养液,37℃恒温培养,24 h后观察细胞荧光。对照组细胞从小鼠卵巢中取出后未进行注射处理即放入培养箱中培养。培养24 h后,注射ZP2-2500-eGFP质粒的小鼠卵母细胞可观察到绿色荧光,而注射ZP2-300-eGFP质粒和对照组细胞无绿色荧光。将有绿色荧光的卵母细胞继续培养48 h后再次进行观察,仍能观察到微弱绿色荧光。
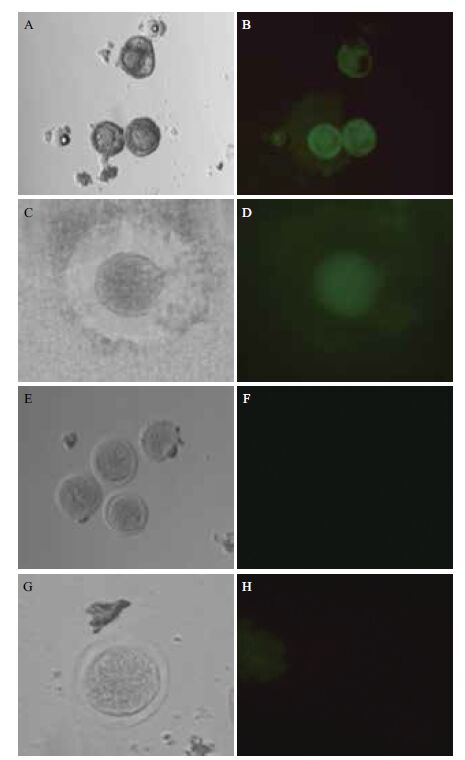
|
| A,B:注射ZP2-2500-eGFP质粒的小鼠卵母细胞体外培养24 h后的观察结果;C,D:注射ZP2-2500-eGFP质粒的小鼠卵母细胞体外培养72 h后的观察结果;E,F:对照组小鼠卵母细胞体外培养24 h后的观察结果;G,H:注射ZP2-300-eGFP质粒的小鼠卵母细胞体外培养24 h后的观察结果;A,C,E,G:明场观察;B,D,F,H:绿色荧光观察 图 4 经显微注射人ZP2报告载体的小鼠卵母细胞体外培养和荧光观察结果 |
体外分化培养干细胞得到成熟生殖细胞具有重要的科学价值和临床意义,但成熟生殖细胞的形成需要进行减数分裂,其外观和功能都发生了重大变化。因此,此类研究多年来一直是干细胞研究领域的难点之一。2003年,Hubner等[14]首次由小鼠胚胎干细胞自发分化得到卵细胞。此后Gejisen等[15]将小鼠胚胎干细胞分化为胚体,利用SSEA1作为筛选标记富集其中的原始生殖细胞,视黄酸体外诱导分化出类似精子的细胞,将其显微注射入小鼠卵细胞后能发育到囊胚时期。2006年,Nayernia等[1]利用Stra8和Prm1报告系统,将小鼠胚胎干细胞体外分化类似精子的细胞,用其受精后的卵细胞再植入小鼠体内并成功获得了后代,但这些后代在体型大小上与正常小鼠不同,且都在未成年之前死亡。2011年,Hayashi等[16]用SSEA1和Integrinβ3作为筛选标记,从诱导分化的小鼠胚胎干细胞筛选出原始生殖细胞,移植回小鼠睾丸后发育为成熟精子,用这种方法获得的精子能使小鼠卵细胞受精并发育为成熟后代。2012年,该作者又用类似的方法获得了小鼠的成熟卵细胞,这种卵细胞能被正常小鼠精子受精并发育为成熟后代[17]。另一方面,在人类胚胎干细胞的研究中,早期多采用简单流式分选或标记蛋白流式分选的方式来分离分化得到的原始生殖细胞,但一直未能获得单倍体[18, 19]。2009年,Kee等[2]采用VASA-eGFP报告系统,从BMPs诱导分化的人类胚胎干细胞中富集原生殖细胞,并通过高表达内源因子DAZL\BOULE\DAZ的方式最终获得单倍体精细胞。但至今尚未有成功将人胚胎干细胞体外分化有功能的成熟卵细胞的研究报道。
使用体外分化方式获得人类成熟卵细胞面临众多问题,如早期分化过程中生殖细胞命运的确定,减数分裂的起始和完成,卵泡结构的成熟等。卵细胞发育过程中,初级卵泡阶段会发生卵细胞第一次减数分裂停滞的恢复,此时卵细胞与颗粒细胞之间的相互作用较之前会显著增强,这些变化对于卵细胞后期的发育成熟极为重要[20]。因此,建立报告系统,有效地指示出分化到初级卵泡及其之后时期的细胞对于最终获得成熟卵细胞的研究很有意义。
本研究采用不同片段长度的人ZP2启动子与绿色荧光蛋白eGFP构建ZP2-300-eGFP和ZP2-2500-eGFP两个报告系统,一般认为基因的启动子越长越利于保持其表达的时空特异性,片段过短会丢失某些关键调控元件,但较长的片段整合入基因组的效率较低,同样对报告系统的指示作用造成影响。从WI38细胞核未分化的胚胎干细胞H9的实验看,这两种不同长度的启动子都不会启动荧光报告基因在这些细胞中的表达。而显微注射和荧光观察的结果表明,ZP2-2500-eGFP报告系统可特异启动荧光报告基因在小鼠卵母细胞中的表达,可作为一种有效的工具应用于胚胎干细胞向卵母细胞分化的研究中。
4 结论
成功构建ZP2-300-eGFP和ZP2-2500-eGFP两个报告系统,通过在WI38细胞、未分化的H9细胞核小鼠卵母细胞中的验证,发现ZP2-2500-eGFP报告系统可以特异启动荧光报告基因在卵母细胞中的表达,而在其他细胞系中无报告荧光表达。
| [1] | Nayernia K, Nolte J, Michelmann HW, et al. In vitro-differentiated embryonic short article stem cells give rise to male gametes that can generate offspring mice[J]. De Cell, 2006, 11: 125-132. |
| [2] | Kee K, Angeles VT, Flores M, et al. Human DAZL, DAZ and BOULE genes modulate primordial germ-cell and haploid gamete formation[J]. Nature, 2009, 462: 222-225. |
| [3] | Kalab P, Schultz RM, Kopf GS. Modifications of the mouse zona pellucida during oocyte maturation: Inhibitory effects of follicular fluid, fetuin, and a2HS-glycoprotein[J]. Biology of Reporduction, 1993, 49: 561-567. |
| [4] | Hinsch E, Hägele W, van der Ven H, et al. Immunological Identification of zona pellucida 2(ZP2)Protein in Human Oocytes[J]. Andrologia, 1998, 30(4-5): 281-287. |
| [5] | Jimenez-Movilla M, Aviles M, Gomez-Torres MJ, et al. Carbohydrate analysis of the zona pellucida and cortical granules of human oocytes by means of ultrastructural cytochemistry[J]. Human Reproduction, 2004, 19(8): 1842-1855. |
| [6] | Luca J, William GJ, Eveline SL, et al. The PLAC1-homology region of the ZP domain is sufficient for protein polymerisation[J]. BMC Biochemistry, 2006, 207(1): 30-39. |
| [7] | Gupta SK, Bansal P, Ganguly A, et al. Human zona pellucida glycoproteins: functional relevance during fertilization[J]. Journal of Reproductive Immunology, 2009, 83: 50-55. |
| [8] | Rankin TL, O’Brien M, Lee E, et al. Defective zonae pellucidae in Zp2-null mice disrupt folliculogenesis, fertility and development[J]. Development, 2001, 128: 1119-1126. |
| [9] | Millar SE, Lander E, Liang LF, et al. Oocyte-specific factors bind a conserved upstream sequence required for mouse zona pellucida promoter activity[J]. Mol Cell Biol, 1991, 11(12): 6197-6204. |
| [10] | Rankin T, Dean J. The zona pellucida: using molecular genetics to study the mammalian egg coat[J]. Reviews of Reproduction, 2000, 5(2): 114-121. |
| [11] | Rosemary ALB, Sarah JM, Richard AA. Increased expression of the FIGLA transcription factor is associated with primordial follicle formation in the human fetal ovary[J]. Molecular Human Reproduction, 2004, 10(6): 373-381. |
| [12] | Liang LF, Chamow SM, Dean J. Oocyte-specific expression of mouse Zp-2: Developmental regulation of the zona pellucida genes[J]. Mol Cell Biol, 1990, 10(4): 1507-1515. |
| [13] | Suter DM, Cartier L, Bettiol E, et al. Rapid Generation of stable transgenic embryonic stem cell lines using modular lentivectors[J]. Stem Cells, 2006, 24: 615-623. |
| [14] | Hubner K, Fuhrmann G, et al. Derivation of oocytes from mouse embryonic stem cells[J]. Science, 2003, 300: 1251-1256. |
| [15] | Geijsen N, Horoschak M, Kim K, et al. Derivation of embryonic germ cells and male gametes from embryonic stem cells[J]. Nature, 2004, 427: 148-154. |
| [16] | Hayashi K, Ohta H, Kurimoto K, et al. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells[J]. Cell, 2011, 146: 519-532. |
| [17] | Hayashi K, Ogushi S, Kurimoto K, et al. Offspring from oocytes derived from in vitro primordial germ cell-like cells in mice[J]. Science, 2012, 338: 971-975. |
| [18] | Tilgner K, Atikinson SP, Golebiewska A, et al. Isolation of primordial germ cells from differentiating human embryonic stem cells[J]. Stem Cells, 2008, 26(12): 3075-3085. |
| [19] | Bucay N, Yebra M, Cirulli V, et al. A novel approach for the derivation of putative primordial germ cells and sertoli cells from human embryonic stem cells[J]. Stem Cells, 2009, 27(1): 68-77. |
| [20] | Nicholas CR, Chavez SL, Baker VL, et al. Instructing an embryonic stem cell-derived oocyte fate: lessons from endogenous oogenesis[J]. Endocrine Reviews, 2009, 30(3): 264-283. |