2.上海生物制品研究所有限责任公司分子病毒研究室,上海 200052
2. Laboratory of Molecular Virology,Shanghai Institute of Biological Products Co.,Ltd.,Shanghai 200052
采用动物细胞培养技术生产流感疫苗,是将病毒适应到传代细胞,并在生物反应器中大规模进行病毒繁殖以实现流感疫苗的规模化生产。目前,这种工艺已经逐步取代传统鸡胚培养技术,成为流感疫苗生产的主流工艺。然而,相对于日益增长的全球流感疫苗需求,这种生产工艺产能相对低下,因此提高工艺效率的研究工作势在必行。近年来,应用于提高产率的手段多种多样,主要涉及营养调节(维持培养基优化、流加、灌注等)[1, 2, 3, 4]、基因改造[5, 6, 7]和感染参数调整[感染复数(Multiplicity of infection,MOI)、感染时间(Time of infection,TOI)等][8]等几个方面。
在基于MDCK细胞(Mardin-Darby kidney cells,MDCK)培养技术的流感疫苗生产工艺中,MDCK细胞是流感病毒的宿主细胞,流感病毒在细胞内的扩增必然会受到感染时的细胞生理状态的影响。生理状态良好的细胞有利于病毒的感染复制,可提高流感病毒在细胞内的扩增效率,而TOI是决定感染病毒时细胞生理状态的关键因素。因此,TOI是流感疫苗生产工艺中一个重要的优化参数。细胞在生长过程中其生理状态是随时间不断变化的,其生产病毒的能力也会随之发生相应改变。因此,考察细胞在何时处于感染复制病毒的最佳生理状态成为一个关键研究点。当TOI较小时,细胞处于对数生长期时,细胞对应的生理状态较好,此时可能有利于病毒感染复制。当TOI较大,细胞处于衰亡期时,细胞逐渐死亡,这对于病毒扩增过程可能造成不利影响[1, 9, 10, 11, 12]。然而,目前的研究工作大多仅涉及最适合TOI的选择,而鲜见TOI对细胞生长、代谢与流感病毒扩增过程影响的研究[8, 13]。因此,深入研究TOI对MDCK细胞生产流感病毒过程的影响机制,对于流感疫苗工艺的开发与优化具有重要的意义。
本研究通过以H1N1流感病毒于不同TOI条件下感染MDCK细胞的方法,研究TOI对MDCK细胞生长、代谢以及流感病毒扩增过程的影响,以期能够揭示TOI对MDCK细胞培养中流感病毒生产过程的作用机制,为基于动物细胞培养技术的流感疫苗生产工艺的开发与优化工作提供数据支持。
1 材料与方法 1.1 材料 1.1.1 细胞株与培养基本实验所用的细胞株为犬肾上皮连续细胞系MDCK细胞,购自ATCC。细胞培养所用培养基补加10%(V/V)胎牛血清(购自美国Gibco公司)和3 700 mg/L碳酸氢钠(购自美国Sigma-Aldrich公司)的DMEM培养基(购自美国Gibco公司)。流感病毒生产阶段所用维持培养基为添加5 mg/L 经甲苯磺酰苯丙氨酰氯甲酮(TPCK)处理的胰蛋白酶(购自美国Sigma-Aldrich公司)的DMEM培养基。
1.1.2 病毒株WHO推荐的甲型流感病毒株A/California/7/2009(H1N1)X-179A,购于英国国家生物标准与检定所(National Institute for Biological Standards and Control,NIBSC)。该病毒为以模式甲型流感A/PR8/34病毒株为骨架,含2009年流行的猪流感病毒抗原蛋白基因的重组病毒株。病毒原液为在SPF鸡胚中收获的尿囊液,其半组织感染滴度TCID50值为5.62×108 TCID50/mL。
1.2 方法 1.2.1 细胞培养种子细胞用方瓶贴壁培养,待种子细胞足够时于搅拌瓶中以微载体悬浮培养进行接毒实验。方瓶培养:从细胞库中复苏MDCK细胞,以4×104-5×104 cells/cm2细胞密度接种于方瓶(购自美国Corning公司)中,置于 37℃、5% CO2的培养箱中培养,作为实验用的种子细胞。待MDCK细胞生长至铺满方瓶底部约80%-90%后,去掉培养液,用不含钙镁的无菌磷酸缓冲液(Phosphate buffered saline,PBS)(0.2 mL/cm2)漂洗细胞;然后于室温下用含0.25%(W/V)胰蛋白酶(购自Gibco公司)和0.05%(W/V)EDTA(Ethylene diamine tetraacetic acid,EDTA)(购自Sigma-Aldrich公司)的无菌消化液(0.2 mL/cm2)消化细胞30-60 s;弃消化液后,置于5% CO2、饱和湿度的培养箱37℃孵育至细胞收缩变圆,轻摇方瓶细胞即可脱落;加入新鲜培养基轻柔吹打均匀后传代,接种密度为4×104-5×104 cells/cm2。
微载体搅拌瓶培养:微载体CytodexTM 1(购自美国GE-Healthcare公司)用PBS浸泡3次,每次浸泡30 min,灭菌后待用。接种MDCK细胞至装有微载体的无菌500 mL搅拌瓶(购自美国Corning公司)中,接种细胞密度为2×105-3×105 cells/mL,微载体用量为2 g/L,培养液体积为200 mL。置于37℃、5% CO2的培养箱中,搅拌瓶转速设为50 r/mim。
1.2.2 病毒感染细胞培养至实验既定时间(TOI,视具体实验设计而定),去除上清,以等培养体积的PBS洗涤细胞两次以除去残留血清蛋白及抑制性代谢物,加入等体积含病毒原液(MOI=0.01,以病毒原液TCID50值为依据[14])和维持培养基继续孵育。
1.2.3 MOI确定方法根据刘鹏等[15, 16, 17]的方法,以不同MOI(1、0.01、0.001、0.000 1和0.000 01)接种病毒原液感染以微载体培养生长良好的MDCK细胞,血凝滴度实验(Hemagglutination assay,HA)结果显示MOI为0.01时病毒HA滴度最高,表明接种剂量选择MOI=0.01为最佳,故本实验MOI采用0.01。
1.2.4 取样及样品处理培养过程中每12 h取样,计数细胞。培养悬液经300×g离心10 min后取上清于-20℃保存,用于检测营养物和代谢副产物浓度。上清存-80℃用于测定流感病毒血凝滴度。
1.2.5 细胞计数传代时细胞经消化后以台盼蓝拒染法计数。具体来说,培养好的贴壁细胞消化后,用新鲜的培养基将细胞按一定比例制成细胞悬液。以0.5 mL加入24孔板一孔中,加入0.5 mL 0.4%台盼蓝染液,染色2-3 min后吸取少许悬液涂于血球计数板上,加上盖玻片,镜下对每个视野分别计死细胞和活细胞数。微载体培养的细胞以结晶紫染核法计数。其方法为,取1 mL含铺有细胞的微载体的培养液,沉降弃上清,以不含钙镁的磷酸缓冲液(Phosphate buffered saline,PBS)洗涤一遍,去除上清,加入与上清等体积的结晶紫裂解染色液,摇床上37℃孵育4 h。经处理,微载体上细胞被裂解,细胞核释放到上清中并被结晶紫染色。将此悬液吹打均匀后用PBS缓冲液以适当倍数稀释,用血球计数板计数细胞核即为活细胞数。计数所需试剂均购自Sigma-Aldrich公司。
1.2.6 营养物及代谢副产物浓度测定培养液中营养物葡萄糖、谷氨酰胺和代谢副产物乳酸、氨的浓度使用生化分析仪Bioprofile 400 analyzer(购自美国Nova biomedical公司)测定。
1.2.7 流感病毒血凝滴度测定采用血凝滴度实验HA试验方法测定。配置鸡红细胞悬液,使悬液中的红细胞密度控制在2.0×107 cells/mL左右。在每个孔中加入50 µL配置好的鸡红细胞悬液,振荡器上振荡混匀,室温下静置20-30 min后,观察其结果[18]。每个样品同时平行测试2遍,结果取平均值。所需96孔微量反应板购自Corning公司,鸡红细胞由上海生物制品研究室有限责任公司提供。
1.2.8 计算方法细胞比生长速率计算:

细胞比死亡速率
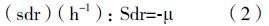
代谢速率计算:

计算乳酸对葡萄糖的转化率Ylac/gluc(mmol/mmol)及氨对谷氨酰胺的转化率Yamm/gln(mmol/mmol):


单位细胞病毒产率(svy)的计算[19]:
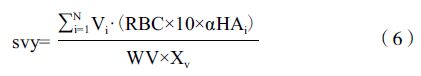
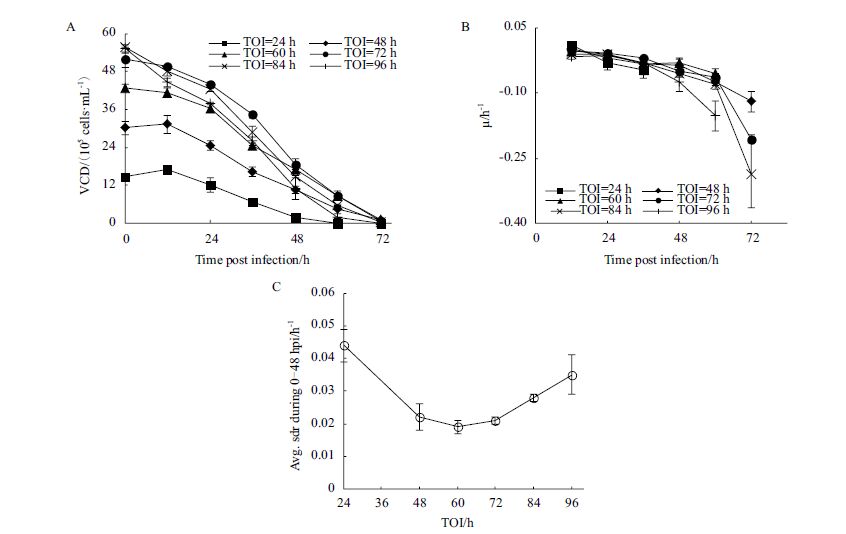
将MDCK细胞培养至24、48、60、72、84和96 h后感染H1N1流感病毒(即TOI分别为24、48、60、72、84和96 h),考察TOI对感染H1N1流感病毒后MDCK细胞生长的影响,结果如图 1所示。
|
| 图 1 不同TOI条件下MDCK细胞的活细胞密度(A)、比生长速率(B)和0-48 hpi平均比死亡速率(C) |
各TOI条件下,感染时活细胞密度CCI(Cell concentration at infection,CCI)为(1.49±0.04)×106 cells/mL、(3.01±0.20)×106 cells/mL、(4.28±0.12)×106 cells/mL、(5.19±0.25)×106 cells/mL、(5.57±0.01)×106 cells/mL和(5.52±0.13)×106 cells/mL。TOI=24 h与TOI=48 h组在感染后12 h(12 hpi)内,细胞密度分别增加(14.61±7.38)%和(21.57±2.62)%,该阶段比生长速率均为正值;随后细胞密度快速下跌,比生长速率变为负值,前者细胞密度60 hpi跌至0,后者细胞密度72 hpi跌至0。TOI=60 h组0-24 hpi细胞密度缓慢下跌,该阶段平均比生长速率为-0.003 h-1;随后下跌速度加剧,72 hpi跌至0。TOI=84 h与96 h组,细胞密度自0 hpi起便快速下跌,无增长期或缓慢下跌期。
计算0-48 hpi平均死亡速率(图 1-C)可知,TOI小于60 h时,细胞比死亡速率随TOI增加而减小;当TOI大于60 h时,细胞比死亡速率随TOI增加而增加。
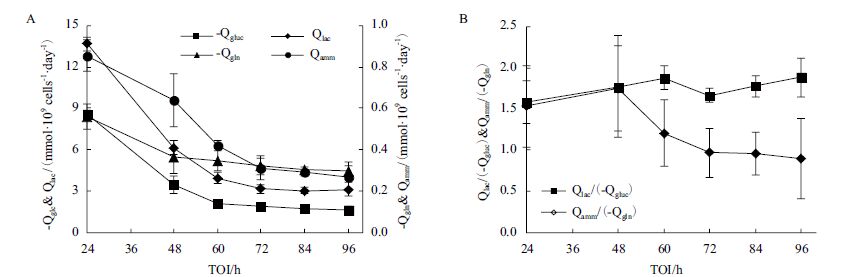
2.2 TOI对感染H1N1流感病毒后MDCK细胞代谢的影响同时,本实验也考察了TOI对感染H1N1流感病毒后MDCK细胞代谢的影响,结果如图 2所示。TOI小于60 h时,葡萄糖比消耗速率(-Qgluc)随TOI增加而大幅下跌;TOI小于60 h时,-Qgluc随TOI变化幅度减小。TOI小于48 h时,谷氨酰胺的比消耗速率(-Qgln)随TOI增加大幅下跌;TOI大于48 h时,-Qgln变化幅度较小。对于乳酸和氨这两种代谢产物,TOI小于72 h时生成速率(Qlac和Qamm)随TOI增加而大幅下跌;TOI大于72 h,Qlac和Qamm代谢速率很小。
|
| 图 2 不同TOI条件下MDCK代谢速率(A)及葡萄糖和谷氨酰胺转化效率(B) |
另外,计算乳酸对葡萄糖的转化率(Qlac/(-Qgluc))与氨对谷氨酰胺的转化率(Qamm/(-Qgln)),结果表明,随着TOI增大,Qlac/(-Qgluc)逐渐增大,而Qamm/(-Qgln)逐渐减小(图 2-B)。
2.3 TOI对MDCK细胞中H1N1流感病毒扩增过程的影响TOI对H1N1流感病毒在MDCK细胞中扩增过程的影响如图 3所示。图 3-A和3-B显示,TOI=24 h组HA滴度至24 hpi达到2.56×102 HA units/50 µL,随后至48 hpi达峰值6.09×102 HA units/50 µL,72 hpi时略有下降;TOI设为48 h,至24 hpi 病毒HA滴度仅为1.28×102 HA units/50 µL,48 hpi达到最大值7.24×102 HA units/50 µL,72 hpi时下跌;TOI为60 h,24 hpi 时HA滴度为(3.84±1.81)×102 HA units/50 µL,48 hpi达最大值(8.74±2.12)×102 HA units/50 µL,72 hpi下降;TOI为72 h,24 hpi 时HA滴度为5.12×102 HA units/50 µL,48 hpi达最大值1.02×103 HA units/50 µL,72 hpi略降;TOI为84 h和96 h,HA滴度亦于48 hpi达最大值,但最大值均低于TOI=72 h组。进一步计算(图 3-C)得知,单位细胞病毒产率svy随TOI增大而降低。而且,TOI=72 h时获得的HA滴度最高,svy却并非最高。随着TOI增加,感染前细胞密度CCI呈上升趋势,而对应svy则呈下降趋势(图 3-C)。
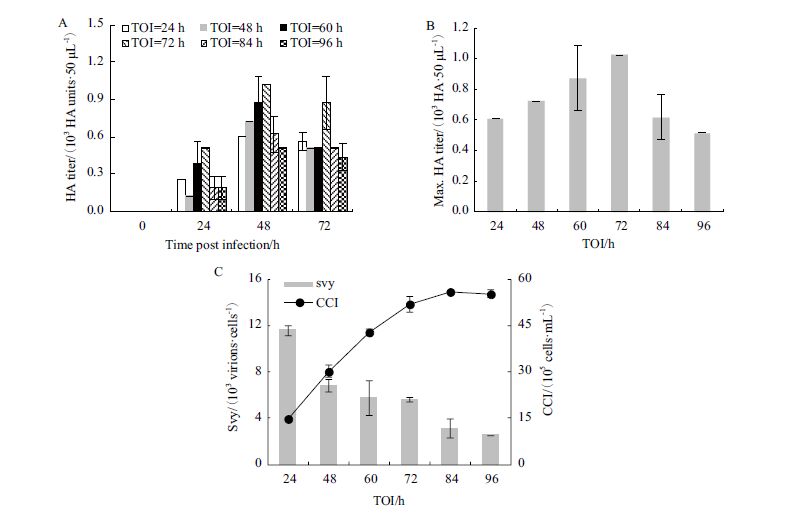
|
| 图 3 不同TOI条件下MDCK中H1N1流感病毒滴度随时间变化(A)、最大滴度(B)和单位细胞病毒产率(C) |
据上述图 3-C结果,有必要进一步考察TOI、CCI与svy的关系。本实验将取自不同培养时间(TOI=24、36、48、60和72 h)的细胞浓缩或稀释至不同细胞密度梯度,即每个TOI条件下设置1×106-5×106 cells/mL 5个细胞密度梯度,考察各实验组svy值。图 4显示,当TOI相同时,不同CCI条件下svy值基本不变;而当CCI相同时,svy随TOI增加而降低。
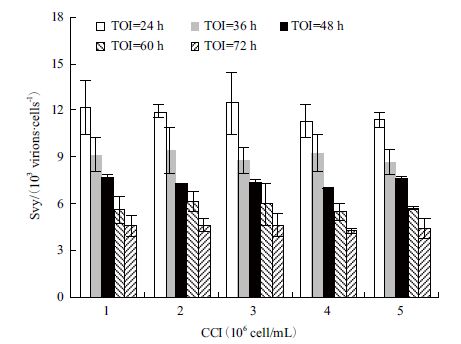
|
| 图 4 不同TOI与CCI条件下MDCK细胞中单位细胞病毒产率 |
近年来,全世界对流感疫苗的需求量在飞速增长。相较之下,以动物细胞培养方法为基础的流感病毒疫苗生产工艺的产能则相对低下,成为制约这种新兴工艺发展的一个瓶颈因素[20]。因此,提高生产效率一直是该类工艺开发与优化工作的重点。在众多的考察因素中,感染参数TOI是一个重要考察对象。然而,目前工作大多仅涉及最适合TOI值的选择[13, 21],而少有研究TOI值对工艺过程影响机制。据此,本研究通过设置不同TOI条件,研究了其对细胞生长、代谢与流感病毒扩增过程影响,以及TOI、CCI与svy之间的关系。
首先,考察了TOI的设定值对被流感病毒感染后的MDCK细胞的生长和代谢的影响。通过上述研究结果可以发现,TOI的设定值会影响细胞死亡速率,TOI值过小或过大均会使被H1N1流感病毒感染的MDCK细胞死亡速率加快。推测其原因可能为:当TOI过小时,细胞密度较小,细胞之间结合比较疏松,且细胞伸展到微载体表面,导致细胞体积大,表面积大[22],因而更容易被病毒感染脱落死亡或被TPCK-胰酶影响[23, 24];相反,TOI过大,细胞衰老,代谢废物累积等原因造成细胞很脆弱,甚至出现凋亡,同时病毒感染又会加剧凋亡过程,所以细胞死亡速率快。同时,TOI设定值不同,也会导致细胞代谢速率出现很大差异。结果表明,被感染后的细胞的对Gluc、Gln、Lac和Amm等物质的代谢速率会随着TOI值的增大而减缓。在细胞生长过程中,细胞之间相互作用,胞内各种代谢相关的酶活均会不断变化[22, 25],最终导致不同TOI条件下细胞对各种营养代谢物的代谢速率不同。综合这两方面结果,不同TOI条件下,感染前细胞维持培养的时间长短不一,从而导致细胞密度不同、营养物的消耗量和代谢副产物的累积量不同。另外不容忽视的一点,不同TOI条件下感染流感病毒后MDCK细胞对乳酸对葡萄糖的转化率和氨对谷氨酰胺的转化效率也会有很大差别。Qlac/(-Qgluc)随TOI设定值的增加而增大,表明随着TOI的增大,进入三羧酸循环(Trica-rboxylic acid cycle,TCA)的Gluc减少,Gluc的产能效率降低;而Qamm/(-Qgln)逐渐减小,表明随着TOI的增大,进入TCA的Gln增多,Gln的产能效率提高[25]。如前所述,培养后期细胞变得脆弱甚至出现凋亡,并且病毒扩增过程也会导致细胞凋亡。而凋亡过程会致使线粒体膜通透性增加,出现能量缺陷[26],需要更多的Gluc进入糖酵解来补充能量[27],同时生成乳酸[25]。与此同时,更多的Gln进入回补TCA途径,待Gln耗竭,便会诱导谷氨酰胺合酶活性,通过谷氨酸和氨合成谷氨酰胺,从而导致Qamm/(-Qgln)逐渐减小[25]。另外,氨气通过培养基挥发逃逸可能也是原因之一。综上分析,MDCK细胞的生长状态、代谢速率及代谢效率均有很大差别,表明不同TOI条件下MDCK细胞的状态也会有很大差别。
另外,通过考察TOI对流感病毒扩增过程的影响发现,TOI不同,则病毒的产量和单位细胞病毒产率也会有很大差别。更值得注意的一点,在此实验条件下CCI越高svy越低,这与文献中提到的“细胞密度效应”极为相似[19, 28]。但经进一步研究TOI、CCI、svy 三者之间的关系可知,当保持TOI不变时,这种“细胞密度效应”则不复存在。换言之,svy高低更大程度上取决于TOI值的大小。纵观全文研究结果,TOI之所以能对MDCK细胞中H1N1流感病毒扩增过程产生显著影响,其根源在于不同TOI条件下细胞自身状态有很大差别[21]。据此,在今后的工艺开发工作中,可以不再受限于TOI,而通过人为合理调控细胞状态的手段来提高流感病毒生产效率。但细胞状态变化所包含的因素错综复杂,而且目前对其界定也尚未十分明确。TOI不同可能会导致细胞表面病毒受体、细胞周期分布、细胞凋亡、信号转导机制、营养组分浓度、代谢毒物积累程度以及其它未知微环境等众多因素发生变化[3, 13, 19, 29],这些都有待进一步详细考察。
4 结论在不同TOI条件下以H1N1流感病毒感染MDCK细胞,考察TOI对MDCK细胞生长与代谢动力学以及H1N1流感病毒扩增过程的影响。结果表明,虽将TOI设置为72 h时H1N1流感病毒产量最高,但svy却随TOI增大而呈现下降趋势。继而考察TOI、CCI与svy三者之间关系可知,该现象是由TOI不同所引起的细胞状态改变所致,而非仅由高细胞密度导致。该研究揭示了由TOI不同导致的细胞状态差异对MDCK细胞中H1N1流感病毒生产效率的重要性,表明有望通过调整细胞状态的手段优化动物细胞培养生产流感疫苗的工艺以提高生产效率。
| [1] | Henry O, Dormond E, Perrier M, et al. Insights into adenoviral vector production kinetics in acoustic filter-based perfusion cultures[J]. Biotechnology and Bioengineering, 2004, 86(7): 765-774. |
| [2] | Pohlscheidt M, Langer U, Minuth T, et al. Development and optimisation of a procedure for the production of Parapoxvirus ovis by large-scale microcarrier cell culture in a non-animal, non-human and non-plant-derived medium[J]. Vaccine, 2008, 26(12): 1552-1565. |
| [3] | Huang D, Xia-Hou K, Liu XP, et al. Rational design of medium supplementation strategy for improved influenza viruses production based on analyzing nutritional requirements of MDCK Cells[J]. Vaccine, 2014, 32(52): 7091-7097. |
| [4] | 孔文刚, 黄锭, 罗剑, 等. 细胞密度和营养供给对 H1N1流感病毒产率的影响[J]. 生物技术通报, 2015, 31(1): 203-208. |
| [5] | Hatakeyama S, Sakai-Tagawa Y, Kiso M, et al. Enhanced expression of an α2, 6-linked sialic acid on MDCK cells improves isolation of human influenza viruses and evaluation of their sensitivity to a neuraminidase inhibitor[J]. Journal of Clinical Microbiology, 2005, 43(8): 4139-4146. |
| [6] | Olsen CW, Kehren JC, Dybdahl-Sissoko NR, et al. bcl-2 alters influenza virus yield, spread, and hemagglutinin glycosylation[J]. Journal of Virology, 1996, 70(1): 663-666. |
| [7] | Tsao YS, Condon R, Schaefer E, et al. Development and improvement of a serum-free suspension process for the production of recombinant adenoviral vectors using HEK293 cells[J]. Cytotechnology, 2001, 37(3): 189-198. |
| [8] | Aggarwal K, Jing F, Maranga L, et al. Bioprocess optimization for cell culture based influenza vaccine production[J]. Vaccine, 2011, 29(17): 3320-3328. |
| [9] | Ferreira TB, Ferreira AL, Carrondo MJ, et al. Effect of re-feed strategies and non-ammoniagenic medium on adenovirus production at high cell densities[J]. J Biotechnol, 2005, 119(3): 272-280. |
| [10] | Ferreira TB, Ferreira AL, Carrondo MJ, et al. Two different serum-free media and osmolality effect upon human 293 cell growth and adenovirus production[J]. Biotechnol Lett, 2005, 27(22): 1809-1813. |
| [11] | Garnier A, Côté J, Nadeau I, et al. Scale-up of the adenovirus expression system for the production of recombinant protein in human 293S cells[J]. Cytotechnology, 1994, 15(1-3): 145-155. |
| [12] | Nadeau I, Garnier A, Cote J, et al. Improvement of recombinant protein production with the human adenovirus/293S expression system using fed-batch strategies[J]. Biotechnol Bioeng, 1996, 51(6): 613-623. |
| [13] | Genzel Y, Dietzsch C, Rapp E, et al. MDCK and Vero cells for influenza virus vaccine production: a one-to-one comparison up to lab-scale bioreactor cultivation[J]. Applied Microbiology and Biotechnology, 2010, 88(2): 461-475. |
| [14] | Dubois E, Merle G, Roquier C, et al. Diversity of enterovirus sequences detected in oysters by RT-heminested PCR[J]. Int J Food Microbiol, 2004, 92(1): 35-43. |
| [15] | 刘鹏, 李佳林, 马超, 等. H1N1流感病毒在微载体培养MDCK细胞上增殖的研究[J]. 微生物学免疫学进展, 2013, 41(1): 12-15. |
| [16] | 张严予, 马磊, 沈霏, 等. 无血清微载体培养MDCK细胞和甲型流感病毒H1N1的条件优化[J]. 云南大学学报: 自然科学版, 2011: 340-344. |
| [17] | 李春艳, 肖晶, 李曦, 等. 微载体规模化培养MDCK细胞增殖H9N2亚型禽流感病毒的研究[J]. 中国人兽共患病学报, 2009, 25(12): 1149-1153. |
| [18] | Kalbfuss B, Knöchlein A, Kröber T, et al. Monitoring influenza virus content in vaccine production: precise assays for the quantitation of hemagglutination and neuraminidase activity[J]. Biologicals, 2008, 36(3): 145-161. |
| [19] | Bock A, Schulze-Horsel J, Schwarzer J, et al. High-density microcarrier cell cultures for influenza virus production[J]. Biotechnology Progress, 2011, 27(1): 241-250. |
| [20] | Frensing T, Heldt FS, Pflugmacher A, et al. Continuous influenza virus production in cell culture shows a periodic accumulation of defective interfering particles[J]. PLoS One, 2013, 8(9): 8999-9008. |
| [21] | Chen A, Poh SL, Dietzsch C, et al. Serum-free microcarrier based production of replication deficient Influenza vaccine candidate virus lacking NS1 using Vero cells[J]. BMC Biotechnology, 2011, 11(1): 81. |
| [22] | Rehberg M, Ritter J, Genzel Y, et al. The relation between growth phases, cell volume changes and metabolism of adherent cells during cultivation[J]. Journal of Biotechnology, 2013, 164(4): 489-499. |
| [23] | Huang HL, Hsing HW, Lai TC, et al. Trypsin-induced proteome alteration during cell subculture in mammalian cells[J]. J Biomed Sci, 2010, 17: 36. |
| [24] | Hossain MJ, Perez S, Guo Z, et al. Establishment and characteriz-ation of a Madin-Darby canine kidney reporter cell line for influenza A virus assays[J]. J Clin Microbiol, 2010, 48(7): 2515-2523. |
| [25] | Janke R, Genzel Y, Händel N, et al. Metabolic adaptation of MDCK cells to different growth conditions: Effects on catalytic activities of central metabolic enzymes[J]. Biotechnology and Bioengineering, 2011, 108(11): 2691-2704. |
| [26] | Ritter JB, Wahl AS, Freund S, et al. Metabolic effects of influenza virus infection in cultured animal cells: Intra-and extracellular metabolite profiling[J]. BMC Systems Biology, 2010, 4(1): 61. |
| [27] | Petiot E, Jacob D, Lanthier S, et al. Metabolic and kinetic analyses of influenza production in perfusion HEK293 cell culture[J]. BMC Biotechnology, 2011, 11(1): 84. |
| [28] | Maranga L, Aunins JG, Zhou W. Characterization of changes in PER. C6 cellular metabolism during growth and propagation of a replication-deficient adenovirus vector[J]. Biotechnol Bioeng, 2005, 90(5): 645-655. |
| [29] | Ferreira TB, Ferreira AL, Carrondo MJT, et al. Effect of refeed strategies and non-ammoniagenic medium on adenovirus production at high cell densities[J]. Journal of Biotechnology, 2005, 119(3): 272-280. |




