随着世界人口的增加,对粮食需求的不断增长。为增加农作物的产量,避免病虫害造成的损失,各种农药的使用量也在逐渐增长。有机磷农药(Orga-nophosphorus pesticides,OPS)是一类非常重要的农药品种,全球已注册的500多种农药或农药代谢物中,有机磷农药占有很大的比例[1]。目前,世界上有机磷农药种类达150多种,我国生产的有机磷农药品种有20余种,年产量超过10万t,占我国农药总产量的80%以上[2]。虽然有机磷农药的大量使用提高了作物的产量,但由于有机磷农药的半衰期较长,大量的农药会残留在水体和土壤环境中造成严重污染[3, 4, 5]。水体、土壤及农产品中残留的有机磷农药已对人们的健康安全带来极大威胁[6, 7, 8]。乙酰胆碱(Acetylcholine,ACh)是一种神经递质,在神经信号传导过程中发挥着重要作用。有机磷农药能够抑制乙酰胆碱酯酶(Acetylcholinesterase,AChE)的活性从而使ACh不能降解而大量聚积进而对人体产生毒性[9, 10, 11]。有研究表明,长期暴露于低剂量有机磷环境下会造成机体多部位损伤,癌症、老年痴呆、帕金森氏综合症和糖尿病等疾病都与包括有机磷农药在内的环境污染物有关[12]。因此,消除环境中残留的有机磷农药一直是人们关注的焦点。
有机磷农药的降解方式主要可分为化学降解、物理降解和生物降解等[7, 13, 14]。生物降解是指通过生物的作用将农药分解成小分子无毒的或者低毒的化合物,并且最终降解为水、CO2和矿物质的过程。相对于物理、化学降解技术,生物降解特别是微生物降解具有高效、操作简单、成本低、彻底、无二次污染等诸多优点,目前对环境污染物的生物降解已经成为研究的热点[15, 16]。
微生物对有机磷农药的降解多是依靠酶促反应进行,而利用纯化酶对农药尤其是低浓度农药的降解效果远优于利用微生物本身,因为在农药浓度较低的情况下,降解菌会优先利用其他碳源而不能有效利用农药作为碳源,而降解酶的专一性高而且不存在碳源的选择问题,因此降解效果不受碳源影响,于是有机磷降解酶受到越来越多的关注[17]。到目前为止,国内外的学者们已经分离了多种能够降解有机磷的微生物,并且提取纯化了多种有机磷降解酶。1973 年,Sethunathan等[18]从水稻田土壤中分离到了第一株能够降解二嗪农和对硫磷的黄杆菌Flavobacterium sp. ATCC 27551。1982年,Serdar等[19]发现了能够降解对硫磷的菌株Pseudomonas diminuta MG。2001年,崔中利等[20]分离到了水解甲基对硫磷的菌株Plesiomonas sp. Stain M6,并克隆到了mpd基因。2002年,陈亚丽等[21]从农药污染土样中分离出的一株能彻底降解甲基对硫磷的菌株Pseudomonas sp. WBC-3。2003年,楚晓娜等[22]从有机磷农药降解菌Pseudomonas sp. WBC-3 中纯化了甲基对硫磷水解酶(Methyl parathion hydrolase,MPH)并对酶性质进行了分析。2003年,伍宁丰等[23]从农药厂被污染的土壤中分离到了一株产有机磷水解酶(Organophosphorus hydrolase,OPH)的菌株Pseudomonas pseudoalcaligenes C2-1并对其产生的有机磷降解酶OPHC2进行了分离和纯化。
目前已报道的有机磷降解菌中只含有一种有机磷降解酶基因,而本研究从一株有机磷农药降解菌施氏假单胞菌Pseudomonas stutzeri YC-YH1中同时克隆到两种有机磷降解酶基因mpd和ophc2。将两种基因分别连接到表达载体并转化大肠杆菌进行表达,研究了这两种降解酶各自的酶学特性及二者联合的酶学特性。
1 材料与方法 1.1 材料 1.1.1 主要试剂甲基对硫磷(Methyl parathion,纯度>99%)购自上海市农药研究所。对硝基苯酚(p-Nitrophenol)(分析纯)购自天津市凯通化学试剂有限公司。4×SDS凝胶上样缓冲液低分子量标准蛋白、限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶、IPTG、DNA片段纯化试剂盒购自宝生物工程(大连)有限公司(TaKaRa)。氨苄青霉素购自Amresco公司。细菌基因组提取试剂盒购自天根生化科技有限公司。LB培养基:胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,去离子水1 L,121℃灭菌20 min。上样缓冲液:Na2HPO4·12H2O 1.78 g,NaH2PO4·2H2O 1.38 g,NaCl 29.22 g,Imidazole 2.0 g,去离子水至1 L,pH7.4。洗脱缓冲液:Na2HPO4·12H2O 1.78 g,NaH2PO4·2H2O 1.38 g,NaCl 29.22 g,Imidazole 34.0 g,去离子水至1 L,pH7.4。
1.1.2 菌株及质粒本研究所用菌株为本实验室分离的有机磷降解菌施氏假单胞菌(Pseudomonas stutzeri)YC-YH1,在中国普通微生物菌种保藏管理中心的保藏号为CGMCC No. 9624。E.coli BL21(DE3)购自天根生化科技有限公司。质粒pET-32a购自Novagen公司。
1.1.3 仪器AKTA avant 蛋白纯化系统配Ni柱(HisTrapTM FF crude 1 mL),Tecan infinite 200 酶标仪,Bio-Rad(PowerPacTM HV Power Supply)蛋白质电泳仪,BRANSON超声波仪器(DIGITAL SONIFIER 250)。
1.2 方法 1.2.1 mpd和ophc2基因的克隆根据施氏假单胞菌Pseudomonas stutzeri YC-YH1全基因组测序结果,用Primer Premier 5.0设计引物(表 1),引物P1和P2 PCR扩增mpd基因,引物P3和P4 PCR扩增ophc2基因。以YC-YH1菌株基因组DNA为模板,扩增目的基因。PCR 扩增程序为:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min 20 s,进行30个循环;72℃延伸10 min;10℃保存。扩增产物用DNA片段纯化试剂盒纯化。
将纯化后的mpd和ophc2用BamHⅠ和SacⅠ酶切,同时酶切载体pET-32a,用DNA片段纯化试剂盒回收,用T4 DNA连接酶将酶切后mpd和ophc2分别与pET-32a质粒于16℃过夜连接,将连接产物转化E.coli BL21(DE3)感受态细胞,在含有100 mg/L氨苄青霉素的抗性平板上筛选阳性克隆,提取质粒进行验证。
1.2.3 mpd和ophc2基因的表达及蛋白纯化将已验证正确的E.coli BL21(pET-mpd)和E.coli BL21(pET-ophc2)分别取300 μL接种到30 mL液体LB培养基中,37℃下振荡培养12 h。将培养后的菌液取4 mL接种到400 mL液体LB培养基中,37℃,200 r/min振荡培养至菌液OD600达到0.8,加入IPTG至终浓度1 mmo/L,在30℃,200 r/min下振荡培养,诱导3 h。然后5 000 r/min离心8 min收集菌体,用30 mL上样缓冲液悬浮菌体后进行超声破碎。超声功率为20%,超声频率:超声3 s,暂停5 s,共超声破碎20 min。破碎完成后12 000 r/min离心10 min,收集上清液进行纯化。
用AKTA avant蛋白纯化系统对蛋白进行纯化,流速1 mL/min,上样26 mL,用洗脱缓冲液进行洗脱,从第4 mL开始收集,收集2 mL蛋白洗脱液。
1.2.4 纯化蛋白的检测使用SDS-PAGE对纯化的蛋白进行纯度测定。配制浓度为12%的分离胶,浓度为5%的浓缩胶,固定染色液为考马斯亮蓝R-250(含异丙醇25%,乙酸10%),脱色液含乙酸10%和乙醇5%。未诱导及诱导后的全细胞蛋白处理方法:l mL菌体细胞沉淀加入20 μL 4×SDS凝胶上样缓冲液及60 μL H2O,100℃加热10 min以充分裂解细胞,12 000 r/min离心10 min使细胞碎片及DNA等沉淀,取适量溶液上样。纯化的MPH和OPHC2分别取60 μL加入20 μL 4×SDS凝胶上样缓冲液混匀,取适量溶液上样。
1.2.5 酶的活性测定取1 μL甲醇配制的浓度为1×104 mg/L的甲基对硫磷母液,1 μL酶液,加入到98 μL Tris-HCl(50 mmol/L,pH9.0)中混匀,28℃反应2 min,然后用酶标仪检测溶液在405 nm下的吸光度值。
有机磷降解酶的一个活性单位(U)定义为:在28℃条件下,每分钟降解1 μmol甲基对硫磷所需酶量。在甲基对硫磷的降解过程中,甲基对硫磷的消耗量与其降解产物对硝基苯酚的生成量之间为11的关系,所以本研究通过检测产生的对硝基苯酚的量而得到甲基对硫磷被降解的量。
1.2.6 酶学性质的测定分别以纯化的MPH、OPHC2以及二者按11比例混合的混合酶为材料,在不同温度、pH及不同金属离子下检测酶对甲基对硫磷的降解效率,测定了其最适反应温度、最适pH及金属离子对酶活性的影响。
取4 μL甲醇配制的浓度为1×104 mg/L的甲基对硫磷母液,1 μL酶液,加入到995 μL Tris-HCl(50 mmol/ L,pH9.0)中混匀,在不同温度(20、30、40、50、60、70和80℃)下保温30 min,检测溶液在405 nm下的吸光度值;在不同pH(3、4、5、6、7、8、9、10、11和12)下进行酶促反应,测定了其最适pH,取0.5 μL酶液,1 μL甲醇配制的浓度为1×104 mg/L的甲基对硫磷母液,加入到98.5 μL Tris-HCl(50 mmol/ L,pH9.0)中混匀,28℃反应30 min后检测405 nm下的吸光度值;在酶促反应体系中分别加入不同金属离子及化学试剂,各种化合物的终浓度为1 mmol/L,28℃下反应30 min后检测405 nm下的吸光度值,以研究不同金属离子及化学试剂对酶反应的影响。
1.2.7 降解甲基对硫磷的动力学分析将不同浓度的甲基对硫磷(25、50、100、200和400 mg/L)作为底物,加入到50 mmol/L Tris-HCl(pH9.0)缓冲液体系中,在28℃下测酶反应速度,按双倒数作图法(Lineweaver-Burk法)求Km和Vm。
1.2.8 MPH和OPHC2的比较分析对几种常见的有机磷农药降解酶基因基因进行分析,用MEGA 5.2构建系统进化树;用Swiss-PdbViewer 4.1.0对MPH和OPHC2蛋白结构进行分析。
2 结果 2.1 目的基因的获得与重组质粒的验证以Pseudomonas stutzeri YC-YH1的基因组DNA为模板,扩增获得两个目的基因,其大小与基因组测序基因大小一致(图 1-A)。将扩增获得的mpd和ophc2基因片段纯化后,用BamHⅠ和SacⅠ双酶切,与载体pET-32a连接并转化E.coli BL21(DE3),在含有100 mg/L氨苄青霉素抗性平板上筛选转化子,提取质粒酶切验证,并分别以pET-mpd和pET-ophc2为模板进行PCR验证,与预测结果相符(图 1-B、图 1-C)。
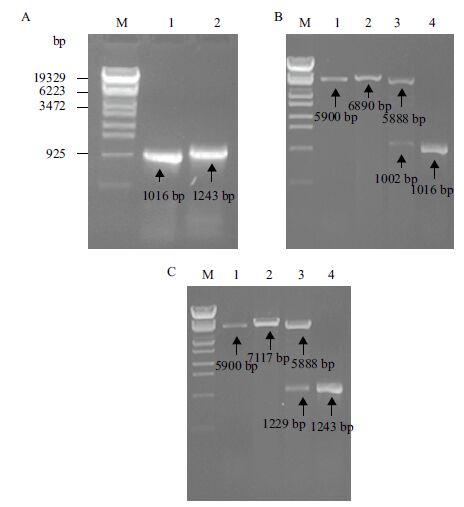
|
| (A)M:λ-EcoT14Ⅰdigest DNA Marker;1:mpd PCR产物;2:ophc2 PCR产物;(B)M:λ-EcoT14Ⅰdigest DNA Marker;1:pET-32a BamHⅠ酶切;2:pET-mpd BamHⅠ酶切;3:pET-mpd BamHⅠ和SacⅠ酶切;4:pET-mpd的PCR验证;(C)M:λ-EcoT14Ⅰdigest DNA Marker;1:pET-32a BamHⅠ酶切;2:pET-ophc2 BamHⅠ酶切;3:pET- ophc2 BamHⅠ和SacⅠ酶切;4:pET- ophc2的PCR验证 图 1 PCR扩增结果及重组质粒验证结果 |
将未进行诱导的全细胞蛋白、诱导后的全细胞蛋白及纯化后的MPH和OPHC2蛋白同时进行SDS-PAGE电泳,结果证明纯化后的酶为单一条带(图 2)。对纯化的酶进行蛋白定量,得到MPH浓度为1.012 mg/mL,OPHC2浓度为1.028 9 mg/mL。
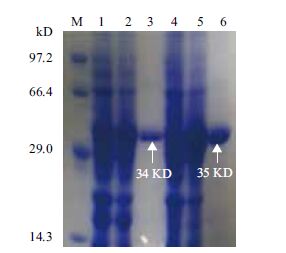
|
| M:蛋白Marker;1:对照全细胞蛋白;2:诱导全细胞蛋白;3:纯化后MPH;4:对照全细胞蛋白;5:诱导全细胞蛋白;6:纯化后OPHC2 图 2 MPH及OPHC2纯化过程SDS-PAGE图 |
温度对酶活力有重要影响,太高的温度会使得蛋白变性,从而使酶失活,太低的温度又会降低酶的活性,因此只有在最适温度下纯化酶才能发挥出最高活性。MPH酶在不同温度下具有不同的活性,MPH对甲基对硫磷的最适反应温度为40℃左右。温度低于40℃时,酶的活性随着温度的升高而逐步上升,但超过40℃酶活力迅速下降,到80℃时酶已经失活。结果表明此酶在室温下有较高的活性,但耐热能力较差,高温时降解能力明显较弱。OPHC2酶的最适反应温度为30℃左右。在20-30℃的温度范围内,酶的活力没有明显的变化,超过30℃以后,酶的活力开始下降,当超过40℃后,酶活力会急剧下降,在50℃时只有室温时的60%。混合酶的最适温度也在30℃左右,混合酶在室温时有较高的酶活,温度上升到50℃时,酶活力下降到60%,这与单一纯化酶相类似(图 3)。
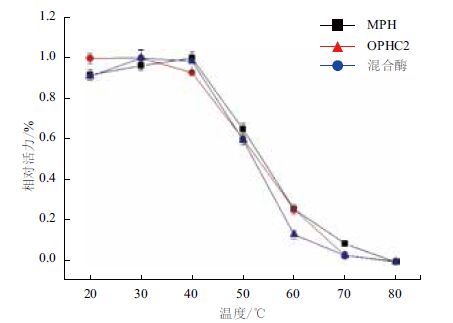
|
| 图 3 温度对酶反应的影响 |
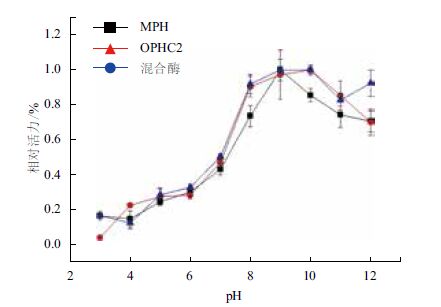
pH值能够对蛋白质的空间构象产生显著影响,过低或过高的pH值均能够降低酶的活性甚至使酶失活,不利于降解酶活性的发挥。降解酶通常只能在特定的pH值范围内具有活性。不同pH下酶活性测定结果表明,两种酶都是在碱性环境中酶的活性较高,同时都有很宽的pH酶解范围。MPH的最适反应pH为9,在pH8-12的范围内酶的相对活力均在70%以上,pH为7时酶活力只有40%左右。OPHC2酶的最适pH为10,在pH3-10范围内,随着pH值的增加,酶活一直呈增长状态,在pH为10时到达最高值。在pH8-12的范围内,OPHC2的酶活均在70%以上,而当pH为7时,酶活只有50%左右。混合酶活力较高的pH范围仍是8-12,pH8-10范围内酶活力在90%以上,pH为7时酶活力下降到50%(图 4)。
|
| 图 4 pH对酶反应的影响 |
以甲基对硫磷为底物,分别测定MPH、OPHC2及混合酶的动力学参数,利用双倒数作图法,求取K m和Vm值,结果见表 2。
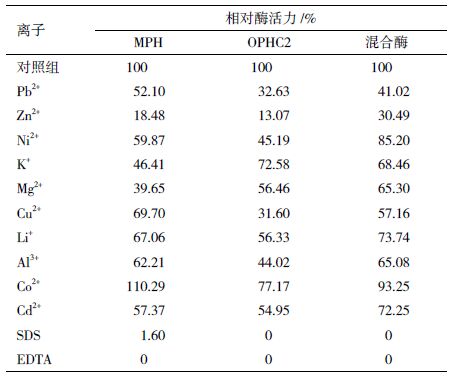
不同的金属离子和有机试剂会对酶组分产生不同的影响,从而促进或抑制酶的作用。由表 3可以看出,有机试剂SDS和EDTA对酶活的影响最大,是MPH和OPHC2的强变性剂。SDS是一种表面活性剂,它是两亲性分子,会使蛋白质变性,所以加入后酶会失活;EDTA是一种络合剂,可与金属离子形成络合物,MPH和OPHC2均金属酶,加入EDTA会与酶活性中心的金属离子螯合,从而降低了酶的活性。不同的金属离子会对酶的活性产生不同的影响。Co2+对MPH的活性有一定促进作用,但同时会对OPHC2的活性产生抑制作用。其他各种金属离子对MPH和OPHC2均表现出抑制作用,其中Zn2+的抑制作用最强。已有文献报道,MPH活性中心的金属离子为Zn2+,晶体状态时每个活性中心的一个Zn2+可被Cd2+取代。OPHC2的活性中心有Zn2+还可能有Co2+或者Fe2+。加入Zn2+可能使得Zn2+过量从而对酶的活性产生强烈抑制。混合酶活性相对稳定,受各种金属离子的影响较小,能够降低添加的金属离子对酶活力的抑制作用。
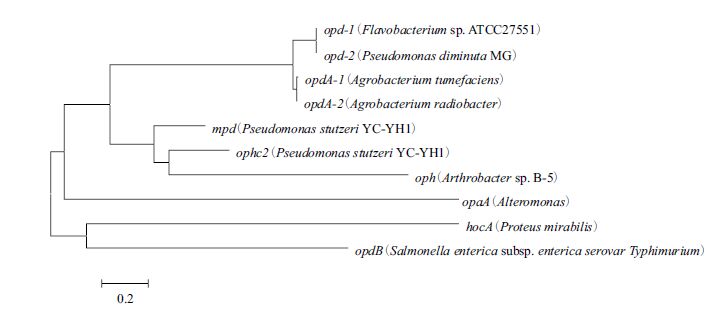
对常见的几种有机磷农药降解酶基因进行比较分析,用MEGA 5.2构建系统进化树(图 5)。可见mpd和ophc2相似性较高,亲缘关系较近。
|
| 图 5 几种常见有机磷降解酶基因的系统进化树 |
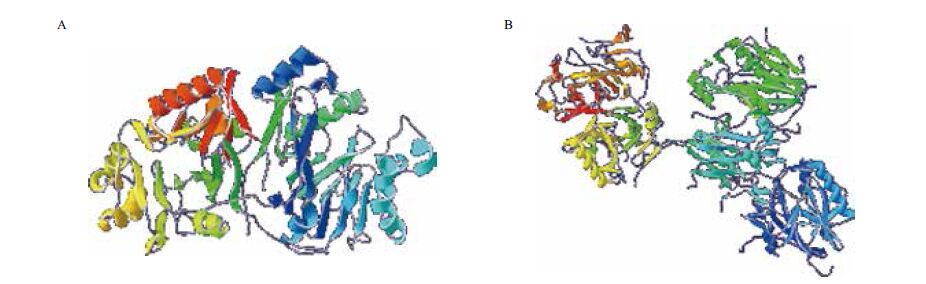
MPH与OPHC2都属于β-内酰胺酶,属于典型的β/α(TIM)折叠桶结构,活性位点均有两个金属离子,其催化机制也类似。MPH 的晶体结构为同源二聚体,包含A,B两条链;OPHC2的晶体结构有A、B、C、D和E 5条链,其中包括两个二聚体和一个单体(图 6)。MPH每个单体中含有45个氢键和8个盐桥。OPHC2单体的N端与另一单体相互作用,单体间相互作用强烈,有29个氢键和15个盐桥,涉及61个氨基酸残基。同时OPHC2的每个单体还有一个二硫键(Cys110-Cys146),可能使OPHC2有更好的热稳定性。
|
| A:MPH;B:OPHC2 图 6 MPH与OPHC2三维结构图 |
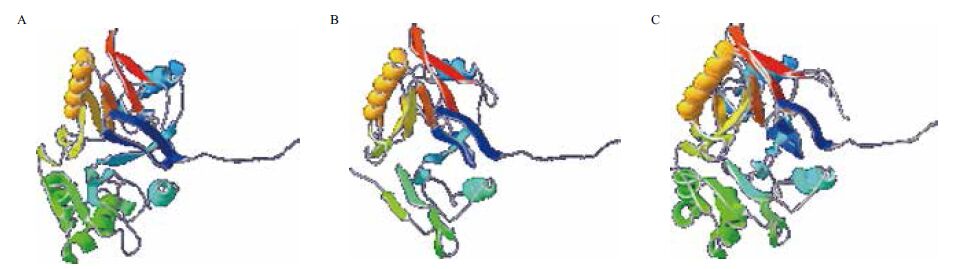
MPH每个单体通过 Asp151、His152、His302、His147、His149、His234和 Asp255与两个金属离子相连,一个H2O分子桥与两个金属离子相连,还有一个H2O分子只与一个金属离子配位。OPHC2单体中的两个金属离子α和β,His294、His144、Asp143、Asp247与α金属离子作用,His226、His139、His141 还有一个H2O分子与β离子作用。用Swiss-PdbViewer 4.1.0对MPH和OPHC2的单体进行分析(图 7),其三维结构相似性很高,与之前的报道一致。由图 7中可以看到,MPH的Gln173-Phe178,Gln182-Asp186,Phe196-Ala210形成3个α螺旋,Lys214-Phe216形成β折叠,此段区域在OPHC2中不存在,可能会对酶的性质有一定影响。
|
| A:MPH单体;B:OPHC2单体;C:MPH单体与OPHC2单体重叠比较 图 7 MPH与OPHC2单体三维结构比较 |
本研究将来源于施氏假单胞菌YC-YH1的mpd和ophc2基因克隆到大肠杆菌中,并成功进行了诱导表达,得到了有功能活性的蛋白,通过亲和层析的方法对蛋白进行纯化,得到了高纯度高浓度的目的蛋白,对单一纯化酶和混合酶的酶学性质进行了初步研究。
楚晓娜等[22]报道其纯化的的MPH在pH9-12范围内能够表现出较高的活力水平,最高活力的反应温度为40℃。在本研究中纯化的MPH的最适反应温度也为40℃,最适pH为9,在pH9-12范围酶活力同样较高。伍宁丰等对纯化的OPHC2进行酶学性质分析,其降解甲基对硫磷的最适温度为65℃,最适pH为9[24],本研究中纯化的OPHC2最适反应温度为30℃,更加接近自然环境温度,最适pH为10,在pH8-12范围内酶活一直较高,具有较好的pH适应性。MPH和OPHC2组成的混合酶在30-40℃范围内具有很高的酶活性,在pH9-10范围内其活力仍保持在最高水平。可以看出混合酶能够更好地适应小范围内温度和pH的变化,使酶活力保持在最高水平。不同金属离子及化学试剂对两种酶的的活性都有一定影响,很多金属离子都会降低酶的活性,SDS和EDTA会使酶完全失活。比较二者对底物甲基对硫磷的降解效率发现,MPH对甲基对硫磷的亲和力高于OPHC2,而OPHC2对甲基对硫磷的降解最大速率高于MPH。混合酶对甲基对硫磷亲和力虽然降低,但最大反应速率明显升高。
MPH与OPHC2酶性质相似,OPHC2的结构表明其更强的热稳定性[25]。通过对酶性质的研究,可以根据其特点定向对酶进行改造,提高降解效率和稳定性。酶工程正在迅速发展,也逐渐应用到人们的生活中。利用酶的进化和改造,使其应用到解决农药污染和环境防治中具有十分重要的意义。
4 结论株有机磷降解菌施氏假单胞菌 Pseudomonas stetzeri YC-YH1中产生的两种降解酶MPH和OPHC2性质相似,共同作用时混合酶比单一的降解酶具有更好的温度和pH适应性,对金属离子和有机试剂的抑制作用也具有较强的抗性,同时最高反应速率也显著增大。
| [1] | Wu L, Yao J, Polonca T, et al. Compound specific isotope analysis of organophosphorus pesticides[J]. Chemosphere, 2014, 111:458-463. |
| [2] | 刘建利. 有机磷农药降解酶的研究进展[J]. 广东农业科学, 2010(1):60-64. |
| [3] | Ahire KC, Kapadnis BP, Kulkarni GJ, et al. Biodegradation of tributyl phosphate by novel bacteria isolated from enrichment cultures[J]. Biodegradation, 2012, 23(1):165-176. |
| [4] | Rovedatti MG, Castané PM, Topalián ML, et al. Monitoring of organochlorine and organophosphorus pesticides in the water of the Reconquista River(Buenos Aires, Argentina)[J]. Water Res, 2001, 35(14):3457-3461. |
| [5] | 谷月, 姜华. 农药污染土壤的微生物降解[J]. 辽宁农业科学, 2013(4):52-55. |
| [6] | Xie J, Zhao Y, Zhang H, et al. Improving methyl parathion hydrolase to enhance its chlorpyrifos-hydrolysing efficiency[J]. Lett Appl Microbiol, 2014, 58(1):53-59. |
| [7] | 王燕, 刘建峰, 刘振华, 等. 环境中有机磷农药微生物降解技术的研究进展[J]. 安徽农业科学, 2013, 41(16):7163-7164. |
| [8] | Fu G, Cui Z, Huang T, et al. Expression, purification, and characterization of a novel methyl parathion hydrolase[J]. Protein Expression and Purification, 2004, 36(2):170-176. |
| [9] | Zhao X, Kong W, Wei J, et al. Gas chromatography with flame photometric detection of 31 organophosphorus pesticide residues in Alpinia oxyphylla dried fruits[J]. Food Chemistry, 2014, 162:270-276. |
| [10] | 张呈祥, 侯明, 鲍海咏, 等. 急性有机磷农药中毒的相关进展[J]. 青海师范大学学报:自然科学版, 2012, 28(1):54-61. |
| [11] | 赵敏, 陈良宏, 张志刚, 等. 有机磷农药中毒机制和治疗新进展[J]. 中国实用内科杂志, 2014, 34(11):1064-1068. |
| [12] | 张宇童, 杨兆娜, 谢飞, 等. 有机磷农药神经发育毒性作用机制研究进展[J]. 安徽农业科学, 2014, 42(12):3561-3564. |
| [13] | 李松桧, 李日强. 有机磷农药生物降解的研究进展[J]. 科技情报开发与经济, 2008(2):123-124. |
| [14] | 金潇, 颜冬云, 秦文秀. 有机磷农药的微生物降解技术[J]. 湖南农业科学, 2011(9):93-97. |
| [15] | 刘建利. 利用微生物降解农药污染[J]. 生物学教学, 2010, 35(4):5-9. |
| [16] | 龙致科, 胡永志, 王韧, 等, 农药降解酶在果蔬清洗剂中的应用探讨[J]. 中国洗涤用品工业, 2014(2):78-80. |
| [17] | 王晓辉, 杜利平, 赵丽霞. 有机磷农药生物降解研究进展[J]. 河北工业科技, 2008, 25(6):405-409. |
| [18] | 汤鸣强. 三唑磷降解菌的分离鉴定及其降解酶特性的研究[D]. 福州:福建农林大学, 2012. |
| [19] | Serdar CM, Gibson DT, Munnecke DM, et al. Plasmid involvement in parathion hydrolysis by Pseudomonas diminuta[J]. Applied and Environmental Microbiology, 1982, 44(1):246-249. |
| [20] | Cui Z, Li S, Fu G, et al. Isolation of methyl parathion-degrading strain M6 and cloning of the methyl parathion hydrolase gene[J]. Applied and Environmental Microbiology, 2001, 67(10):4922-4925. |
| [21] | 陈亚丽, 张先恩, 刘虹, 等. 甲基对硫磷降解菌假单胞菌WBC-3的筛选及其降解性能的研究[J]. 微生物学报, 2002, 42(4):490-497. |
| [22] | 楚晓娜, 张先恩, 陈亚丽, 等. 假单胞菌WBC-3甲基对硫磷水解酶性质的初步研究[J]. 微生物学报, 2003, 43(4):453-459. |
| [23] | 伍宁丰, 邓敏捷, 史秀云, 等. 一种新的有机磷降解酶的分离纯化及酶学性质研究[J]. 科学通报, 2003, 48(23):2446-2450. |
| [24] | Su Y, Tian J, Wang P, et al. Improving the thermostability of a methyl parathion hydrolase by adding the ionic bond on protein surface[J]. Appl Biochem Biotechnol, 2011, 165:989-997. |
| [25] | Gotthard G, Hiblot J, Gonzalez D, et al. Structural and enzymatic characterization of the phosphotrieterase OPHC2 from Pseudomonas pseudoalcaligenes[J]. PLoS One, 2013, 8(11):e77995. doi:10. 1371/journal. pone. 0077995. |