大菱鲆(Scophthalmus maximus L.)是一种名贵的海洋经济鱼类,原产于英国。中国水产科学研究院黄海水产研究所的雷霁霖院士于1992年8月首次将其引入我国,并经过一系列关键养殖技术研究取得成功,很快在我国北方沿海地区形成了大规模的工厂集约化养殖生产[1]。近年来,随着养殖量的迅速增大,尤其是集约化的高密度养殖生产,导致大菱鲆疾病相继出现,特别是由某种病原微生物引起的感染病(Infectious diseases)时有发生,并常常会导致较大的经济损失[2]。
作者在对养殖鱼类感染病的病原研究中,从养殖大菱鲆患病死亡及濒死鱼中经常分离到病原细菌,其中尤以鳗弧菌(Vibrio anguillarum Bergeman 1909)的分离频率较高,且分离菌株均具有较强的致病作用,能引起不同日龄大菱鲆发生败血性感染病。本研究对从自然发生的大菱鲆鳗弧菌感染病(死)鱼苗分离的鳗弧菌菌株,进行了比较系统的检验与分析,旨为对由鳗弧菌引起的大菱鲆弧菌病(Vibriosis)的有效预防与控制。
1 材料与方法 1.1 材料2012年5月,河北某水产养殖场的大菱鲆鱼苗大量死亡。主要表现为体表弥漫性出血,有的病鱼腹部臌胀、腹内积液(充盈淡红色腹水),肝脏苍白易碎。在5月13日的发病死亡高峰期,取发病后刚刚死亡大菱鲆鱼苗进行病变特征检验后,分别以其肝脏组织及腹水为材料,接种于普通营养琼脂、血液(含7%家兔血液)营养琼脂培养基,置28℃培养24-48 h;对分离菌做纯培养并统一编号后,进行检验与分析。
1.2 方法 1.2.1 分离菌株的表观分类学指征检验对分离保存的纯培养菌株,分别进行形态特征、培养特征、生理生化特性等这些表观分类学指征的系统检验。生理生化特性检验,采用法国BioméRieux细菌自动鉴定仪(ATB1525-expression),并对一些项目内容进行补充试验[3]。
1.2.2 分离菌株的16S rRNA基因序列测定与系统发育学分析择经表观分类学指征检验后的代表菌株,进行16S rRNA基因序列测定与系统发育学分析。方法是将供试菌株接种于LB肉汤培养基中,28℃(110 r/min)振荡培养16 h作为供试菌液,采用北京赛百盛基因技术有限公司生产的树脂型TM基因组DNA提取试剂盒,参照相应的方法提取细菌DNA作为PCR模板。
以弧菌检验的通用引物,即对应于大肠埃希氏菌(Escherichia coli)16S rRNA基因第8-27个碱基位置的5'-AGAGTTTGATC(C/A)TGGCTCAG-3'为正向引物、对应于大肠埃希氏菌16S rRNA基因第1492-1510 个碱基位置的5'-TACGG(C/T)TACCTTGTTACGACTT -3'为反向引物(1492R),按常规方法对供试菌株进行16S rRNA基因序列的PCR扩增[4];即在50 μL反应体系中含有2×PCRmix缓冲液25 μL、引物各1 μL、DNA模板 4 μL、无菌蒸馏水19 μL,PCR反应条件为:95℃预变性3 min;94℃变性1 min,55℃复性1 min,72℃延伸2 min,30个循环;72℃温育6 min。所扩增的PCR产物经纯化后,提交上海生工生物工程股份有限公司进行基因序列测定。
对所测定的基因序列,通过NCBI的BLAST检索系统进行序列同源性分析,使用DNASTAR软件与GenBank数据库存中获得的相似性较高的基因序列进行多序列匹配排列(Multiple Alignment),采用邻接法(Neighbor joining method)构建分支系统树。
1.2.3 免疫血清学检定以用已知大菱鲆病原鳗弧菌制备的全菌体抗原,经多次免疫家兔制备的相应抗血清,分别对供试菌株做玻片凝集反应,进行血清型的定性实验,以呈现明显凝集(++)判定为阳性。同时,分别以大菱鲆病原迟钝爱德华氏菌(Edwardsiella tarda)、正常健康家兔血清、无菌生理盐水,作为阴性实验对照[4]。
1.2.4 菌株分类位置确定根据细菌形态特征、理化特性等表观分类学指征的检验结果,主要参照第2版《伯杰氏系统细菌学手册》(Bergey’s Manual of Systematic Bacteriology)及有关资料,并结合16S rRNA基因序列与系统发育学、免疫血清学的测定结果,对供试菌株进行分类学的归类判定 [3, 5]。
1.2.5 人工感染实验择经分类鉴定后的代表菌株,以其纯培养物分别移接普通营养肉汤培养基,经28℃培养18 h作为供试菌液。分别对体重200-250 g/尾的健康大菱鲆,进行腹腔注射接种的感染实验(0.1 mL/尾),以被感染发病、死亡,呈现出同自然病(死)大菱鲆的发病和病变特征、并能从病变组织中重新分离回收到原感染菌,作为致病作用的判定指标;同时设立仅接种无菌普通营养肉汤的实验对照,须在实验观察期内健康存活。供试大菱鲆在实验前统一养殖于水温19-21℃的实验水族箱中,养殖观察7 d且健康才可用于实验。
2 结果 2.1 菌株与编号取发病后刚刚死亡大菱鲆鱼苗10尾进行细菌分离,从其肝脏组织及腹水中,均分离到了多量且纯一的同种细菌。从每尾大菱鲆鱼苗的分离菌,各取1个菌落移接于普通营养琼脂斜面培养基,置28℃培养24 h作为纯培养菌,于4℃普通冰箱保藏供实验用。菌株编号系按分离地与日期,依次为HC120513-1至HC120513-10。
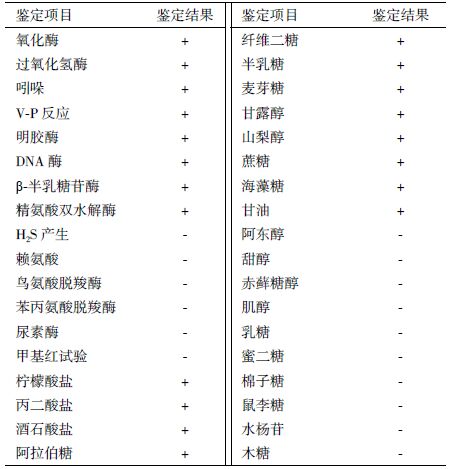
2.2 形态与培养特征 2.2.1 形态特征取保藏的10株纯培养菌,分别移接于普通营养琼脂斜面培养基,置28℃培养24 h后做涂片标本进行革兰氏染色检查,均为革兰氏染色阴性、杆状及短杆状(多数菌体稍弯曲)、一端或两端钝圆(有的一端或两端稍尖)、散在(个别成双)、无芽孢、大小多在0.3-0.7 μm×1.0-2.2 μm。进行负染色的透射电子显微镜标本观察发现,菌体弯曲、表面光滑,但不平整、有微泡(Micorovesicale)、端生单鞭毛(图 1)。
|
| 图 1 鳗弧菌透射电子显微镜照片(×4 000) |
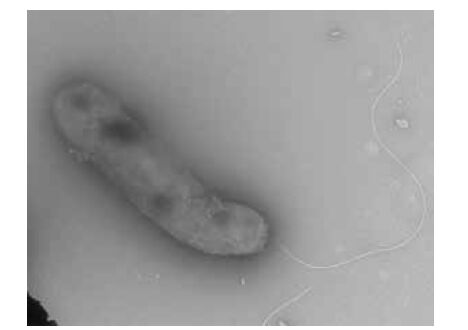
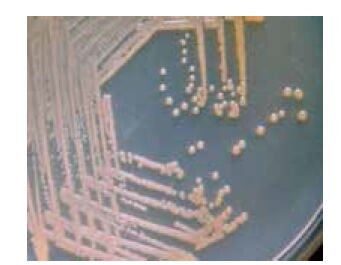
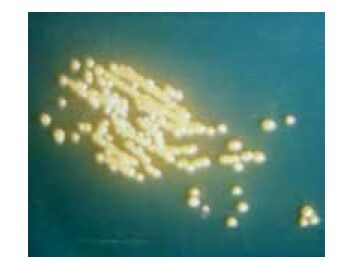
取保藏的10株纯培养菌,分别移接于普通营养琼脂、血液(含7%家兔血液)营养琼脂、硫代硫酸钠柠檬酸钠胆酸钠蔗糖琼脂(Thiosulfate citrate bile salt sucrose agar,TCBS)培养基,置28℃培养24-48 h培养后检查生长情况及菌落特征。结果在普通营养琼脂、血液(含7%家兔血液)营养琼脂培养基上,与用此两种培养基从病死大菱鲆鱼苗所分离的一致,表现为在普通营养琼脂培养基上,培养24 h检查菌落呈圆型光滑、边缘整齐、较隆起、浅橘黄色、不透明、直径多在0.8-1.0 mm(培养48 h的多在1.5-1.8 mm),生长较丰盛(图 2);在血液(含7%家兔血液)营养琼脂培养基上,生长情况与菌落特征基本同在普通营养琼脂上的,培养24 h的菌落直径多在1.0-1.2 mm(培养48 h的多在1.5-2.0 mm),β-溶血(图 3);在TCBS培养基上,培养24 h检查不见明显生长或仅形成直径多在0.3 mm左右的小菌落(培养48 h的可达1.2-1.5 mm),菌落圆形光滑、边缘整齐、较隆起、黄色,常表现是仅在做划线接种的起始部长出菌苔及少数菌落,菌落(苔)黏稠不易乳化,菌落周围培养基常表现轻微下陷(菌落长入培养基中),刮下菌落后可见长入培养基中留下的菌落痕迹(图 4)。
|
| 图 2 鳗弧菌在营养琼脂培养基中28℃培养48 h的菌落形态 |

|
| 图 3 鳗弧菌在血液营养琼脂培养基中28℃培养48 h的菌落形态 |
|
| 图 4 鳗弧菌在TCBS培养基上28℃培养48 h的菌落形态 |
取保藏的10株纯培养菌,分别移接于普通营养琼脂斜面培养基,置37℃培养24-48 h检查,表现在37℃培养呈微弱生长,但比在28℃培养的表现生长缓慢。
2.3 理化特性供试10株纯培养菌,对所测项目的结果表现一致。均可还原硝酸盐,对O/129敏感,剩余项目如表 1所示。
择经表观分类学指征检验后的HC120513-1作为代表菌株,进行的16S rRNA基因序列测定与系统发育学分析,结果得到了长度为1 450 bp的基因序列。将此菌株的16S rRNA序列在NCBI上进行同源性检索发现,其与弧菌属(Vibrio Pacini 1854)细菌的16S rRNA基因序列自然聚类;在检索出的弧菌属细菌序列中,此菌株与它们的同源性都在99%。选取20株弧菌属细菌的16S rRNA基因序列进行系统发育学分析,此菌株与编号为KC884632的鳗弧菌聚为一个分支(图 2)。
2.5 血清学凝集实验以10株纯培养菌的普通营养琼脂培养基、28℃培养24 h的培养物为全菌体抗原,进行的血清学凝集反应实验,结果均与供试鳗弧菌全菌体抗血清呈现强阳性反应(++++),与正常健康家兔血清、无菌生理盐水均为阴性。对照用的迟钝爱德华氏菌,与供试鳗弧菌全菌体抗血清、正常健康家兔血清、无菌生理盐水均为阴性(图 5)。

|
| 图 5 实验菌株与对照菌株的玻片凝集实验 |
根据对10株供试菌表观分类学指征的检验、16S rRNA基因序列与系统发育学分析、免疫血清学凝集反应检定结果,综合分析判定为弧菌属的鳗弧菌。参考菌株:HC120513-1。
2.7 致病作用将16尾供试大菱鲆,分为每组8尾的两组隔离养殖于两个实验用水族箱中;其中的1组接种供试菌株HC120513-1的菌液为感染实验组,另外1组接种普通营养肉汤为实验对照组,分别养殖观察。结果如表 2所示,实验组的8尾于接种感染后48 h内均表现发病且死亡6尾(死亡率75.0%);对照组8尾,养殖观察7 d仍正常存活。

|
| 图 6 鳗弧菌16S rRNA基因序列系统发生树 |
死亡6尾大菱鲆,均呈现出了同自然发病的出血、腹水等病变。取其肝脏组织及腹水为材料,接种于普通营养琼脂、血液(含7%家兔血液)营养琼脂培养基,置28℃培养48 h,均分离到了大量纯一的同种细菌;经做纯培养后进行的主要理化特性检验,表明为原感染用的鳗弧菌。
3 讨论从发生大量死亡的养殖大菱鲆鱼苗中分离的10株细菌,通过普通细菌学方法检测为革兰氏阴性菌,杆状及短杆状(多数菌体稍弯曲),端生单鞭毛,氧化酶反应呈阳性,能够还原硝酸盐,对弧菌抑制剂O/129敏感等,这些都符合弧菌属的典型特征。这10株细菌还能够利用柠檬酸盐、丙二酸盐和酒石酸盐;分解阿拉伯糖、纤维二糖、半乳糖、麦芽糖、甘露醇、山梨醇、蔗糖、海藻糖和甘油产酸,不分解阿东醇、甜醇、赤藓糖醇、肌醇、乳糖、蜜二糖、棉子糖、鼠李糖、水杨苷和木糖;过氧化氢酶、吲哚产生、V-P反应、明胶酶、DNA酶、β-半乳糖苷酶和精氨酸双水解酶阳性;H2S产生、赖氨酸及鸟氨酸脱羧酶、苯丙氨酸脱氨酶、尿素酶、甲基红试验阴性;这是一些主要具有鉴别意义的项目,能够在弧菌属中有效区分鳗弧菌。由此,从生理生化鉴定看,实验菌株接近于鳗弧菌。
后续对10株细菌进行了DNA的提取,扩增了通用片段16S rRNA,并建立了系统进化树,结果表明菌株与鳗弧菌KC884632聚为一支,相似度最高达到99.9%,而与霍乱弧菌X74696遗传距离较远一些,相似度只能达到93.9%,偏低。所以,从系统发育学和序列相似度上来看,实验用菌株与鳗弧菌较近一些。
随后分别又对回归感染试验分离出的细菌和原分离于病死成年大菱鲆病原鳗弧菌为抗原制备抗血清,能够发生强凝集反应,这不仅对鳗弧菌的检验具有重要意义[6],也初步显示了在这些不同来源菌株间的血清型同源性;人工感染大菱鲆的实验结果,显示具有强致病作用。进一步说明尽管鳗弧菌虽属于水环境微生物区系正常菌群的一种弧菌,但更是海水养殖鱼类的一种常见的重要病原菌。据此,可考虑将此菌列为养殖用海水清洁度及弧菌病暴发的监测菌。
已有的研究报告显示,在水温以及盐度和有机物含量较高的养殖环境,鳗弧菌的数量急剧增加;养殖密度的增大、养殖水体中溶氧量的降低、养殖水温的骤变等因素,可使鱼类处于应激状态并导致免疫机能下降,更容易引起鳗弧菌的感染[7]。显然,在诸多养殖技术难以规范的实际情况下,应用鳗弧菌疫苗进行免疫接种的方法,可能会构成最为有效的途径之一;但要做到这一点,对病原鳗弧菌的广泛分离与检验是一个重要方面的内容,其中尤以血清学检验确定血清型别是最为需要的。但作为免疫原性来讲,还需要明确在抗原表达、免疫保护效果方面的应用价值。对这些方面的内容,我们还在进一步的研究中;也期望能为鱼类免疫预防的实践应用,提供具有可行性的基础资料。
4 结论本次报告分离于大菱鲆鱼苗的10株病原细菌,经过一系列形态特征和菌落特征观察、生理生化鉴定、16S r RNA系统学发育分析鉴定是鳗弧菌,并对大菱鲆进行了回归感染试验,最终可得出这10株病原菌确实是导致大菱鲆致病的鳗弧菌。
| [1] | 雷霁霖. 大菱鲆养殖技术[M]. 上海:上海科学技术出版社, 2003:1-7. |
| [2] | 雷霁霖, 马爱军, 陈超, 等. 大菱鲆&Scophthalmus maximus(L.)养殖现状与可持续发展[J]. 中国工程科学, 2005, 7(5):30-34. |
| [3] | 杨正时, 房海. 人及动物病原细菌学[M]. 石家庄:河北科学技术出版社, 2003:1523-1643. |
| [4] | Martin F, Pol Z, Collen M Cavanaugh. Bias in template-to-product ratios in multitemplate PCR[J]. Appl Environ Microbiol, 1998, 64(10):3724-3730. |
| [5] | Garrity GM. Bergey’s Manual of Systematic Bacteriology. Second Edition[J]. Volume 2. Part B. Springer, New York, 2005:494-546. |
| [6] | 邹玉霞, 张培军, 莫照兰, 等. 大菱鲆出血症病原菌的分离和鉴定[J]. 高技术通讯, 2004, 14(4):89-93. |
| [7] | Villamil L, Figueras A, Novoa B. Immunomodulatory effects of nisin in turbot(Scophthalmus maximus L. )[J]. Fish&Shellfish Immunology, 2003, 14:157-169. |