2.中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193
2. The National Key Laboratory of Plant Diseases and Insect Pests,Beijing 100193
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)对多种鳞翅目、鞘翅目害虫具有杀虫活性,由于杀虫谱窄无污染等特点,是目前世界上应用最广泛的微生物杀虫剂。另外,在转基因作物中Bt基因也得到了广泛的应用。2014年,全球转基因作物种植面积达到1.815亿hm2,其中,转Bt基因作物种植面积为7 000万hm2[1]。随着转基因农作物的迅猛发展,转基因作物的安全性评价备受关注,其中最受关注的还是食用安全性问题。Cry蛋白只有在靶标害虫的碱性消化道内与其中肠上皮细胞的特异蛋白受体结合才能起到杀虫作用[2],而其他非靶标生物体内都被证明没有这种特异性蛋白质受体[3]。即使非靶标生物进食了上千或上万倍的对靶标昆虫产生急性毒性反应的剂量时,也不会产生任何不良反应[4]。在典型食物蛋白加工的过程中,经常会加热到95-100℃,尽管这样的高温并不会改变蛋白作为膳食氨基酸来源的营养价值,但是可导致不可逆转的变性并使蛋白质功能丧失[5]。美国孟山都公司对Cry1Ac蛋白进行了消化稳定性实验,他们指出,Cry1Ac蛋白核心片段(57.8 kD)在模拟胃肠也中极其不稳定,并且该蛋白不会以完整或小肽的形式进入单胃哺乳动物小肠[6]。另外,Xu等[7]在对Cry1Ab/Ac融合蛋白进行模拟胃肠液消化和小鼠饲喂后,也证明了其作为人类食物和动物饲料的安全性。
cry1Ie基因是由本实验室发现并克隆的具有自主知识产权的模式基因[8],其编码蛋白只有81 kD[9],不同于大多数Cryl类蛋白的130 kD。该基因的另一个特点是在Bt菌株中多数是沉默的,而在大肠杆菌中却能过表达[10]。Cry1Ie蛋白对小菜蛾(Plutella xylostella)、亚洲玉米螟(Ostrinia furnacalis)及大豆食心虫(Leguminivora glycinivorella)均有很强杀虫活性[11],并且该蛋白与商业化种植Bt作物中的Cry1Ab和Cry1Ac蛋白无交互抗性,具有巨大的应用价值[12]。中国农业科学院植物保护研究所与中国农业科学院作物科学研究所合作,将cry1Ie基因应用于抗虫玉米的培育[13, 14],目前已经进入生产性试验阶段。除了对亚洲玉米螟有显著的防治效果,对Cry1Ac抗性棉铃虫品系也具有杀虫活性[15]。
针对具有巨大应用价值和商业化前景的Cry1Ie蛋白,本研究在大肠杆菌表达系统中将其进行表达、提取和纯化。对Cry1Ie蛋白进行热稳定性和消化稳定性评价,并且分析处理后该蛋白对亚洲玉米螟的杀虫活性。
1 材料与方法 1.1 材料 1.1.1 菌种与质粒克隆载体、细菌表达载体pET-21 b,感受态细胞DH5α、Rossetta菌株由本实验室提供。
1.1.2 试剂各种抗生素均购自美国Amresco公司;常规化学试剂均购自国药集团化学试剂有限公司。酪蛋白(α-casein)、大豆胰蛋白酶抑制剂(Soybean trypsin inhibitor,STI)、胃蛋白酶(Pepsin)、胰蛋白酶(Trypsin),均购自Solarbio公司;亚洲玉米螟(Ostrinia furnacalis)、人工饲料由中国农业学院植物保护研究所玉米害虫组提供。
1.1.3 模拟胃消化液(Simulated gastric fluid,SGF)本标准中采用的胃蛋白酶(Pepsin)活力≥3 000 U/mg。
根据公式(1)计算100 mL模拟胃液中的胃蛋白酶的添加量:

称取0.2 g氯化钠(NaCl)和A mg胃蛋白酶,加入70 mL重蒸馏水,加入730 μL盐酸,再用盐酸调pH至1.2,加水定容至100 mL。现用现配。
1.1.4 模拟肠消化液(Simulated gastric fluid,SIF)称取0.7 g磷酸二氢钾(KH2PO4)溶于25 mL重蒸馏水中,振荡使之完全溶解,加入19 mL 0.2 mol/L氢氧化钠溶液和40 mL重蒸馏水,加入1.0 g胰蛋白酶,用0.2 mol/L 氢氧化钠溶液调pH至7.5,加重蒸馏水定容至100 mL。现用现配。
样品蛋白溶液(2 g/L):称取2 mg样品蛋白,定容于1 mL重蒸馏水中,混匀。
1.1.5 玉米粉提取液将非转基因玉米粉在液氮中磨成细粉,称取0.1 g,加入1 mL重蒸水,混匀后13 500×g、4℃离心5 min,取上清。
1.2 方法 1.2.1 蛋白表达与表达条件的优化挑取阳性克隆接种于含有氨苄青霉素和氯霉素的5 mL LB液体培养基中,37℃、220 r/min培养6 h,以1%的比例接种于300 mL的LB液体培养基中,37℃、220 r/min进行培养。当OD600值达到0.5左右时,加入0.1 mmol/L IPTG,在18℃、150 r/min条件下诱导12 h。8 000 r/min离心10 min收集菌体。将菌体再次悬浮于30 mL的缓冲液20 mmol/L Tris-HCl(pH8.0)中,利用超声波破碎菌体(宁波新芝SCIENTZ II-D),功率45%,工作3 s,暂停5 s,共超声破碎5 min。10 000 r/min 离心20 min,分别收集上清和沉淀,然后通过SDS-PAGE电泳检测目标蛋白。在此基础上,挑取部分阳性菌株,通过改变IPTG的浓度(0.1、0.5、1和1.0 mmol/L)以及诱导表达的温度(18和30℃),寻找最佳的目标蛋白表达条件。
1.2.2 目的蛋白的纯化准备5 mL的镍柱,首先用无菌水清洗Ni-NTA柱(5倍柱体积),然后用上样缓冲液I(50 mmol/L Na2CO3,pH 10.5,含50 mmol/L 咪唑、0.5 mol/L NaCl)进行平衡(5倍柱体积)。加入10 mL的蛋白,反复上样4次。用上样缓冲液I洗脱未结合的蛋白(5倍柱体积)。用同样体积的含有250 mmol/L咪唑的缓冲液(50 mmol/L Na2CO3,pH10.5,含有0.5 mol/L NaCl)洗脱目的蛋白。用500 mmol/L咪唑的缓冲液(50 mmol/L Na2CO3,pH 10.5,含有0.5 mol/L NaCl)清洗残余的蛋白,SDS-PAGE检测纯化效果。
1.2.3 模拟胃液稳定性测定向无菌1.5 mL离心管中加入18 μL模拟胃消化液,37℃恒温水浴5 min。分别加入2 μL样品蛋白(5 mg/mL)、模拟胃液空白对照、不稳定对照蛋白(5 mg/mL酪蛋白)、稳定对照蛋白(5 mg/mL大豆胰蛋白酶抑制剂),迅速漩涡振荡并快速置于37℃水浴,在每个反应时间点,迅速加入10 μL 1.5 mol/L 碳酸钠溶液,冰浴,加入7.5 μL 5×SDS-PAGE蛋白样品上样缓冲液,沸水浴加热5 min,取出后13 500×g离心5 min,冷却至室温进行SDS-PAGE检测。蛋白反应时间依次为0和15 s,1、2、5、10、30 和60 min。不稳定对照酪蛋白反应时间为2 min,稳定对照STI 反应时间为1 h。胃蛋白酶对照组为不含胃蛋白酶的模拟胃液,其他步骤同上。
1.2.4 模拟肠液稳定性测定在已灭菌的1.5 mL离心管中加入 18 μL模拟肠消化液(SIF)溶液,37℃恒温水浴5 min。分别加入2 μL样品蛋白(2 mg/mL)、模拟肠液空白对照、不稳定对照蛋白(2 mg/mL酪蛋白)、稳定对照蛋白(2 mg/mL大豆胰蛋白酶抑制剂),漩涡振荡后快速置于37℃水浴中,在每个反应时间点立即加入5 μL 5×SDS-PAGE蛋白样品上样缓冲液,沸水浴加热5 min,取出后13 500×g离心5 min,冷却至室温进行SDS-PAGE检测。反应时间点依次为0和15 s、1、2、5、10、30和60 min。不稳定对照酪蛋白反应时间为2 min,稳定对照STI 反应时间为1 h。胰蛋白酶对照组为不含胰蛋白酶的模拟肠液,其他步骤同上。
1.2.5 热稳定性测定将目的蛋白干粉分别用超纯水和玉米粉提取液中溶解后在沸水浴中加热,在反应时间点取出20 μL,立即加入5 μL 5×SDS-PAGE蛋白样品上样缓冲液,沸水浴加热5 min,取出后13 500×g离心5 min,冷却至室温进行SDS-PAGE检测。反应时间依次为15 s、1、2、5、10、30和60 min。
1.2.6 亚洲玉米螟生物活性测定亚洲玉米螟选用初孵幼虫,称取30 g人工饲料置于灭菌培养皿中,加入3 000 μL待测样品溶液,用药匙充分搅拌均匀,室温放置,使饲料多余水分蒸发。将全部饲料分装于3个一次性培养皿中(直径=5 cm)。用毛笔轻轻接入幼虫,每培养皿接30头虫,每个处理重复3次,接虫后以2层卫生纸严格密封,防止幼虫逃逸。放置25℃光照培养箱中培养。每日监测培养箱中温度与湿度,湿度<30%时,及时添加蒸馏水以保持湿度。每天观察,检查光照、湿度、温度以及饲料是否霉变,是否有水蒸气凝结。7 d分别调查死、活虫数,计算死亡率、校正死亡率。实验样品分别为模拟胃液37℃消化15 s、模拟肠液37℃消化1 h、超纯水中100℃放置1 h、玉米叶片提取液中100℃放置30 min。对照组分别为Cry1Ie原蛋白阳性对照2 μg/g和5 μg/g、模拟胃液对照、模拟肠液对照、超纯水对照、玉米粉提取液对照。
1.2.7 SDS-PAGE分析取蛋白样品进行制样,100℃煮沸10 min,13 000×g离心10 min,取上清点样,4%浓缩胶,10%分离胶,80 V电泳20 min,150 V电泳直到胶底边缘。电泳结束后取出凝胶,进行脱色、染色及扫描图谱,参见萨姆布鲁克等[16]的方法。
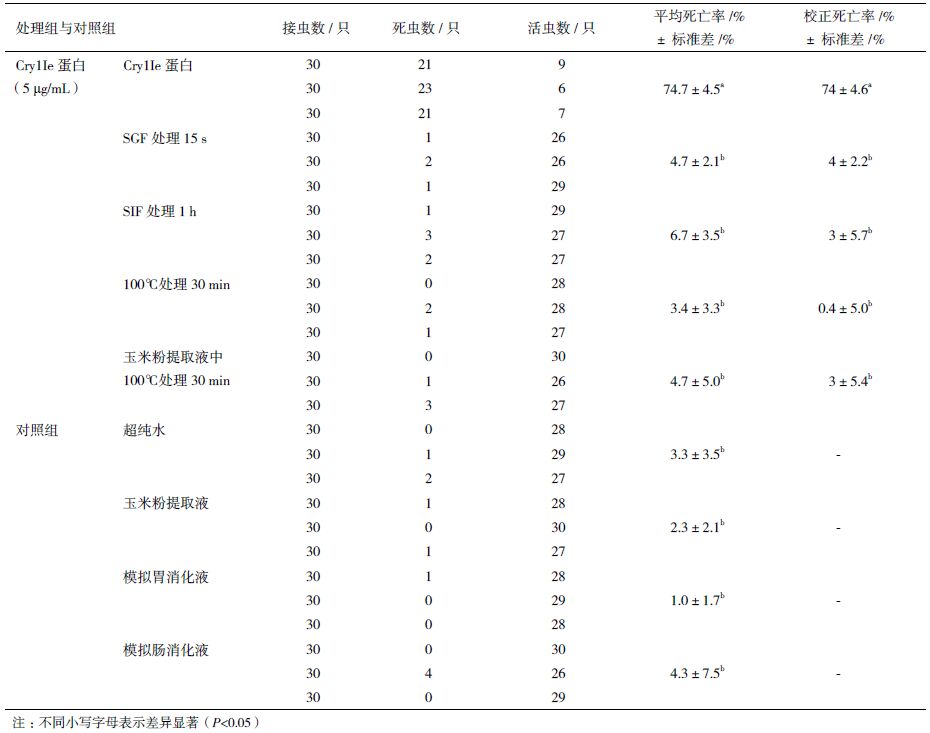
2 结果 2.1 Cry1Ie蛋白提取及表达条件的确定通过在不同温度条件和不同浓度的IPTG诱导,结果发现,在30℃时诱导Cry1Ie蛋白表达量明显低于18℃,在18℃时0.1 mmol/L IPTG诱导培养条件下,Cry1Ie重组蛋白的表达量最高(图 1-A,泳道1)。最终选择18℃、0.1 mmol/L IPTG、150 r/min诱导12 h作为该蛋白提取的最优条件。
|
| M:蛋白marker;CK:pET-21b空载体;1-3:IPTG浓度分别为0.1、0.5、1.0 mmol/L 图 1 不同温度和IPTG浓度下可溶性(A)和包涵体(B)Cry1Ie蛋白的SDS-PAGE检测 |
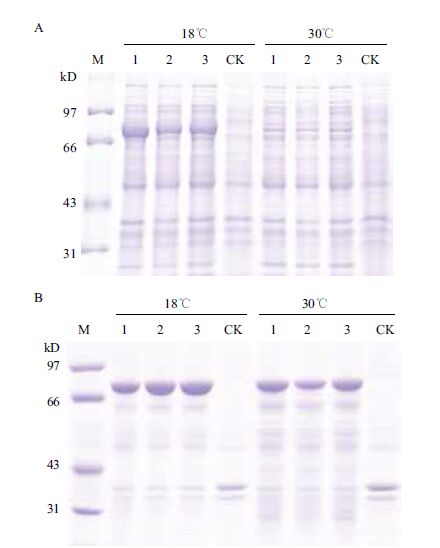
首先对可溶性Cry1Ie蛋白进行Ni-NTA亲和纯化,在250 mmol/L咪唑浓度下洗脱出浓度较高的纯蛋白(图 2-A)。再将250 mmol/L咪唑洗脱下来的蛋白用Millipore进行浓缩后进行分子筛层析,在出现洗脱峰时收集流穿,获得了纯蛋白(图 2-B),通过Image J软件分析蛋白纯度达到91%。
|
| 1:Cry1Ie;2:流穿;3:50 mmol/L咪唑洗脱;4:100 mmol/L咪唑洗脱;5-8:250 mmol/L咪唑洗脱;9:500 mmol/L咪唑洗脱;10:Cry1Ie浓缩;11-16:洗脱峰收集 图 2 Cry1Ie蛋白的Ni-NTA亲和层析纯化(A)及Superdex-75分子筛层析纯化(B) |
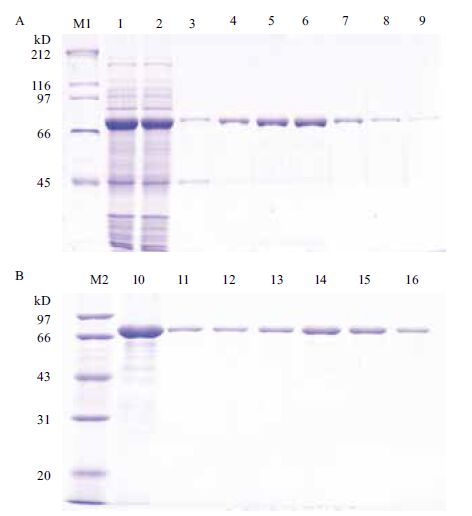
Cry1Ie蛋白在模拟胃液中不稳定,在15 s内可被消化完全,SDS-PAGE检测不到小片段残留(图 3-A)。不稳定对照酪蛋白在模拟胃液中2 min后被降解(图 3-B,泳道1),而稳定对照STI在1 h内没有被完全降解(图 3-B,泳道2),说明了该消化体系的稳定性及有效性。
|
| M:蛋白marker;(A)1:Cry1Ie蛋白;2-8:分别为Cry1Ie蛋白在SGF中处理15 s、1、2、5、10、30和60 min;(B)1:不稳定对照;2:稳定对照;3:模拟胃液空白对照;4:酪蛋白;5:STI 图 3 Cry1Ie蛋白(A)及对照蛋白(B)在模拟胃液中的消化稳定性分析 |
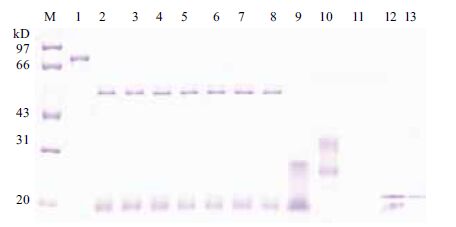
Cry1Ie蛋白在模拟肠液中不稳定,在15 s内可被消化,只有少量的抗蛋白酶核心片段蛋白没有被消化(图 4)。不稳定对照酪蛋白在模拟肠液中2 min后被降解(图 4,泳道9),稳定对照STI在1 h内没有被降解(图 4,泳道12),说明了该消化体系的稳定性及有效性(图 4,泳道9-13)。
|
| M:蛋白marker;1:Cry1Ie蛋白;2-8:分别为Cry1Ie蛋白模拟肠液处理15 s、1、2、5、10、30和60 min;9:不稳定对照;10:酪蛋白;11:模拟肠液空白对照;12:稳定对照;13:STI 图 4 Cry1Ie蛋白在模拟肠消化液稳定性 |
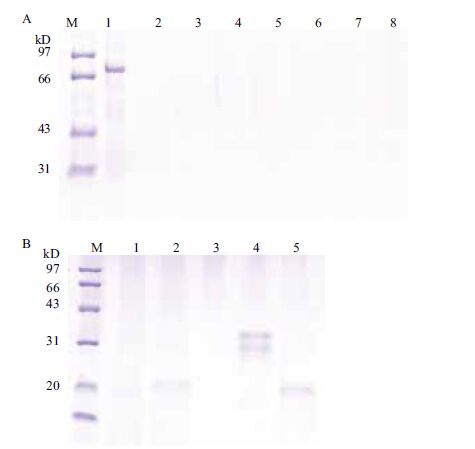
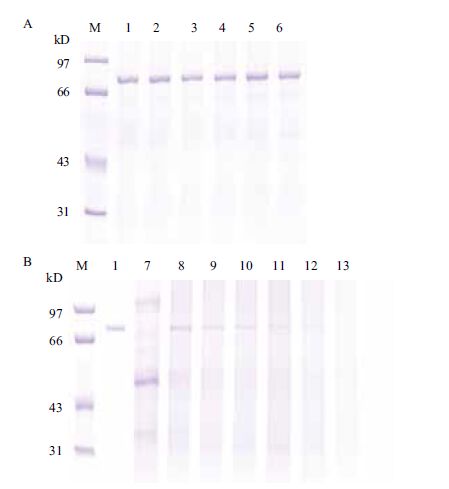
Cry1Ie蛋白在沸水浴中加热1 h后未降解(图 5-A,泳道2-6),证明纯蛋白具有热稳定性。为检测转基因玉米中Cry1Ie蛋白的热稳定性,将过量Cry1-Ie蛋白加入玉米粉提取液中,沸水浴中30 min,SDS-PAGE检测蛋白被完全降解(图 5-B,泳道7-12)。
|
| M:蛋白marker; 1:Cry1Ie;2-6: 2 min、5 min、10 min、30 min、1 h; 7:米粉溶液对照;8-13:Cry1Ie蛋白沸水浴中加热15 s、1 min、5 min、10 min、30 min、1 h 图 5 Cry1Ie纯蛋白(A)在超纯水及在玉米粉提取液中(B)的热稳定性分析 |
本实验中Cry1Ie蛋白浓度为5 μg/mL时,校正死亡率为74%,这与Song等[11]的Cry1Ie对亚洲玉米螟的生物活性测定结果是一致的。模拟胃肠液处理后的Cry1Ie蛋白已经失去杀虫活性,100℃超纯水处理1 h后的蛋白没有降解,但是已经失去杀虫活性。而在玉米粉提取液中处理30 min后的蛋白完全降解,并且失去杀虫活性(表 1)。
本研究获得了纯度为91%的纯Cry1Ie蛋白,证明了体外模拟胃肠液消化后及玉米粉提取液中热处理后Cry1Ie蛋白不稳定,并失去对亚洲玉米螟的杀虫活性。
自从1987年以来,转Bt基因抗虫农作物在全世界广泛种植[1]。对转基因农作物、转基因食品进行安全性评价尤为重要。目前用于饲料和食品的转基因Bt 作物主要是玉米。在中国和其他国家获得审批的转基因Bt 植物表达的Cry 蛋白包括Cry1Ab、Cry1F、Cry1A.105、Cry1Ac、Cry2Ab2、Cry3Bb、Cry34Ab1 和Cry35Ab1等[13]。欧洲食品安全局(EFSA)对玉米植株中所表达的Cry 蛋白的食品安全进行了评估,如Cry1Ab 和Cry3Bb1[17]、Cry1F[18]、Cry34-Ab1 和Cry35Ab1[19]和包含一种以上Cry 蛋白的玉米杂交品种[20, 21]。每一个注册的转基因Bt 作物都要根据国际食品法典的建议进行安全性评价,其中包括蛋白质特性、在模拟消化液中进行稳定性评估、在小鼠中进行急性高剂量口服毒性试验、与已知毒素和致敏原进行氨基酸序列比对及对非靶标生物的作用。对具有商业化前景的Bt作物及其外源蛋白进行评估,为其环境安全性及食用安全性评价奠定基础,体外模拟胃肠液消化稳定性与热稳定性评价恰恰是这方面最基础也是最关键的一个步骤。
本研究选择具有应用前景的Cry1Ie蛋白,并获得了大量可溶性蛋白,纯度达到91%这与此前的Song等[10]所做的表达相比,增加了蛋白的可溶性。根据Guo等[22]所做的IE648蛋白的表达纯化相比,仅仅用Ni-NTA亲和层析和分子筛层析就获得了纯度高的Cry1Ie蛋白,大大提高了纯化效率。
在2009年,Xu等[7]对Cry1Ab/Ac融合蛋白进行了消化稳定性和热稳定性评价,发现Cry1Ab/Ac蛋白在模拟消化液中不稳定,与本研究的结果一致。但是在热稳定性评价实验中,Xu只将目的蛋白溶解于20 mmol/L Tris-HCl中进行了热稳定性评价,而本研究同时将 Cry1Ie蛋白溶解于玉米粉提取液中进行热稳定性评价,证明了其在玉米粉提取液中的热不稳定性。这一实验模拟了该蛋白作为膳食来源经过一系列加工后进入人体的可能途径。在对Cry1Ie蛋白进行消化稳定性和热稳定性实验后,该蛋白都会以小肽或氨基酸的形式存在,而这些物质在人体内仅能够作为膳食来源的营养物质。除了花粉蛋白,其他所有免疫原性蛋白对消化酶都有极高的稳定性,因此蛋白质的稳定性可以被认为是预测蛋白质免疫原性的重要参考数据[23]。蛋白质经过胃蛋白酶消化后形成小于3.5 kD的小肽和氨基酸,则被认为几乎不可能具有免疫原性[24]。根据以上研究进展,可以初步判断,Cry1Ie蛋白不具有免疫原性。但是这只是一个初步的判断,并不能完全证明其无免疫原性。因为目前还没有发现抗蛋白酶消化与免疫原活性有直接的关系[24]。
4 结论通过Ni-NTA亲和层析系统和分子筛层析系统获得了Cry1Ie的纯蛋白,纯度达到91%对亚洲玉米螟具有较高的杀虫活性。通过模拟消化实验,证明Cry1Ie蛋白在体外模拟胃肠液中不稳定,15 s即被降解,对亚洲玉米螟失去杀虫活性。热稳定性实验证明,Cry1Ie蛋白在沸水浴中加热1 h后没有降解,并且保持对亚洲玉米螟的杀虫活性。但是该蛋白在玉米粉提取液中不稳定,在沸水浴中30 min即被降解,对亚洲玉米螟失去杀虫活性。
| [1] | James C. Global Status of Commercialized Biotech/GM Crops:2014[R]. ISAAA Brief 49, 2015. |
| [2] | Adang MJ, Crickmore N, Jurat-Fuentes JL. Diversity of Bacillus thuringiensis crystal toxins and mechanism of action[J]. Advances in Insect Physiology, 2014, 47:39-87. |
| [3] | Federici BA, Siegel JP. Safety assessment of Bacillus thuringiensis and Bt crops used in insect control[M]. // Hammond B. Food safety of proteins in agricultural biotechnology. New York:CRC Press, Boca Raton, 2007:45-102. |
| [4] | Hammond B, Cockburn A. The safety assessment of proteins introduced into crops developed through agricultural biotechnology:a consolidated approach to meet current and future needs[M]. // Hammond B. Food safety of proteins in agricultural biotechnology. New York:CRC Press, 2008:259-288. |
| [5] | Meade SJ, Reid EA, Gerrard JA. The impact of processing on the nutritional quality of food proteins[J]. Association of Official Analytical Chemists International, 2005, 88:904-922. |
| [6] | Environmental Protection Agency, Office of Pesticide Programs. Biopesticides and pollution prevention division. Bacillus thuringiensis Cry1Ac protein and the genetic material(Vector PV-GMIR9)necessary for its production in MON 87701(OECD Unique Identifier:MON 877Ø1-2)Soybean:US, 006532[P]. 2010. |
| [7] | Xu WT, Cao SS, He XY, et al. Safety assessment of Cry1Ab/Ac fusion protein[J]. Food and Chemical Toxicology, 2009, 47:1459-1465. |
| [8] | 中国农业科学院植物保护研究所. 人工合成的用于转基因抗虫植的Bt杀虫基因及其研制方法:中国, 03149867. 1[P]. 2006-1-25. |
| [9] | Crickmore N, Zeigler DR, Feitelson J, et al. Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins[J]. Microbiology and Molecular Biology Reviews, 1998, 62:807-813. |
| [10] | Song FP, Zhang J, Gu AX, et al. Identification of cry1I-type genes from Bacillus thuringiensis strains and characterization of a novel cry1I-type gene[J]. Applied and Environmental Microbiology, 2003, 69:5207-5211. |
| [11] | Liu YJ, Song FP, He KL, et al. Expression of a modified cry1Ie gene in E. coli and in transgenic tobacco confers resistance to corn borer[J]. Acta Biochimica et Biophysica Sinica, 2004, 36:309-313. |
| [12] | Xu L, Wang Z, Zhang J, et al. Cross-resistance of Cry1Ab-selected Asian corn borer to other Cry toxins[J]. Applied Entomology, 2010, 134:429-438. |
| [13] | 中国农业科学院作物研究所. 转基因玉米事件IE034外源插入片段旁侧序列及其应用:中国, 102604940A[P]. 2012-07-25. |
| [14] | Zhang YW, Liu Y, Zhang J, et al. Assessment of transgene copy number and zygosity of transgenic maize overexpressing Cry1Ie gene with SYBR® Green qRT-PCR[J]. In Vitro Cellular and Developmental Biology-Plant, 2015, 51(2):125-134. |
| [15] | Zhang YW, Liu YJ, Ren Y, et al. Overexpression of a novel Cry1Ie gene confers resistance to Cry1Ac-resistant cotton bollworm in transgenic lines of maize[J]. Plant Cell, Tissue and Organ Culture, 2013, 115:151-158. |
| [16] | 萨姆布鲁克 J, 拉塞尔 DW. 分子克隆实验指南[M]. 黄培堂, 译. 第3版. 北京:科学出版社, 2002. |
| [17] | European Food Safety Authority(EFSA). Opinion of the Scientific Panel on Genetically Modified Organisms on a request from the Commission related to the notification(reference C/DE/02/9)for the placing on the market of insect-protected genetically modified maize MON 863 x MON 810, for import and processing, under Part C of Directive 2001/18/EC from Monsanto[Z]. The EFSA Journal, 2005, 251:1-22. |
| [18] | EFSA. Opinion of the Scientific Panel on Genetically Modified Organisms on an application(reference EFSA-GMO-NL-2004-02)for the placing on the market of insect-tolerant genetically modified maize 1507, for food use, under Regulation(EC)No1829/2003 from Pioneer Hi-Bred International/Mycogen Seeds[Z]. The EFSA Journal, 2005, 182:1-22. |
| [19] | EFSA. Opinion of the Scientific Panel on Genetically Modified Organisms on an application(reference EFSA-GMO-NL-2005-12)for the placing on the market of insect-resistant genetically modified maize 59122, for food and feed uses, import and processing under Regulation(EC)No 1829/2003, from Pioneer Hi-Bred International, Inc. and Mycogen Seeds, c/o Dow Agrosciences LLC[Z]. The EFSA Journal, 2007, 470:1-25. |
| [20] | EFSA. Scientific Opinion on application(reference EFSAGMO-NL-2005-15)for the placing on the market of the insect-resistant and herbicide-tolerant genetically modified maize 1507×59122, for food and feed uses, import and processing under Regulation(EC)No 1829/2003 from Mycogen Seeds, c /o Dow AgroSciences LLC and Pioneer Hi-Bred International, Inc. as represented by Pioneer Overseas Corporation[Z]. The EFSA Journal, 2009, 1074:1-28. |
| [21] | EFSA. Scientific Opinion on application(EFSA-GMO-NL-2007-39)for the placing on the market of insect resistant and herbicide tolerant genetically modified maize MON89034×MON88017 for food and feed uses import and processing under Regulation(EC)No 1829/2003 from Monsanto. EFSA Panelon Genetically Modified Organisms(GMO)[Z]. The EFSA Journal, 2010, 8:1564. |
| [22] | Guo SY, Zhang CL, Lin XY, et al. Purification of an active fragment of Cry1Ie toxin from Bacillus thuringiensis[J]. Protein Expression and Purification, 2011, 78:204-208. |
| [23] | Astwood JD, Leach JN, Fuchs RL. Stability of food allergens to digestion in vitro[J]. Nature Biotechnology, 1996, 14:1269-1273. |
| [24] | Fu TJ, Abbott UR, Hatzos C. Digestibility of food allergens and nonallergenic proteins in simulated gastric fluid and simulated intestinal fluid-a comparative study[J]. Journal of Agricultural and Food Chemistry, 2002, 50:7154-7160. |