壳寡糖溶解度大,易于被人体吸收利用,且具有抗肿瘤、抗菌免疫激活及保湿吸湿等许多生理活性,在医药、保健品方面的应用令人瞩目[1, 2, 3]。目前,壳寡糖的制备来自于壳聚糖的降解,主要有化学降解法、物理降解法和酶降解法[4, 5]。其中酶降解法由于反应条件温和易控,寡糖得率高、功能性更强及不易造成环境污染等优点,是壳寡糖制备的主要方法[6, 7]。壳聚糖酶(Chitosanase,EC 3.2.1.99)对壳聚糖具有专一性,获得的寡糖分子量范围较窄,功能性更强,是最理想的壳寡糖制备酶[7]。但目前由于壳聚糖酶产量低,商品价格昂贵,无法用于大规模生产。研究发现许多水解酶如蛋白酶、果胶酶、溶菌酶及脂肪酶等多种常见工业酶制剂对壳聚糖有降解作用[8, 9, 10, 11]。国内外的学者对于不同来源的多种非专一性酶对壳聚糖的降解特性及产物特征等进行了研究发现,效果较为显著的酶主要有来自Trichoderma viride 及Aspergillus niger的纤维素酶、来自Aspergillus oryzae的半纤维素酶、来自Aspergillus niger的果胶酶,以及来自Aspergillus niger 的真菌蛋白酶、木瓜蛋白酶、无花果蛋白酶、菠萝蛋白酶、胃蛋白酶和溶菌酶等[12, 13]。还有学者将几种非专一性降解酶如纤维素酶、蛋白酶和α-淀粉酶共同作用于壳聚糖发现,这些酶水解壳聚糖具有协同作用[14]。多项研究表明,将这些酶复配后用于壳聚糖的降解,其水解作用比单一酶强,用于壳寡糖的制备效果更佳,可以得到相对分子质量低于3 000的低聚糖[9, 10, 11]。因此,开发和制备壳聚糖降解复合酶制剂对于壳寡糖的制备很有必要。
目前,关于复合酶对壳聚糖的酶解的研究多集中于酶的种类、复配和降解效果及相关工艺等方面[9, 14, 15, 16],而关于壳聚糖降解用复合酶制剂生产方面的报道较少。固态发酵具有酶系全、活性高及生产成本低等优势,随着固态发酵技术的发展,固态发酵已广泛应用于食品、饲料及洗涤剂等工业用酶的生产[17, 18, 19, 20]。因此,在确保菌种优良和合适的培养条件下,应用固态发酵技术生产含有多种酶(如纤维素酶、果胶酶、半纤维素酶及淀粉酶)活性的壳聚糖非专一性降解酶制剂复合物是可行的,这很有可能为壳聚糖降解复合酶的开发提供一种新途径。
本研究以一株产壳聚糖降解酶的生产菌——曲霉为出发菌株,对其进行固和液态发酵,对两种发酵粗酶产物的组分及酶学特性进行对比和分析,并对其相关因素进行进一步分析,确定固态发酵在生产壳聚糖降解酶复合酶制剂方面的优势,旨为高效壳聚糖降解复合酶制剂的开发提供参考依据。
1 材料与方法 1.1 材料菌株:曲霉(壳聚糖酶生产菌)由武汉生物工程学院酶工程实验室提供(此菌为实验室新筛选保藏菌种,尚未取得菌种保藏编号)。
斜面种子培养基(g/L):胶体壳聚糖1.0,(NH4)2SO4 0.5,酵母膏0.5,K2HPO4 0.07,KH2PO4 0.03,NaCl 0.5,MgSO4·7H2O 0.05,葡萄糖0.1,自然pH。液体发酵培养基(g/L):胶体壳聚糖1.0,(NH4)2SO4 0.5,酵母膏0.5,K2HPO4 0.07,KH2PO4 0.03,NaCl 0.5,MgSO4·7H2O 0.05,葡萄糖0.1,自然pH。固态发酵培养基(g/L):营养液:MgSO4 0.5、K2HPO4 0.5、KCl 0.5、FeSO4·7H2O 0.01、ZnSO4 0.1,壳聚糖4.0,自然pH。麸皮:豆饼粉=35,料水比89。
1.2 方法 1.2.1 曲霉液态发酵及粗酶液的制备取培养成熟(培养2 d)的斜面孢子制备菌悬液,接种量(体积分数)为0.2,装液量75 mL/250 mL,180 r/min,32℃恒温培养9 d,每天取样,将发酵液用布氏漏斗(6-7层滤纸)进行抽滤和微滤得粗酶液,以壳聚糖为底物测壳聚糖降解酶酶活。
1.2.2 曲霉固态发酵粗酶液的制备取培养成熟(培养2 d)的斜面孢子制备菌悬液,接种量1 mL,30℃恒温培养15 d,每天取样,及时将固体曲研碎,按固体曲重量的10倍加入浸提液(pH5.0的醋酸-醋酸钠缓冲液),浸提1 h,离心得粗酶液,以壳聚糖为底物测壳聚糖降解酶酶活。固态发酵产酶量以1 g固体曲重所含酶活计算。
1.2.3 酶活测定壳聚糖降解酶酶活的测定:以1%胶体壳聚糖为底物,采用DNS法[14]测定。酶活单位定义为:在测定条件下(pH5.6,50℃准确反应15 min),每分钟水解底物生成1 μmol还原糖所需的酶量定义为一个酶活力单位,单位为U/mL。果胶酶酶活测定,以多聚半乳糖醛酸为底物,采用DNS试剂测定[21span>]。酶活力单位定义:在测定条件下(pH5.6,50℃准确反应30 min),每分钟水解底物生成1 μmol半乳糖醛酸所需的酶量定义为一个酶活力单位,单位为U/mL。纤维素酶酶活测定,以羧甲基纤维素钠为底物,按Bailey和Nevalainen[22]的方法测定。酶活力单位定义:在测定条件下(pH5.6,50℃准确反应30 min),每分钟催化底物生成1 μmol葡萄糖所需的酶量定义为一个酶活力单位,单位为U/mL。蛋白酶酶活测定,以酪蛋白为底物,采用福林-酚法。酶活力单位定义:测定条件下(pH5.6,50℃准确反应10 min),每分钟催化底物生成1 μmol酪氨酸所需的酶量定义为一个单位,单位为U/mL。淀粉酶酶活测定,以可溶性淀粉为底物,采用DNS法测定。酶活力单位定义:在测定条件下(pH5.6,50℃准确反应15 min),每分钟催化底物生成1 μmol葡萄糖所需的酶量定义为一个单位,单位为U/mL。脂肪酶酶活测定,以甘油三酯为底物,参照国家标准进行滴定。酶活力单位定义:在测定条件下,每分钟催化底物生成1 μmol的可滴定的脂肪酸即为一个酶活力单位,单位为U/mL。
1.2.4 固液态发酵产壳聚糖降解酶的最适反应温度及温度稳定性以1%胶体壳聚糖为底物,在不同温度(30、35、40、45、50、55和60℃)条件下测两种粗酶液的壳聚糖降解酶酶活,以活力最高者为100%,确定两种酶制剂的最适反应温度; 将酶液在不同温度(30、35、40、45、50、55℃和60℃)条件下分别保温一定时间(30、60、90、120和150 min)后,在最适条件下测定两种酶制剂的壳聚糖降解酶酶活,以未进行保温的酶液的酶活为100%计算相对酶活力,确定测试酶的温度稳定性。
1.2.5 固液态发酵产壳聚糖降解酶的最适反应pH及酸碱稳定性以1%胶体壳聚糖为底物,在不同pH(4.0、4.6、5.2、5.8、6.4、7.0和7.6)条件下测两种酶制剂的壳聚糖降解酶酶活,以活力最高者为100%,确定两种酶制剂的最适反应pH; 将酶液在不同pH(4.0、4.6、5.2、5.8、6.4、7.0和7.6)件下分别保存一定时间(30、60、90、120和150 min)后,在最适条件下测定两种酶制剂的壳聚糖降解酶酶活,以在不同pH条件下保存前的酶活为100%,确定两种酶制剂的酸碱稳定性。
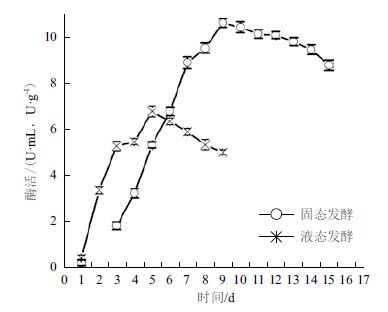
2 结果 2.1 曲霉固液态发酵产酶过程分析本实验对曲霉进行固液态发酵,结果(图 1)表明,两种发酵过程的发酵趋势基本一致,随发酵的进行,酶液的壳聚糖降解活力先增加后减少。但同时发现两者的发酵速度有很大不同,其中液态发酵较固态发酵提前4 d到达产酶高峰期。发酵结束后,测定固液态发酵粗酶酶活,分别为10.33 U/g(固体曲)和4.85 U/mL(发酵液)。
对图 1进行综合分析认为,固态发酵的营养物质结构致密,成分复杂不易吸收,微生物生长周期长,利于酶的积累,由此体现出固态发酵的优势。液态发酵后期酶活会迅速降低,说明该壳聚糖降解酶在此状态下稳定性较差。因此,应正确把握液态发酵结束时间,否则酶活损失较大。
|
| 图 1 曲霉固液态发酵产壳聚糖降解酶过程曲线 |
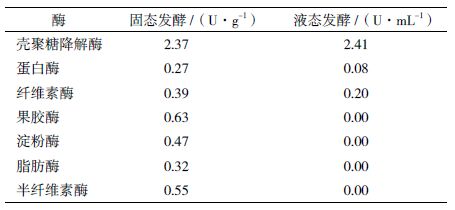
对获得的粗酶液进行稀释或浓缩,使两种粗酶液以壳聚糖为底物的酶活相等,测定固液态发酵酶产物的各种酶酶活,结果见表 1。
由表 1可见,该曲霉固液态发酵产酶酶活均以壳聚糖降解活性为主。但固态发酵粗酶同时具有多种常见糖苷酶,如纤维素酶、果胶酶、淀粉酶、脂肪酶和半纤维素酶酶活。对曲霉液态发酵产酶进行分析发现,该酶具有较高壳聚糖降解活性,同时具有相对较高的纤维素酶酶活和较低的蛋白酶酶活,不含有脂肪酶和淀粉酶酶活。因此推测有两种可能:(1)该曲霉在液态发酵中所产酶可能为具有纤维素酶活的专一性壳聚糖酶(EC 3.2.199); (2)也可能该曲霉同时分泌了专一性壳聚糖酶(EC 3.2.199)和纤维素酶。
以上分析表明,本研究所用曲霉在液态发酵条件下分泌酶组分较单一,在固态发酵时可以分泌多种具有壳聚糖降解活性的酶。
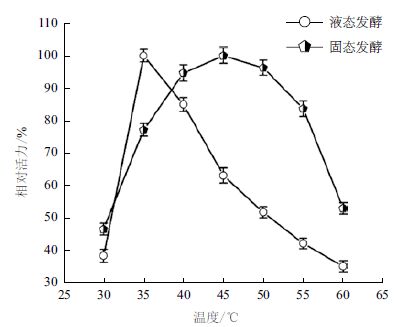
2.3 烟曲霉固液态发酵产壳聚糖降解酶酶学性质 2.3.1 固液态发酵产壳聚糖降解酶的最适反应温度分别在不同温度下测定不同来源的壳聚糖降解酶的活力,以活力最高者为100%对照,确定酶的最适反应温度,结果如图 2所示。固液态发酵产壳聚糖降解酶最适反应温度分别为45℃和40℃。并且,固态发酵壳聚糖降解酶具有较宽泛的温度适宜范围,在40-55℃之间均具有较高的酶活,液态发酵壳聚糖降解酶在35-40℃之间的活性较高。这可能跟固态发酵酶组分比较复杂有关,不同的酶在自身适宜的温度条件下分别表现出较高酶活。
|
| 图 2 温度对固液态发酵壳聚糖降解酶酶活性的影响 |
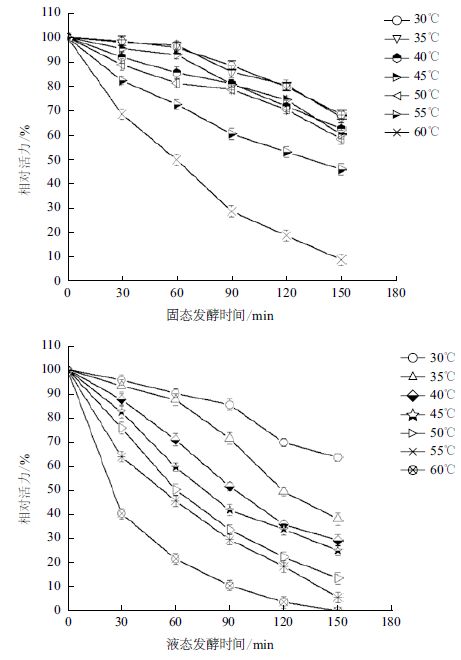
考察测试样品的温度稳性,结果如图 3所示。固态发酵壳聚糖降解酶热稳定性高于液体发酵壳聚糖降解酶。液体发酵壳聚糖酶在30℃时稳定性最高,保温150 min后仍维持原酶活的64.5%。随着温度的增加,酶的稳定性迅速下降,50℃时保温150 min,残余酶活仅为13.4%。固态发酵壳聚糖降解酶在40-50℃范围之内均具有较高的稳定性,50℃保温150 min后维持原酶活的58.3%左右,这可能和其复杂的酶组分有关。
|
| 图 3 固液态发酵产壳聚糖降解酶温度稳定性 |
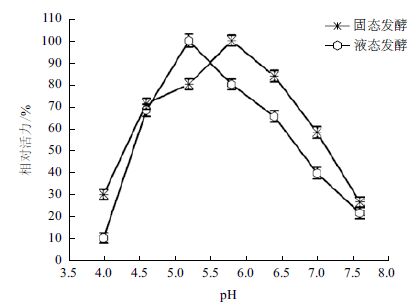
对固液态发酵壳聚糖降解酶最适反应pH进行考察,结果如图 4和图 5所示。
|
| 图 4 pH 对固液态发酵产壳聚糖降解酶酶活性的影响 |
|
| 图 5 固液态发酵产壳聚糖降解酶的酸碱稳定性 |
由图 4所示,固液态发酵壳聚糖降解酶最适反应pH分别为5.8和5.2,由此可见两者的最适反应pH差异不大。但固态发酵产酶在pH4.6-6.4范围内活性较高,而液态发酵产酶在pH4.6-5.8范围内活性较高,其pH适宜范围略窄于固态发酵来源的壳聚糖降解酶。壳聚糖溶于弱酸,碱性不溶,由此可见两种来源的壳聚糖降解酶最适反应pH与壳聚糖的降解环境pH较为一致。
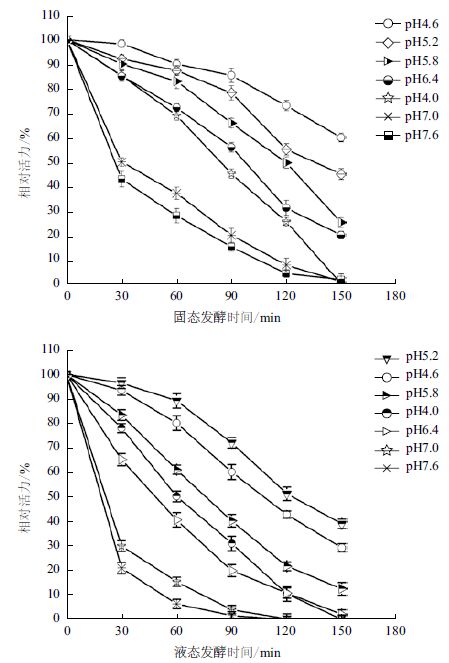
考察酶的酸碱稳定性,可以为酶催化反应体系与反应时间的设定提供依据,提高降解效果。由图 5可知,固液态发酵产壳聚糖降解酶在相同的酸碱度范围内具有相似的稳定性,在pH4.6-6.4范围内均较稳定,分别在pH4.6和pH5.2时稳定性最高,环境pH>6.4或pH≤4.0时酶活迅速降低。固态发酵壳聚糖降解酶的酸碱稳定性略高于液态发酵壳聚糖降解酶。例如,在pH4.6环境中保存60、90、120和150 min后,固液态壳聚糖降解酶分别保留原酶活的91.11%和80.1%、85.5%和60.24%、73.1%和42.9%、60.1%和29.3%。
3 讨论目前,深层液体发酵已成为主要的工业酶制剂生产方法。但随着对固态发酵研究的深入,人们发现固态发酵具有液体发酵无法比拟的优势。例如,原材料廉价、目的产物浓度高、废水废渣少等。固态发酵培养基成分复杂,微生物需要代谢各种酶类来为细胞的生长和代谢提供能源[17, 18],这为复合酶制剂的开发提供了便捷而廉价的方法。
本研究以壳聚糖酶生产菌——曲霉为出发菌进行研究,期望通过比较固液态发酵产物的组分及酶学特性发现对壳聚糖降解复合酶生产有价值的信息。结果表明,在固态发酵情况下,该曲霉产酶组分更加复杂,壳聚糖降解酶稳定性更强,温度和pH适用范围更广,这一点符合固态发酵产物的特性,固态发酵酶的酶学特性更加符合工业应用的要求。因此,专一性壳聚糖酶(EC 3.2.199)生产菌的筛选需要更加科学的方法,传统的以壳聚糖为唯一碳源的普通平板筛选法可能仅适合于壳聚糖降解酶生产菌的筛选。固态发酵壳聚糖降解酶热稳定性高于液态的,这一特点在壳寡糖工业制备中的应用较液态的发酵壳聚糖降解酶更具优势和潜力。更加值得注意的是,固态发酵产物中含有纤维素酶、蛋白酶、淀粉酶及果胶酶等是壳聚糖降解的主要的非专一性酶[8, 9, 10, 11],这为壳聚糖降解酶的生产开发提供了新的思路。目前有关壳聚糖酶的生产研究大多都集中在菌种基因工程菌的构建、发酵条件的优化和控制方面[23, 24, 25]; 对壳聚糖降解的应用研究主要集中在将各种单一酶进行复配,考察其降解效果和条件方面[8, 9, 10, 11],而忽略了固态发酵本身可以提供廉价复合酶这一特点。当然,若要利用固态发酵制备有效的壳聚糖降解酶,需要做的工作还很多。例如,首先需要有高效的生产菌种; 其次还需要对其培养条件、底物种类及产物特性进行广泛的研究等,还需要更深入的研究揭示微生物固态发酵产酶种类及其含量的影响因素及相关的机理等。因此,还需要进行大量的研究探索。
利用固态发酵可获得多组分壳聚糖降解酶,是获得复合酶组分的有效方法。培养基组分对微生物产酶包括酶组分、含量和特性等具有很大影响,若系统考察固态发酵培养基对烟曲霉产酶的影响,或许能获得具有特定配比及适合应用要求的复合酶制剂。但若通过此法开发满足壳寡糖工业生产所需的复合酶制剂还需要进行系统和深入的研究。由于研究手段的限制,本研究未能进一步确认各酶酶活所对应的具体酶的种类、蛋白结构等信息; 同时也未能探讨不同的固态发酵培养基底物对所得复合酶组分和酶学性质的影响。只是对固液态发酵酶组分及其基本酶学性质进行了简单的研究,得出了固态发酵产壳聚糖降解酶可应用于壳聚糖降解的有利信息,但还未考察固态发酵产壳聚糖降解酶在壳聚糖降解方面的应用情况,此方面的研究有待进一步进行,以确认固态发酵产复合酶对壳聚糖降解的具体作用。
4 结论固液态发酵具有相同的发酵趋势,但发酵周期不同。固态发酵产壳聚糖降解酶产酶高峰期出现在发酵第9天,比液态发酵产酶高峰期延迟4 d。
固态发酵所得酶组分复杂,除具有壳聚糖降解活性外,还具有蛋白酶、纤维素酶、果胶酶、淀粉酶、脂肪酶和半纤维素酶活; 液态发酵所得酶组分较单一,除壳聚糖降解活性外,还表现出较小的蛋白酶酶活和纤维素酶酶活。
固液态发酵所产酶最适反应温度分别为45℃和35℃,适宜温度分别40-55℃和35-40℃。固态发酵产酶较液态产酶具有更加宽泛的适宜范围,两者分别在40-50℃和30℃时稳定性最高,50℃时保温150 min,残余酶活分别为62.5%和13.4%。
固液态发酵产酶的最适反应pH分别为5.8和5.2,分别在pH4.6-6.4和pH4.6-5.8具有较高活性; 两者在pH4.6-6.4范围内均较稳定,分别在pH4.6和pH5.2时稳定性最高。在pH4.6和pH5.2环境中保存150 min,固液态壳聚糖降解酶分别保留原酶活的60.1%和29.37%以及45.1%和39.1%。
| [1] | Aam BB, Heggset EB, Norberg AL, et al. Production of chitooligosa-ccharides and their potential applications in medicine[J]. Marine Drugs, 2010, 8(5):1482-1517. |
| [2] | 张长梅, 于抒含, 张良栓, 等. 不同分子量壳寡糖的制备及其生物活性研究[J]. 哈尔滨医科大学学报, 2013, 47(6):486-489. |
| [3] | 朱玉霞. 壳寡糖的制备、分离分析及抑菌活性研究[D]. 无锡:江南大学, 2013. |
| [4] | Ilina AV, Varlamov VP. Hydrolysis of chitosan in lactic acid[J]. Applied Biochemistry and Microbiology, 2004, 40(3):300-303. |
| [5] | 陈小娥. 曲霉产壳聚糖酶酶学性质及作用机理研究[D]. 无锡:江南大学, 2004. |
| [6] | Yu WL, Hsiao YC, Chiang BH. Production of high degree polymerized chitooligosaccharides in a membrane reactor using purified chitosanase from Bacillus cereus[J]. Food Research International, 2009, 42(9):1355-1361. |
| [7] | Takashi K, Yohei N, Mitsutoshi N, et al. Production of chitosan oligosaccharides using chitosanase immobilized on amylose-coated magnetic nanoparticles[J]. Process Biochemistry, 2008, 43(1):62-69. |
| [8] | Xia WS, Liu P, Liu J. Advance in chitosan hydrolysis by non-specific cellulases[J]. Bioresource Technology, 2008, 99(15):6751-6762. |
| [9] | Lin H, Wang HY, Xue CH, et al. Preparation of chitosan oligomers by immobilized papain[J]. Enzyme and Microbial Technology, 2002, 31(5):588-592. |
| [10] | Cabrera JC, Cutsem VP. Preparation of chitooligosaccharides with degree of polymerization higher than 6 by acid or enzymatic degradation of chitosan[J]. Biochemical Engineering Journal, 2005, 25(2):165-172. |
| [11] | Kim SK, Rajapakse N. Enzymatic production and biological activities of chitosan oligosaccharides(COS):A review[J]. Carbohydrate Polymers, 2005, 62(4):357-368. |
| [12] | Fu JY, Wu SM, Chang CT, et al. Characterization of three chitosanase isozymes isolated from a commercial crude porcine pepsin preparation[J]. Journal of Agriculture and Food Chemistry, 2003, 51(4):1042-1048. |
| [13] | Hong SP, Kim DS. Chitosanolytic characteristics of cellulases from Trichoderma viride and Trichoderma reesei[J]. Korean Journal of Food Science Technology, 1998, 30(2):245-252. |
| [14] | Zhang H, Du YG, Yu XJ, et al. Preparation of chitooligosaccharides from chitosan by a complex enzyme[J]. Carbohydrate Research, 1999, 320(3-4):257-260. |
| [15] | Pan SK, Wu SJ, Kim JM. Preparation of glucosamine by hydrolysis of chitosan with commercial α-amylase and glucoamylase[J]. Journal of Zhejiang University-Science B, 2011, 12(11):931-934. |
| [16] | 何新益, 夏文水. 复合酶对壳聚糖的降解作用研究[J]. 食品与机械, 2007, 23(3):32-35. |
| [17] | Gustavo VG, Emesto FT, Cristobal NA, et al. Christopher Augur. Advantages of fungal enzyme production in solid over liquid fermentation systems[J]. Biochemical Engineering Journal, 2003, 13(2-3):157-167. |
| [18] | Gramihha EBN, Goncalves AZL, Pirota RDPB, et al. Enzyme production by solid-state fermentation:Application to animal nutrition[J]. Animal Feed Science and Technology, 2008, 144(1-2):1-22. |
| [19] | Couto SR, Sanromán MA. Application of solid-state fermentation to food industry—A review[J]. Journal of Food Engineering, 2008, 76(3):291-302. |
| [20] | Couri S, da Costa Terzi S, Saavedra Pinto GA, et al. Hydrolytic enzyme production in solid-state fermentation by Aspergillus niger 3T5B8[J]. Process Biochemistry, 2000, 36(3):255-261. |
| [21] | 张飞, 岳田利, 费坚, 等. 果胶酶活力的测定方法研究[J]. 西北农业学报, 2004, 13(4):134-137. |
| [22] | Bailey MJ, Nevalainen KMH. Induction, isolation and testing of stable Trichoderma reesei mutants with improved production of solubilizing cellulose[J]. Enzyme Microbial Technology, 1981, 3(2):153-157. |
| [23] | Ngo KX, Umakoshi H, Shimanouchi T, et al. Heat-Enhanced production of chitosanase from Streptomyces griseus in the presence of liposome[J]. Journal of Bioscience and Bioengineering, 2005, 100(5):495-501. |
| [24] | Ngo KX, Umakoshi H, Shimanouchi T, et al. Enhanced release of chitosanase from Streptomyces griseus through direct interaction of liposome with cell membrane under heat stress[J]. Journal of Bioscience and Bioengineering, 2008, 106(6):602-605. |
| [25] | Thadathil N, Velappan SP. Recent developments in chitosanase research and its biotechnological applications:A review[J]. Food Chemistry, 2014, 150(1):392-399. |