氧和铁是生物必需的营养元素,参与代谢时会产生O2-、H2O2、·OH等自由基(Reactive oxygen species,ROS),造成氧化压力[1],对DNA、蛋白质、膜脂等细胞组分造成氧化损伤[2, 3]。Almiron和Azam等[4, 5]在长期饥饿培养的大肠杆菌(Escherichia coli,E. coli)中发现一种消除ROS的抗氧化蛋白,命名为DPS(DNA-binding proteins from starved cells)。现已证实DPS蛋白广泛分布于细菌体内,是一种重要的抗胁迫蛋白[6]。细菌处于生长静止期或受胁迫时在体内表达DPS蛋白,并与DNA结合,形成紧密的DPS-DNA复合体,保护DNA免受氧化损伤[7]。同时,作为铁蛋白超家族一员,DPS以十二聚体结构结合并储存铁,调节铁的供应,防止铁盐沉淀造成的毒性损伤[8, 9]。十二聚体结构作为DPS发挥功能的重要结构基础,其自组装过程研究未见报道。本研究以大肠杆菌基因组为模板,用基因工程原核表达DPS,应用纯化的DPS观察其在体外条件下的自组装情况,旨在为研究其自组装和抗氧化活性提供参考。
1 材料与方法 1.1 材料 1.1.1 菌种、载体、培养基和试剂菌株为大肠杆菌0111菌株和DH5α菌株(本实验室保存)。原核表达载体是pBV220质粒。LB细菌培养基由Oxiod公司胰蛋白胨和酵母提取物配制而成。鼠源抗HIS单抗(Anti-His mA)为Earthox产品,羊抗鼠辣根过氧化物酶标二抗购自北京中杉金桥生物技术公司。亲和层析用1 mL His Trap FF crude column柱为GE公司产品。其他试剂为国产分析纯。
1.1.2 工具酶和试剂盒核酸限制内切酶EcoR I、BamH I,Taq DNA聚合酶、T4 DNA连接酶等均为Fermentas公司产品。多功能DNA纯化回收试剂盒、高纯质粒小量制备试剂盒、细菌基因组提取试剂盒均购自北京博大泰克公司。透析袋(Ф27 mm)为Union Carbide Corporation产品。DAB显色试剂盒购自北京中杉金桥生物技术公司。
1.2 方法 1.2.1 引物设计、基因扩增和表达载体构建模板为提取的0111菌株基因组DNA。特异性上下游引物为5'-CGGAATTCATGAGTACCGC-3'和5'-GCGGA-TCCTTAGTGATGATGATGATGATGTTCGATGTTAGAC-TCG-3',是参考GenBank中大肠杆菌dps基因序列设计,其中上游引物引入EcoR I酶切位点序列和ATG,下游引物引入6×His序列(斜体部分)、TAA以及BamH I酶切位点序列。引物由上海生物工程技术服务有限公司合成。
目的基因和提取的pBV220质粒分别用EcoR I、BamH I双酶切,T4连接酶连接,转化DH5α感受态细胞,阳性克隆进行双酶切和测序鉴定。基因测序送北京华大基因公司完成测序。
1.2.2 蛋白表达和纯化工程菌在LB培养基中37℃培养至对数期,42℃过夜诱导表达目的蛋白。沉淀细胞超声破碎后分别取上清和沉淀,用SDS-PAGE(4%浓缩胶,12%分离胶)和Western-blotting检测鉴定目的蛋白。
用His Trap FF crude column亲和层析柱纯化目的蛋白。超声破碎菌体并提取包涵体,用含6 mol/L脲的20 mmol/L磷酸盐缓冲液(PB)溶解包涵体后加入到层析柱中,再用含100-400 mmol/L咪唑的特异性洗脱缓冲液洗脱,SDS-PAGE分析洗脱组分。
1.2.3 DPS自组装鉴定将纯化的DPS蛋白分别用含4、2和0.5 mmol/L脲的PB缓冲液,分级逐步透析去除蛋白溶液中的6 mmol/L脲,进行非变性PAGE电泳分析,浓缩胶为4%,分离胶为10%。
1.2.4 DPS对DNA的抗氧化保护将等体积DPS(1.8 mg/mL)和等体积pBV220质粒(40 ng/mL)混合后,加入等量的Fenton试剂(终浓度为10 mmol/L H2O2,100 mmol/L FeSO4,50 mmol/L Tris-HCl),37℃孵育24 h,1.2%琼脂糖电泳,检测质粒DNA降解情况。同时分别用质粒、加热变性的DPS、BSA蛋白与Fenton试剂孵育作为对照体系。
2 结果 2.1 目的基因扩增与表达载体构建经PCR扩增获得了一条特异性DNA片段,长度与dps基因522 bp相当,重组载体双酶切鉴定也得到了该片段(图 1)。经DNA测序鉴定,重组载体插入了3'-末端带有6×His标签的dps基因序列(测序结果略)。

|
| M:DL2000分子量标准; 1:PCR扩增产物; 2:pBVDPSHis载体; 3:重组载体经EcoR I 和 BamH I 酶切产物 图 1 pBVDPSHis载体及鉴定 |
从SDS-PAGE结果(图 2-A)可以看出,42℃诱导的宿主细胞中存在分子量接近20 kD的表达蛋白条带,该蛋白与DPS单体蛋白的理论分子量19.5 kD相当。用Anti-His mA单抗进行Western blotting检测,结果(图 2-B)表明,工程菌成功表达了带有HIS标签的DPS蛋白。另外,表达蛋白主要存在沉淀中,说明该蛋白是以包涵体形式获得高效表达。

|
| M:低分子量标准蛋白; 1, 3, 5:未诱导工程菌的细胞蛋白(1:全菌,3:上清,5:沉淀); 2, 4, 6:诱导工程菌的细胞蛋白(2:全菌; 4:上清,6:沉淀); 7:诱导工程菌的全菌蛋白印迹; 8:纯化的DPS蛋白印迹 图 2 表达产物的SDS-PAGE(A)和Western blotting分析(B) |
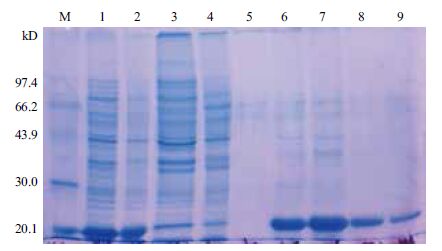
蛋白纯化后的SDS-PAGE结果(图 3)显示,在特异性洗脱组分中含有目的蛋白(图 3泳道6-9),其中300和400 mmol/L咪唑洗脱组分中得到较纯的DPS蛋白。
|
| M:低分子量标准蛋白; 1:诱导细胞全菌蛋白; 2:沉淀(包涵体); 3,4:穿过峰; 5:非特异性洗脱组分; 6-9:分别用 100、200、300及400 mmol/L 咪唑特异性洗脱组分 图 3 DPS蛋白SDS-PAGE结果 |
纯化的DPS蛋白进行PAGE分析结果(图 4)显示,DPS蛋白在6 mmol/L脲的PB中出现多条条带,说明变性蛋白虽能组装成大分子量(十二)聚体,但仍然有大量的低聚体存在,分子量大多都超过66.7 kD。相比而言,脲降低到0.5 mmol/L时蛋白低聚体比例大大降低,大分子量(十二)聚体蛋白更加稳定。如果在0.5 mmol/L脲的蛋白中添加NaCl,可以明显促进大分子聚合体的形成,特别是50 mmol/L NaCl浓度时,几乎所有蛋白都自组装成稳定的十二聚体蛋白,说明NaCl能促进自组装过程。

|
| 1:1 mg/mL BSA(牛血清白蛋白); 2:变性DPS(6 mmol/L 脲); 3:复性DPS(0.5 mmol/L脲); 4-8:复性DPS(分别加50、100、150、200和300 mmol/L NaCl) 图 4 纯化的DPS蛋白PAGE结果 |
结果(图 5)显示,Fenton反应后,质粒DNA在不含DPS的反应体系中被完全降解,在含DPS的反应体系中保持不变,在含热变性DPS的体系中被部分降解,而在含BSA蛋白的对照组同样被降解。上述结果说明,Fenton反应产生的羟基自由基对DNA分子造成氧化破坏,而DPS对DNA分子有抗氧化保护作用,加热变性后的DPS仍有部分保护作用,而且DPS对DNA的抗氧化保护是其特异性的功能,BSA不具备同样功能。

|
| 1:质粒; 2:质粒和Fenton试剂; 3:质粒、Fenton试剂和DPS; 4:质粒、Fenton试剂和热变性DPS; 5:质粒、Fenton试剂和BSA蛋白 图 5 质粒保护琼脂糖凝胶电泳结果 |
作为细菌内的抗氧化保护蛋白,DPS蛋白在菌体内翻译、自组装成十二聚体结构发挥作用。两个相邻DPS蛋白单体,侧面反向交叉形成一个面,六个面围城一个近乎球形的六面体,该球形六面体外径9 nm,内径4.5 nm,其中空腔穴带有负电荷,是铁成核及矿化部位[10]。有文献报道,DPS聚合体是由6个二聚体组合而成,也有说是4个三聚体组合而成[11, 12]。本实验中观察到有不同分子量大小的聚合体,部分支持了这种观点,但也说明还可能存在其它聚体形式。实验中获得的纯化蛋白经除脲复性和添加NaCl后,可以形成稳定的分子量均一的聚合,这与文献报道的DPS十二聚体的活性结构相吻合[13]。因此可以确定基因工程表达的DPS能够自组装成十二聚体结构。而DPS在Fenton反应中对质粒DNA的保护作用的实验结果,证明体外表达纯化的DPS能够发挥抗氧化保护蛋白功能。
DPS一方面通过将Fe2+转化成羟基氧化铁(FeOOH)形式防止羟自由基产生[14],并储存铁元素,调节铁的利用和储存间平衡; 另一方面,DPS能够在逆境环境下与DNA分子形成非序列依赖性的DPS-DNA复合体结晶,稳定DNA分子[15, 16, 17]。有些病原菌甚至利用DPS蛋白的活性抵抗药物作用[18]。因此DPS结构及其抗氧化作用都是抗病原菌药物设计的潜在靶点。另外,DPS颗粒状结构还是小分子抗原的展示平台,可用于纳米疫苗的研究。
4 结论基因工程原核表达的带有His标签的DPS蛋白,纯化后能自组装成稳定的十二聚体结构并具有抗氧化保护质粒DNA作用。
| [1] | Lushchak VI. Oxidative stress and mechanisms of protection against it in bacteria[J]. Biochemistry(Moscow), 2001, 66(5):476-489. |
| [2] | Chiancone E, Ceci P, Ilari A, et al. Iron and proteins for iron storage and detoxification[J]. Biometals, 2004, 17:197-202. |
| [3] | Imlay JA. Cellular defences against superoxide and hydrogen peroxide[J]. Annu Rev Biochem, 2008, 77:755-776. |
| [4] | Almiron, M, Link AJ, Furlong D, et al. A novel DNA-binding protein with regulatory and protective roles in starved Esherichia coli[J]. Genes Dev, 1992, 6:2646-2654. |
| [5] | Azam AT, Iwata A, Nishimura A, et al. Growth phase-dependent variation in protein composition of the Esherichia coli nucleoid[J]. Bacteriol, 1999, 181:6361-6370. |
| [6] | Farr SB, Kogoma T. Oxidative stress responses in Esherichia coli and Salmonella typhimurium[J]. Microbiol Rev, 1991, 55:561-585. |
| [7] | Chiancone E. Dps proteins, an effcient detoxification and DNA protection machinery in the bacterial response to oxidative stress[J]. Rendiconti Lincei, 2008, 19:261-270. |
| [8] | Arosio P, Ingrassia R, Cavadini P. Ferritins:a family of molecules for iron storage, antioxidation and more[J]. Biochim Biophys Acta, 2009, 1790:589-599. |
| [9] | Ekman M, Sandh G, Nenninger A, et al. Cellular and functional specificity among ferritin-like proteins in the multicellular cyanobacterium Nostoc punctiforme[J]. Environ Microbiol, 2014, 16(3):829-844. |
| [10] | Le Brun NE, Crow A, Murphy ME, et al. Iron core mineralization in prokaryotic ferritins[J]. Biochim Biophs Acta, 2010, 1800:732-744. |
| [11] | Roy S, Saraswathi R, Chatterji D, et al. Structural studies on the second Mycobacterium smegmatis Dps:Invariant and variable features of structure, assemble and function[J]. J Mol Biol, 2008, 375:948-959. |
| [12] | Ekman M, Sandh G, Nenninger A, et al. Cellular and functional specificity among ferritin-like proteins in the multicellular cyanobacterium Nostoc punctiforme[J]. Environ Microbiol, 2014, 16(3):829-844. |
| [13] | Chiancone E, Ceci P. The multifaceted capacity of Dps proteins to combat bacterial stress conditions:Detoxification of iron and hydrogen peroxide and DNA binding[J]. Biochimica et Biophysica Acta, 2010, 1800:798-805. |
| [14] | Bellapadrona G, Ardini M, Ceci P, et al. Dps proteins prevent Fenton-mediated oxidative damage by trapping hydroxyl radicals within the protein shell[J]. Free Radical Biology & Medicine, 2010, 48:292-297. |
| [15] | Grove A, Wilkinson SP. Differential DNA binding and protection by dimeric and dodecameric forms of the ferritin homolog Dps from Deinococcus radiodurans[J]. J Mol Biol, 2005, 347:495-508. |
| [16] | Abbondanzieri EA, Vtyurina N, Meyer A. Nucleoid reorganization by the stress response protein Dps[J]. Biophysical Journal, 2014, 106(2)(Suppl 1):79a. |
| [17] | Vtyurina N, Dulin D, Docter M, et al. Chromosome reorganization by the highly cooperative Dps protein[J]. Biophysical Journal, 2015, 108(2)(Suppl 1):15a. |
| [18] | 赵忠朝, 张玉秀, 周正富, 等. 耐辐射异常球菌抗氧化保护机制的研究进展[J]. 生物技术进展, 2013, 3(2):109-114. |




