生物表面活性剂是一种由微生物合成的、结构多样的表面活性物质,包括糖脂、脂肽、脂蛋白、磷脂及中性类脂衍生物等[1]。目前,研究最广泛的生物表面活性剂是糖脂,其中对由铜绿假单胞菌产的鼠李糖脂研究最多[2]。鼠李糖脂具有乳化、增溶及降低界面张力等功能,在生物能源、石油化工、生物医药及食品等领域有较大应用前景[3, 4, 5, 6, 7]。目前较低的产量和过高的生产成本限制了鼠李糖脂在工业上广泛应用,因此获得一株高产菌株,对于鼠李糖脂工业化生产至关重要。常压室温等离子体诱变是一种新型的育种技术,该技术可以快速高效地突变各类微生物,已成为获取高产菌株的有效方法[8]。
本研究对本实验室筛选并保存的产鼠李糖脂菌株Pseudomonas aeruginosa C3进行常压室温等离子体诱变,筛选出一株遗传性状稳定的高产菌株,并通过单因素实验进一步对产脂培养基和发酵条件进行优化,最后研究产物鼠李糖脂对枯草芽孢杆菌细胞壁的影响,旨在选育鼠李糖脂高产菌株。
1 材料与方法 1.1 材料 1.1.1 菌株及试剂菌种铜绿假单胞菌(Pseudomonas aeruginosa C3),枯草芽孢杆菌(Bacillus subtilis CL)由本实验室分离筛选获得; 酵母粉、蛋白胨购自英国Oxoid公司,苔黑酚购自美国 Aladdin公司,其他试剂均为化学纯采购自国药集团化学试剂有限公司。
1.1.2 培养基筛选培养基:蓝色凝胶琼脂平板(%)[9]:葡萄糖 2,KH2PO4 0.07,Na2HPO4 0.09,NaNO3 0.2,MgSO4·7H2O 0.04,CaCl2·2H2O 0.01,CTAB 0.02,亚甲基蓝 0.000 5,琼脂 1.5,2 mL/L 微量元素溶液。微量元素溶液(%):FeSO4·7H2O 0.2,MnSO4·H2O 0.15。
初始发酵培养基(%):甘油 1,NaNO3 0.5,KH2PO4 0.1,Na2HPO4·12H2O 0.1,MgSO4 0.01,FeSO4·7H2O 0.02,CaCl2·2H2O 0.01,pH6.0。产酶培养基(%):乳糖1,K2HPO4 0.3,MgSO4·7H2O 0.03,蛋白胨1.5,玉米浆粉1.5,初始 pH 值 5.0-5. 5。
1.2 方法 1.2.1 鼠李糖脂含量检测方法采用苔黑酚法测定鼠李糖脂含量[10]。鼠李糖脂的鼠李糖基在浓硫酸作用下脱水形成糠醛类化合物,与地衣酚结合显示蓝绿色,在421 nm有最大吸收。根据鼠李糖标准曲线得到鼠李糖的浓度,鼠李糖脂的浓度为鼠李糖的3.4倍[11]。
1.2.2 ARTP诱变方法按照ARTP生物诱变育种机的操作流程。以氦气为气体,通气流量为10 L/min,作用距离2 mm,作用功率120 W[12]。将培养好铜绿假单胞菌C3的种子用0.9%的生理盐水稀至OD660=0.6,取10 μL菌液均匀涂布于无菌小铁片上,风干后放入育种机中进行诱变。为了寻找最佳诱变条件,设定处理时间(30、60、90和120 s),将处理后的样品稀释涂布平板,通过平板菌落计数以未处理样品为对照计算致死率。
1.2.3 突变株筛选方法采用蓝色凝胶平板筛选法进行初筛。平板中的十六烷基三甲基溴化铵(CTAB)、亚甲基蓝与阴离子表面活性剂鼠李糖脂发生络合作用,便形成蓝色光晕,通过测定蓝色晕圈直径与菌落直径之比,以此比值来初步衡量鼠李糖脂产量的高低。复筛:将初筛单菌落接种于种子培养基中,37℃,180 r/min培养12 h得到种子液,按6%接种量接入初始发酵培养基中,30℃,200 r/min培养5 d,培养液离心后取上清测定鼠李糖脂含量。
1.2.4 突变株SC-11发酵生产鼠李糖脂的培养优化采用发酵培养基,以浓度为1%的葡萄糖、豆油、甘油、玉米粉、蔗糖、乳糖、菜籽油和柴油为碳源,探讨不同碳源对突变株SC-11生长及产鼠李糖脂的影响,进而研究碳源浓度对发酵的影响。在培养基碳源优化的基础上,以硝酸钠、氯化铵、硝酸铵、尿素和硫酸铵为无机氮源(初始添加量为5 g/L),以酵母粉、牛肉膏、豆粕粉、花生粕及蛋白胨为有机氮源(初始添加量为10 g/L),分析氮源的种类对发酵的影响、优化其组成及浓度。
在培养基碳氮源优化的基础上进一步考察不同发酵条件对突变株SC-11发酵生产鼠李糖脂的影响。初始发酵条件为初始pH6.0,温度为30℃,接种量为6%,依次优化发酵初始pH(5、5.5、6、6.5、7、7.5、8和8.5)、发酵温度(20、25、30、35、40和45℃)和接种量(1%、2%、4%、6%、7%和8%),确定鼠李糖脂合成的最佳初始pH、最适温度、接种量。
1.2.5 鼠李糖脂对Bacillus subtilis CL产羧甲基纤维素酶与木聚糖酶的影响 1.2.5.1 鼠李糖脂的制备从斜面接种突变株SC-11到种子培养基,培养12 h后接入优化后的发酵培养基中,培养120 h后,发酵液经离心、有机溶剂萃取及硅胶柱层析得到鼠李糖脂[13]。
1.2.5.2 结构鉴定采用美国安捷伦公司的Agilent Q-TOF 6520质谱仪进行质谱分析。质谱条件为:电喷雾(ESI)负离子扫描模式,质谱扫描范围为200-1 000 m/z。采用Bruker AV-300核磁共振仪。取少量分离纯化后的鼠李糖脂,以DMSO-d6作为溶剂,进行波谱分析。
1.2.5.3 鼠李糖脂对Bacillus subtilis CL产羧甲基纤维素酶与木聚糖酶的影响实验向产酶培养基中分别加入相应浓度的鼠李糖脂和TritonX-100。按2%接种量将Bacillus subtilis CL种子液接入产酶培养基中,于35℃,200 r/min条件发酵培养,定时取样。发酵液在8 000 r/min下离心10 min,得到的上清液即为酶液。以不添加表面活性剂的培养基作为对照。
1.2.5.4 酶活测定羧甲基纤维素酶(CMCase)酶活的测定:取1%的羧甲基纤维素钠1.0 mL作为底物,加入0.5 mL适当稀释的发酵酶液,在45℃水浴保温30 min,立刻加入3 mL DNS试剂,沸水浴反应5 min,于540 nm下测OD值。将在上述条件下每分钟由底物产1 μmol还原糖所需的酶量定义为一个活力单位,用IU/mL表示。木聚糖酶(Xylanase)酶活的测定:取1%的木聚糖1.0 mL作为底物,加入0.5 mL适当稀释的发酵酶液,在45℃水浴保温30 min,立刻加入3 mL DNS试剂,沸水浴反应5 min后,于540 nm下测OD值。酶活定义同CMCase。
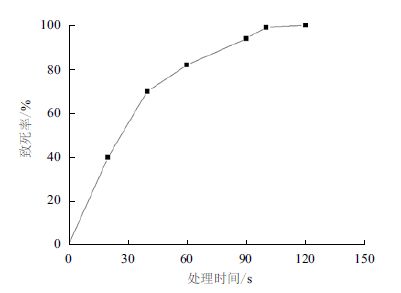
2 结果 2.1 等离子体处理时间对Pseudomonas aeruginosa C3的致死率选择合适的ARTP操作条件能够实现微生物的快速诱变。图 1可知,在1.2.2所述的设定功率下,注入离子体对菌株C3的损伤作用效果明显,随着等离子体射流处理时间的增加,其致死率逐渐增大。处理100 s时,菌株C3几乎全部致死。当存活率为1%-10%时,诱变处理对细胞的诱变效应较强,所以本研究采用90 s处理时间对菌株C3进行诱变。
|
| 图 1 菌株Pseudomonas aeruginosa C3的致死率曲线 |
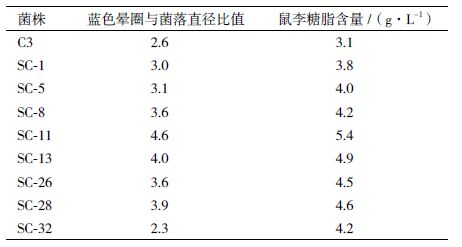
出发菌株C3经ARTP诱变处理,通过蓝色凝胶平板初筛得到40株菌,将其进行摇瓶复筛实验,产鼠李糖脂增幅较大的其中8株菌产鼠李糖脂结果(表 1)表明采用蓝色凝胶平板初筛结果与产糖脂能力基本成正比。其中突变株SC-11产鼠李糖脂量最高,且该菌株传代培养10次产糖脂量无显著变化,遗传性状稳定,表明蓝色凝胶平板筛选方法是一种有效的初筛方法。通过摇瓶发酵突变株SC-11的鼠李糖脂产量为5.4 g/L,比出发菌株提高了74.2%。
表 1 菌株C3的诱变选育结果
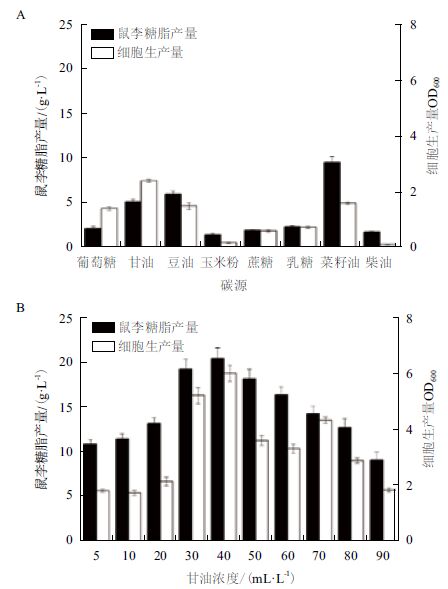
2.3 突变株SC-11产鼠李糖脂发酵培养优化 2.3.1 碳源对突变株SC-11产鼠李糖脂的影响碳源种类及碳源浓度对铜绿假单胞菌产鼠李糖脂的影响,见图 2。铜绿假单胞菌能利用不同碳源生成鼠李糖脂,疏水性碳源比亲水性碳源更适合生产鼠李糖脂。菜籽油对于产鼠李糖脂最为有利,而甘油对菌体生长最为有利。因此选取二者作为复合碳源。
|
| 图 2 碳源种类(A)及碳源含量(B)对合成鼠李糖脂的影响 |
向培养基中加入10 mL/L菜籽油,再加入不同浓度的甘油,其他成分和培养条件不变。考察不同浓度的甘油对产鼠李糖脂的影响。由图 2-B可知随着甘油浓度的增加,鼠李糖脂产量相应增加,当甘油的浓度为40 mL/L时,鼠李糖脂的产量为20.4 g/L,达到最高。因此甘油的最适宜添加量为40 mL/L。
2.3.2 氮源对突变株SC-11产鼠李糖脂的影响在培养基碳源优化的基础上,考察硝酸钠等10种氮源对突变株SC-11产鼠李糖脂的影响。结果(图 3)表明,硝酸钠最有利于鼠李糖脂的合成,而花生粕对菌体生长最为有利。以硝酸钠为氮源时,鼠李糖脂产量最高达22.4 g/L。鉴于硝酸钠和花生粕分别属于无机氮源和有机氮源,二者之间可能存在协同作用,因此选取二者作为复合氮源。
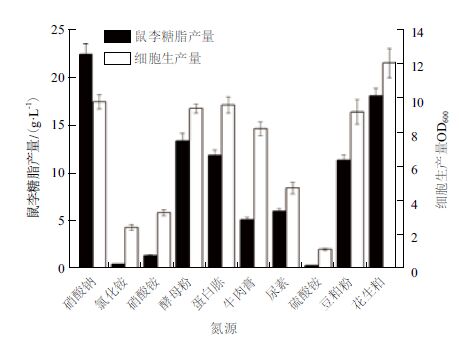
|
| 图 3 氮源种类对合成鼠李糖脂的影响 |
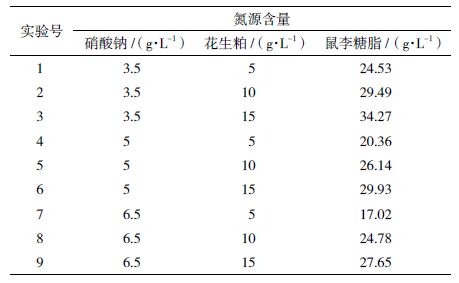
考察不同浓度的硝酸钠和花生粕对突变株SC-11产鼠李糖脂的影响,结果(表 2)显示,当硝酸钠浓度为3.5 g/L,花生粕浓度为15 g/L时,鼠李糖脂产量为34.27 g/L,达到最高。因此,确定硝酸钠浓度为3.5 g/L,花生粕浓度为15 g/L。
表 2 硝酸钠和花生粕浓度对合成鼠李糖脂的影响
2.3.3 发酵条件对突变株SC-11产鼠李糖脂的影响采用碳氮源优化后的培养基,优化突变株SC-11产鼠李糖脂的发酵条件。分别考察发酵条件初始pH值、温度与接种量对发酵产鼠李糖脂的影响,结果(图 4)表明,初始pH为6.5,温度为35℃,接种量为6%为鼠李糖脂的适宜的发酵生产条件,在上述发酵条件下鼠李糖脂产量为42 g/L。
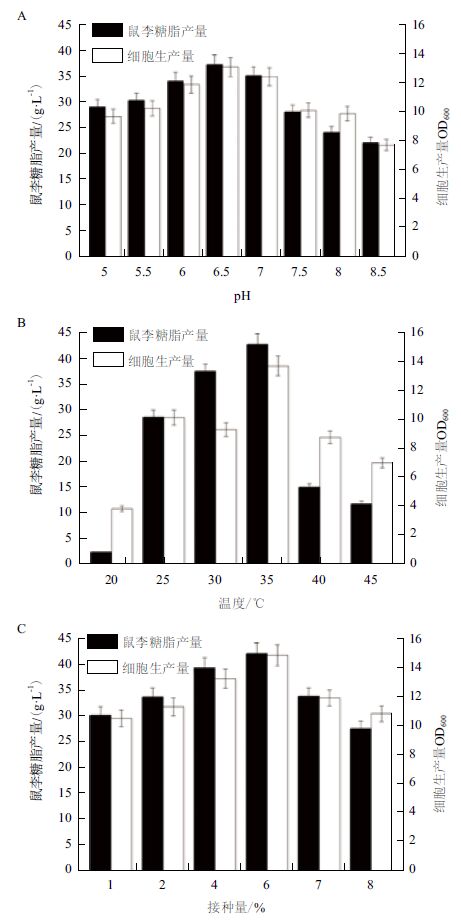
|
| 图 4 初始pH(A)、温度(B)与接种量(C)对合成鼠李糖脂的影响 |
参照方法1.2.5.1得到的样品,主要由化合物1与化合物2组成。利用质谱及核磁共振技术对两种化合物进行结构鉴定,结果如下:化合物1,ESI-MS m/z:503[M-H]-,提示其分子量为504,结合核磁共振谱可推出其分子为式C26H48O9 1HNMR(300 MHz,DMSO-d6)δ:0.83(3H、t、J1=6.3Hz和J2=6.9 Hz)0.85(3H、t、J1=6.4 Hz和J2=6.4 Hz)1.24(2H,m)、1.24(3H,m)、1.52(2H,m)、1.54(2H,m)、2.38(2H,m)、2.50(1H,m)、3.40(1H,m)、3.66(1H,m)、3.68(1H,m)、3.78(s)、4.22(1H,m)、4.83(s)和5.40(1H,m)13CNMR(75 MHz,DMSO-d6)δ:14.0、13.9、17.2、22.5、25.0、24.5、29.0、29.1、29.3、29.6、31.6、31.7、34.4、39.0、39.4、67.8、70.4、71.1、71.3、71.5、73.3、95.4、171.3和173.7。结果表明该化合物为单鼠李糖脂。
化合物2,ESI-MS m/z:649[M-H]-,提示其分子量为650,结合核磁共振谱可推出其分子式为C32H58O13。1HNMR(300 MHz,DMSO-d6)δ:0.85(3H、t和J1=J2=6.4 Hz)1.10(1H,d,j=5.7 Hz)1.11(1H,d,j=5.7Hz,)1.24(1H,m),2.34(1H,m),2.43(2H,d,j=5.0Hz)、3.13(1H,m)、3.19(1H,m)、3.41(1H,m)、3.41-3.46(1H,m)、3.51(1H,m)、3.61(1H,s)、3.91(1H,m)、4.69(1H,s)、4.79(1H,s)和5.12(H,m)。13CNMR(75 MHz,DMSO-d6)中δ:13.9、17.7、17.8、22.1、22.0、24.0、24.7、28.6、28.8、29.0、31.2、40.1、40.3、68.7、68.8、70.1、70.2、70.5、71.5、71.9、72.1、73.2、77.1、97.7、101.2和170.2。结果表明该化合物为双鼠李糖脂。
2.5 鼠李糖脂对Bacillus subtilis CL产羧甲基纤维素酶与木聚糖酶的影响近年来,通过加入表面活性剂加强细胞的通透性促进微生物产酶的研究得到越来越多的重视。本研究选取了Triton X-100 和鼠李糖脂添加到Bacillus subtilis CL产酶培养基中进行对比实验,考察了表面活性剂对菌株CL产羧甲基纤维素酶与木聚糖酶的影响。鼠李糖脂的添加量经初步优化表明,浓度为0.01%时,对Bacillus subtilis CL产羧甲基纤维素酶与木聚糖酶促进作用最大,羧甲基纤维素酶活与木聚糖酶活达到最高。在此条件下,菌株CL产胞外酶木聚糖酶活最高达到10.12 U/mL,与对照相比提高了18.3%(图 5-A)。菌株CL产羧甲基纤维素酶活最高达到17.19 U/mL,与对照相比提高了12.9%(图 5-B)。而TritonX-100对菌株CL产羧甲基纤维素酶与木聚糖酶均有明显的抑制作用。
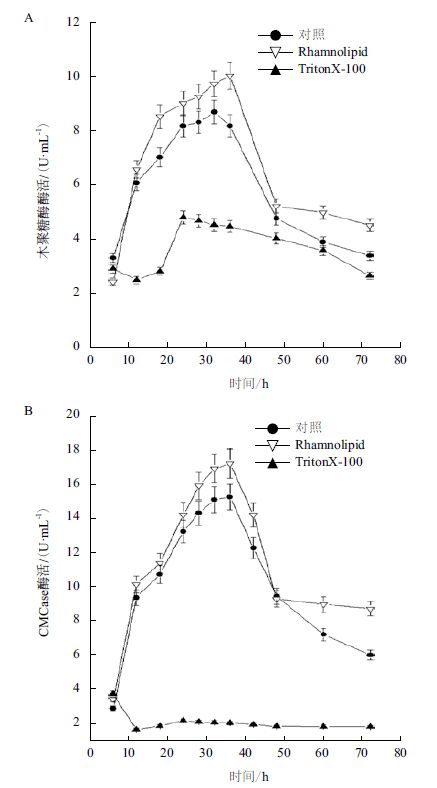
|
| 图 5 表面活性剂对Bacillus subtilis CL产木聚糖酶(A)及羧甲基纤维素酶的影响(B) |
关于鼠李糖脂高产菌株的筛选的报道有很多。沈微等[14]采用紫外线照射与UV+LiCl复合诱变的手段,对P. aeruginosa BS-03的野生型菌株进诱变,获得出一株高产正突变株,鼠李糖脂产量与出发菌株相比产量提高了65.85%,达到6.8 g/L。秦新政等[15]用产物诱变的方法筛选到一株遗传性状稳定的高产突变株,使鼠李糖脂产量比出发提高了57.14%。然而通过ARTP诱变育种方法诱变选育鼠李糖脂高产菌株并未报道过。本研究的筛选结果表明ARTP诱变育种方法可快速有效地诱变鼠李糖脂高产菌株,该菌株的诱变筛选为进一步工业化应用研究奠定了基础。
底物转化率对于鼠李糖脂的工业化应用十分重要,目前鼠李糖脂产量一般为30-40 g/L左右,底物转化率相对较低。例如,马满英等[16]报道的假单胞菌AB93066鼠李糖脂产量为56 g/L,产率为0.47 g/g底物。时进刚等[17]报道的的铜绿假单胞菌AB93066鼠李糖脂产量为30-40 g/L,产率为0.67 g/g底物。Giani等[18]报道铜绿假单胞菌DSM 7108和DSM 2874的鼠李糖脂产量为70-120 g/L,产率为0.68 g/g底物。而本研究经过优化后鼠李糖脂摇瓶发酵产量为42 g/L,产率为0.7 g/g底物,具有较高的产量和底物转化率。
鼠李糖脂促进微生物(多为真菌)产胞外酶的研究已有报道。例如Liu等[19]报道的鼠李糖脂促进黄孢原毛平革菌产的羧甲基纤维素酶活与木聚糖酶活分别提高了13.25%和16.27%。Wang等[20]报道的鼠李糖脂使青霉菌产的羧甲基纤维素酶活提高了48.5%。刘佳等[19]报道的鼠李糖脂使绿色木酶产的羧甲基纤维素酶活提高了1.6倍。一般认为提高酶活的主要原因是表面活性剂改变了微生物细胞膜的渗透性,微生物所分泌的胞外酶更加容易透过细胞膜运输到细胞外部[21]。本研究通过添加微量的鼠李糖脂使枯草芽孢杆菌产的羧甲基纤维素酶活与木聚糖酶活分别提高了12.9%和18.3%。微量的鼠李糖脂通过加强细胞通透性来提高酶活,而对发酵菌体影响小,这一特性有望应用于其它胞外酶的研究。
4 结论通过对出发菌株进行常压室温等离子体诱变选育,获得了生物表面活性剂鼠李糖脂高产诱变菌株SC-11,鼠李糖脂产量达到5.4 g/L,比出发菌株提高了74.1%。进一步对产鼠李糖脂的摇瓶发酵培养基和发酵条件进行了优化,摇瓶优化后的鼠李糖脂产量可达42 g/L,产率为0.7 g/g底物,具有较高的底物转化率。
研究考察了通过发酵所得的鼠李糖脂对液态发酵过程中枯草芽孢杆菌产羧甲基纤维素酶与木聚糖酶的影响。结果表明,添加0.01%的鼠李糖脂对枯草芽孢杆菌产纤维素酶有促进作用,使羧甲基纤维素酶活与木聚糖酶活分别提高12.9%和18.3%,酶活分别达到17.19 U/mL和10.12 U/mL。
| [1] | Desai JD, Banat IM. Microbial production of surfactants and their commercial potential[J]. Microbiology and Molecular Biology Reviews, 1997, 61(1):47-64. |
| [2] | 钱欣平, 阳永荣, 孟琴, 等. 生物表面活性剂对微生物生长和代谢的影响[J]. 微生物学通报, 2002, 29(3):75-78. |
| [3] | 左晶, 王学川. 生物表面活性剂的应用[J]. 化学工业与工程技术, 2005, 26(2):23-26. |
| [4] | Nitschke M, Costa SG, Contiero VAO. Biosurfactants in food industry[J]. Biotechnology Progress, 2007, 21(3):252-259. |
| [5] | Banat IM, Makkar RS, Cameotra SS. Potential commercial applications of microbial surfactants[J]. Applied Microbiology and Biotechnology, 2000, 53(5):495-508. |
| [6] | Singh P, Cameotra SS. Potential applications of microbial surfactants in biomedical sciences[J]. Trends in Biotechnology, 2004, 22(3):142-146. |
| [7] | Wu ZB, Zhong H, Yuan XZ, et al. Adsorptive removal of methylene blue by rhamnolipid-functionalized graphene oxide from wastewater[J]. Water Research, 2014, 67(5):330-344. |
| [8] | 金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报, 2011, 27(3):461-467. |
| [9] | Pinzon NM, Ju LK. Improved detection of rhamnolipid production using agar plates containing methylene blue and cetyltrimethylammo-nium bromide[J]. Biotechnology Letters, 2009, 31(3):1583-1588. |
| [10] | Koch AK, Kappeli O, Fiechter A, et al. Hydrocarbon assimilation and biosurfactant production in Pseudomonas aeruginosa mutants[J]. Journal of Bacteriology, 1991, 173(13):4214-4219. |
| [11] | Benincasa M, Contiero J, Manresa MA, et al. Rhamnolipid produc-tion by Pseudomonas aeruginosa LBI growing on soapstock as the sole carbon source[J]. Food Engineering, 2002, 54(4):283-288. |
| [12] | 柏中中, 孙家铎, 吴斌. 基于常压室温等离子体技术诱变选育D-乳酸高发酵速率菌株[J]. 食品工业科技, 2013, 34(24):173-176. |
| [13] | Liu J, Yuan X, Zeng Z. Effect of biosurfactant on cellulose and xylanase production by Trichoderma viride in solid substrate fermentation[J]. Process Biochemistry, 2006, 41(11):2347-2351. |
| [14] | 沈蔚, 杨树林, 宁长发, 等. 铜绿假单胞菌(Pseudomonas aeruginosa)BS-03的诱变育种及产鼠李糖脂类生物表面活性剂的摇瓶工艺初探[J]. 食品与发酵工业, 2004, 30(12):26-30. |
| [15] | 秦新政, 杨新平, 唐娴, 等. 产物诱变选育鼠李糖脂高产菌株的研究[J]. 新疆农业科学, 2008, 45(6):1060-1063. |
| [16] | 马满英, 施周, 刘有势, 等. 假单胞菌AB93066产鼠李糖脂发酵条件的优化[J]. 精细化工, 2008, 25(3):221-225. |
| [17] | 时进钢, 袁兴中, 曾光明, 等. 鼠李糖脂生物表面活性剂及其在生活垃圾堆肥化中的应用:中国, 1207383[P]. 2005-06-22. |
| [18] | Giani C, Wullbrandt D, Rothert R, Meiwes J. Pseudomonas aeruginosa and its use in a process for the biotechnological preparation of L-rhamnose:United Patent, 5658793[P]. 1997-08-19. |
| [19] | Liu XL, Zeng GM, Tang L, et al. Effects of dirhamnolipid and SDS on enzyme production from Phanerochaete chrysosporium in submerged fermentation[J]. Process Biochemistry, 2008, 43(11):1300-1303. |
| [20] | Wang HY, Fan BQ, Li CH. Effects of rhamnolipid on the cellulase and xylanase in hydrolysis of wheat straw[J]. Bioresource Technology, 2011, 102(11):6515-6521. |
| [21] | 刘佳, 袁兴中, 曾光明, 等. 表面活性剂对绿色木霉产纤维素酶影响的实验研究[J]. 中国生物工程杂志, 2006, 26(8):62-66. |