miRNA(microRNA)是近年来在真核生物中发现的一类内源、不编码蛋白、长度为 20-24 nt的单链小分子 RNA[1]。miRNA能与靶mRNA分子的3' UTR区特异性配对,引起靶mRNA的降解或者抑制其翻译,从而实现对靶基因在转录后水平上的负向调控[2]。miR319最初是通过对jaw-D基因突变体的正向遗传分析发现的,它可通过靶向TCP转录因子来调控植物叶片的形态建成与生长发育[3]。过表达miR319基因会引起植物表型变化,包括植物叶片边缘锯齿化、果实畸形、叶片向上生长等一系列异常的表型[4]。Schommer[5]进一步发现miR319还可调控茉莉酸生物合成,从而调控植物叶片的衰老进程。此外,miR319还在花瓣和雄蕊的发育过程中起着关键的调控作用,如miR319a成熟序列的一个碱基发生突变,会导致miR319功能缺失,引起花瓣变短变窄、雄蕊变短等[6]。
在低温胁迫下,Sunkar 等[7]发现miR393 和miR319c在拟南芥冷害下强烈上调表达; 贾蓓[8]通过基因芯片在水稻中发现miR319a/b在低温处理0.5 h即有表达量的下调。Wang等[9]进一步发现过量表达miR319b能提高转基因水稻的耐低温能力,同时提升转基因植株的脯氨酸含量和逆境后的成活率。与此同时,其靶基因OsPCF6和OsTCP21在转基因植株中下调表达,推测miR319b可能是通过活性氧的清除实现耐低温能力的提升。
木薯是典型的热带块根作物,其耐低温能力及特性与拟南芥及以种子为收获目标的水稻可能存在差异,本研究旨在针对miR319在木薯低温胁迫过程的响应特点做初步的探索。
1 材料与方法 1.1 材料木薯品种SC124和C4。
1.2 方法在室外大田采用种茎繁殖的方法将木薯SC124和C4种植在体积为3 L的塑料盆,每周浇施1/4浓度的霍格兰大量元素营养液和阿农微量元素营养液,常规病虫害管理3个月后,将盆栽苗移到SANYO人工气候培养箱内进行低温处理。实验共设置4个处理:驯化处理(acclimation treatment,AT:25℃梯度降温至14℃后开始计时); 驯化后寒害(acclimation hurt,AH:在经历5 d驯化处理后再由14℃梯度降温至4℃); 非驯化寒害(non-acclimation hurt,NAH:25℃直接降温至4℃)和对照(negative control,NC:一直维持25℃的温度)。
4个处理的前中后3个时间点的功能叶混合成4个样品:NC(0 d、5 d和10 d),AT(6 h、24 h和5 d),AH(6 h、24 h和5 d)和NAH(6 h、24 h和5 d),这4个样品抽提的RNA同时用于小RNA的定量分析和靶基因的定量分析。miRNA的RT-PCR检测参考Wang 等[10]的Multiplexed RT-PCR方法,内参基因为U6,靶基因的特异引物设置在跨越miRNA与靶基因结合区的前端(5'端)和后端(3'端),内参基因为Actin。
2 结果 2.1 miR319与其靶基因在SC124的4个处理转录组中的消长关系前期对SC124的4个处理中的根茎叶混合样品进行了小RNA测序和转录组测序,两组数据中miR319a与其靶基因之间的表达量关系如表 1所示:miR319在NAH中相对于NC来说下调表达了6.6倍,4个靶基因则是上调表达7-155倍之多,涉及的基因有MYB33、TCP4、GSTU8及一个未知功能基因(以下简称Unknown)。而在其他两个低温处理与对照的比较中未发现miR319与其靶基因在表达量上存在消长关系。
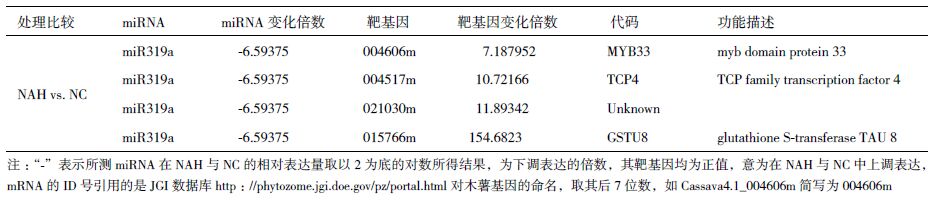
选取每个处理前中后3个时间点功能叶混合样品对miR319a做的定量分析,结果(图 1-A)显示,miR319a在C4和SC124两个品种中的4个处理的响应模式一致,均呈“反Z”型。4个处理的两两比较分析(图 1-B)表明,SC124的变化幅度显著大于C4相应处理间的表达量变化,尤其是在包含NAH处理的比较中,如NAH/NC和NAH/AT,两品种间的差异最大(图 1-B中两曲线中间的间隔宽度,分别为2.269和3.21),而在AT/NC(0.941)和AH/NC(0.937)中的差距则要小许多。这一结果与小RNA测序结果中仅在NAH中差异表达较大相一致。
|
| A:纵坐标为U6的CT值-目的基因的CT值; B:纵坐标为一组处理间的相对表达量取Log2的值,如AT/NC表示驯化处理与对照的相对表达量,相对表达量计算公式为2 -△△CT,式中△△CT =(△CT sample - △CT control),△CT = CT(target)-CT(reference) 图 1 四个处理条件下miR319a与内参基因U6的相对表达量(A)及两两处理间的相对表达量(B) |
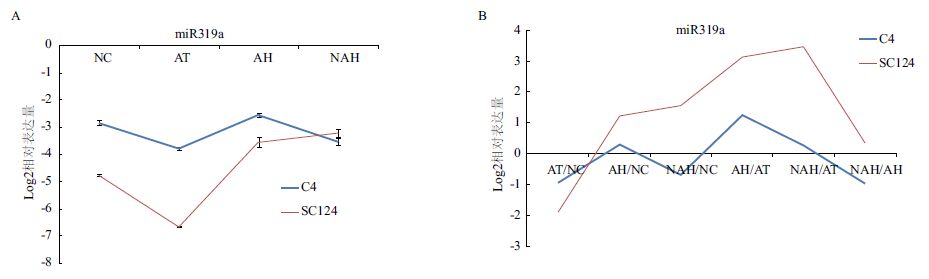
结合miR319与其4个靶基因在同一套样品中的表达量变化(图 2)显示,miR319在C4和SC124两个品种的NAH处理中都具有明显此消彼长的关系,这与转录组数据相一致,且两品种间的变化趋势相反,说明这一miRNA表达量上的差异可能在这两个木薯品种的耐低温能力差异上起着重要作用。而在AH处理下,尤其是AT处理下无明显的规律。
|
| 图 2 miR319a与4个靶基因在C4和SC124两个品种之间的表达模式 |
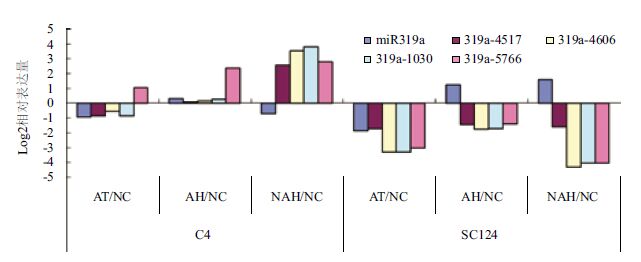
将4个处理中miR319a及其靶基因与NC的相对表达量进行散点图分析(图 3),可得出以下拟合方程,miR319a与靶基因之间的相关系数表现出一定的变化:C4中miR319a与3个靶基因(TCP4、MYB33和Unknown)的相关系数均大于SC124中miR319a与相应靶基因的相关系数,而miR319a与GSTU8(5766)的相关系数却是在SC124中大于C4中的相关系数。miR319与靶基因的相关系数及R2值在两个品种中从大到小的顺序一致,依次为MYB33>Unknown>TCP4>GSTU8。
|
| A:miR319与靶基因miR319a-4517(TCP4)在C4中的相关性分析; B:miR319与靶基因miR319a-4517(TCP4)在SC124中的相关性分析; C:miR319与靶基因miR319a-4606(MYB33)在C4中的相关性分析; D:miR319与靶基因miR319a-4606(MYB33)在SC124中的相关性分析; E:miR319与功能未知靶基因miR319a-1030(Unknown)在C4中的相关性分析; F:miR319与功能未知靶基因miR319a-1030(Unknown)在SC124中的相关性分析; G:miR319与靶基因miR319a-5766(GSTU8)在C4中的相关性分析; H:miR319与靶基因miR319a-5766(GSTU8)在SC124中的相关性分析。图中横坐标和纵坐标分别为miR319a与靶基因在NC/NC、AT/NC、AH/NC和NAH/NC四组比较中的相对表达量 图 3 miR319a与其靶基因在两个品种中4个处理间的相关性分析 |
miRNA在植物中一般是通过对其靶基因的mRNA进行剪切,从而实现其对靶基因的负向调控,从我们的研究结果可以看出,剪切是具有时间、部位、处理方式及品种特异性。本研究发现miR319a在C4和SC124两个木薯耐低温能力不同的品种中的4个低温胁迫处理表现大体一致,且在SC124中的变化幅度要大于C4中的变化幅度,尤其是在NAH(从正常的25℃直接降到4℃的非驯化低温伤害处理)中两个品种的差别最大。由此可见,miR319a在未经过驯化的NAH下品种差异最大,而通过14℃的驯化处理(包括AT和AH),miR319所介导的靶基因调控在两个品种低温响应模式趋于一致。前期表型分析结果发现,在NAH处理下木薯植株在4个低温处理中低温伤害最显著,且SC124的表型伤害要重于C4的低温伤害[11],说明NAH处理下两品种miR319a表达量变化某种程度上表征了木薯低温胁迫的程度。
miR319是目前研究比较深入的植物miRNA,它的靶基因涉及TCP转录因子和MYB转录因子,调控着植物叶和花的发育及叶片的衰老。前人研究证明在叶的发育阶段,靶基因TCP转录因子负调控叶的发育进程,而在叶片的衰老阶段,靶TCP转录因子正向调控叶的衰老进程[5, 12]。这个现象与木薯miR319a在低温胁迫伤害表现最明显的NAH处理中呈现出与靶基因明显的消长关系不谋而合,因为在NAH处理中的低温伤害中大量的叶片出现黄化、萎蔫,甚至干枯掉落,是明显的衰老过程。而对于AT和AH这两个经历了14℃亚低温驯化过程的处理来说,明显削弱了miR319对衰老的正向促进作用,起到一种类似于延缓衰老的客观效果,这与亚低温驯化减轻低温胁迫伤害的生产实践经验也是一致的。
由miR319a与4个不同靶基因的表达量的拟合方程来看,拟合方程的斜率(即相关系数)和R2值(即拟合程度)都不是很显著,原因之一可能是:仅依靠miR319a一个成员与其4个共同的靶基因做消长关系的拟合方程可能会发生信息转换的不准确。因为miR319家族中有miR319a、miR319b、miR319c等3个成员,且3个成员在叶的生长发育中发挥着截然不同的功能[6],表达水平各不相同且有部分重叠,解决办法是用更为特异的stem-loop方法准确定量miR319的3个不同成员的表达量变化,进而区分哪个miR319成员在哪个处理下与哪个靶基因之间具有明显的消长关系。
miR319a与4个不同靶基因表达量的拟合方程中的相关系数表明,与miR319a相关系数从大到小的靶基因依次为MYB33>Unknown>TCP4>GSTU8。本研究组前期工作发现,在木薯低温胁迫的NAH处理中检测到miR319a对TCP4(4517)在miRNA与mRNA结合区的第8个碱基处有剪切作用,但miR319的另外一个基因GSTU8(5766)与miR319匹配区内未检测miR319a对它的剪切事件[13]。这进一步验证了miR319a与TCP4的拟合方程中的相关系数(-2.793,R2为0.136)也显著大于miR319a与GSTU8的相关系数(-0.091,R2为0.104)。此外,我们还发现比经典靶基因TCP4,与miR319a的相关系数更高的有MYB33和功能未知基因(021030 m)两个靶基因,预示着miR319的靶基因MYB33和Unknown处于更为优先的调控目标,MYB33作为miR319的靶基因主要在花的发育过程中起着重要的调控作用,如影响植物雄蕊的育性[14]。但miR319对MYB33和Unknown的调控作用在木薯的低温逆境适应性过程中起着怎样的作用,是下一步值得深入研究的问题。
4 结论成功克隆并报道了miR319a及其4个不同靶基因在两个木薯品种低温胁迫的响应特征,通过miRNA与靶基因之间在不同低温处理间的比较分析表明,miR319a对MYB33和Unknown(021030m)两个靶基因的调控在木薯的低温适应性上有着重要作用,是木薯低温适应性遗传改良的重要候选基因。
| [1] | Jones-Rhoades MW, Bartel DP. Computational identification of plant microRNAs and their targets, including a stress-induced miRNA[J]. Molecular Cell, 2004, 14(6):787-799. |
| [2] | Schwab R, Palatnik JF, Riester M, et al. Specific effects of microRNAs on the plant transcriptome[J]. Development Cell, 2005, 8(4):517-527. |
| [3] | Palatnik JF, Allen E, Wu XL, et al. Control of leaf morphogenesis by microRNAs[J]. Nature, 2003, 425(6955):257-263. |
| [4] | Bartlett ME, Specht CD. Changes in expression pattern of the teosinte branched l-like genes in the Zingiberales provide a mechanism for evolutionary shifts in symmetry across the order[J]. American Journal of Botany, 2011, 98(2):227-243. |
| [5] | Schommer C, Palatnik JF, Aggarwal P, et al. Control of jasmonate biosynthesis and senescence by miR319 targets[J]. PLoS Biology, 2008, 6(9):e230. |
| [6] | Nag A, King S, Jack T. miR319a targeting of TCP4 is critical for petal growth and development in Arabidopsis[J]. Proc Natl Acad Sci USA, 2009, 106(52):22534-22539. |
| [7] | Sunkar R, Zhu JK. Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis[J]. Plant Cell, 2004, 16(8):2001-2019. |
| [8] | 贾蓓. 水稻miR319的耐冷功能分析与分子机制研究[D]. 哈尔滨:东北农业大学, 2012. |
| [9] | Wang ST, Sun XL, Hoshino Y, et al. MicroRNA319 positively regulates cold tolerance by targeting OsPCF6 and OsTCP21 in rice(Oryza sativa L. )[J]. PLoS One, 2014, 9(3):e91357. |
| [10] | Wang X. A PCR-based platform for microRNA expression profiling studies[J]. RNA, 2009, 15(4):716-723. |
| [11] | 周玉飞, 曾长英, 陈新, 等. 低温驯化对木薯耐寒性形态、生理特性的影响[J]. 热带农业科学, 2011, 31(6):1-6. |
| [12] | 罗茂, 张志明, 高健, 等. miR319在植物器官发育中的调控作用[J]. 遗传, 2011, 33(11):1203-1211. |
| [13] | Zeng CY, Chen Z, Xia J, et al. Chilling acclimation provides immunity to stress by altering regulatory networks and inducing genes with protective functions in cassava[J]. BMC Plant Biology, 2014, 14:207. |
| [14] | Millar AA, Gubler F. The Arabidopsis GAMYB-like genes, MYB33 and MYB65, are microRNA-regulated genes that redundantly facilitate anther development[J]. Plant Cell, 2005, 17(3):705-721. |