2. 中国农业科学院作物科学研究所/ 农作物基因资源与基因改良重大科学工程, 北京 100081 ;
3. 云南农业大学普洱茶学院,昆明 650201
2. Institute of Crop Science,Chinese Academy of Agricultural Sciences,Beijing 100081 ;
3. College of Longrun Pu-erh tea,Yunnan Agricultural University,Kunming 650201
点杂交是一种快速检测DNA、RNA和蛋白等生物分子种类和含量的简便方法,广泛应用于分子生物学、生物化学、免疫遗传学和医药、农业、食品等领域[1, 2, 3]。在点杂交实验中,先将样品点到介质上,然后用特异性探针进行杂交,最终依据检测到的杂交信号强弱判断样品中目标物的种类和含量。目前高通量和自动化的基因和蛋白芯片技术已成为高效、快速和大规模获取相关生物信息的重要手段[4],但芯片技术并不适合普通实验室使用,手工点杂交仍然是最常使用的点杂交技术。手工点杂交常用的杂交膜有NC膜、PVDF膜和尼龙膜,这类膜在实际使用时普遍存在点样点排列不整齐、上样体积受限制、单位面积样品数量较少、样品在杂交膜上容易扩散导致点样点的大小和形状不一致等问题[5, 6],限制了该技术的应用,有必要对点样环节加以改进。
本研究针对手工点样斑点杂交实验中存在的样品点密度小、点样体积受限制和点样点不规整等问题,通过对杂交膜的预处理,使样品富集和吸附在点样点部位,以期提高手工点样的通量和规范性。
1 材料与方法 1.1 材料 1.1.1 植物材料和试剂水稻、小麦和大豆均为常规品种,叶片采自中国农业科学院作物科学研究所实验温室,-80℃保存待用。鼠抗水稻看家蛋白抗体Anti-HSP购自北京华大蛋白公司;IRDye800标记的山羊抗鼠抗体购自宝生物工程有限公司。硝酸纤维素膜(nitrocellulose membrane,NC膜)和聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF膜)均为颇尔公司产品。低熔点石蜡(48-50℃)和其他试剂购自国药集团化学试剂公司。
1.1.2 主要仪器Odyssey CLX双色红外荧光成像仪为美国LI-COR公司产品。
1.1.3 缓冲液提取液:7 mol/L尿素,2 mol/L硫脲,4%(W/V)CHAPS,2 µg/μL DTT。洗脱液:0.01 mol TBST:10 mmol Tris,100 mmol NaCl,用0.1 mol HCl调pH为7.5,加入0.1% Tween-20。
1.2 方法 1.2.1 蛋白提取方法 蛋白质提取参考Herman等[7]方法改进。植物叶片液氮研磨,取0.2 g溶于1.5 mL提取液,置于冰上静置1 h;离心(12 000×g,4℃,15 min),上清液重复离心后加4倍体积预冷丙酮,-20℃放置过夜;离心(12 000×g,4℃,15 min),沉淀即为蛋白提取物。蛋白定量参照Bradford方法[8]。
1.2.2 膜预处理方法根据预设点样点的孔径、排列方式和密度,先制作塑料材质的柱状凸起模具。制作模具时需保证柱状凸起的直径和间距与预设点样点对应,且凸起部位平整。还可使用底面平整的V型底384孔深孔板等商品化的塑料孔板,以孔板的V型底作为模具的柱状凸起部位。预处理杂交膜前,将模具平放在用支撑平板托起的杂交膜上,再用固定夹固定模具和支撑平板,使模具的凸起部位与杂交膜紧密接触。然后将熔化的石蜡涂布于膜上非模具接触部位,待石蜡凝固后小心移走模具,确保预留的点样点无蜡质污染,同时使非点样部位具有疏水性。
1.2.3 点杂交方法点杂交实验参考Cheley等[9]方法,封闭和抗体孵育后用洗脱液清洗3次,每次10 min。
1.2.4 检测方法用LI-COR Odyssey CLX双色红外荧光成像仪直接扫描成像,选择800 nm绿光通道,膜成像分辨率设置为80 μm。
2 结果 2.1 杂交膜的预处理点杂交实验常用的杂交膜是NC膜和PVDF膜,这两种杂交膜均可以用柱状凸起模具和低熔点石蜡进行预处理。图 1为采用孔距4.5 mm,凸起部位直径1.2-2.4 mm的模具制备的预处理杂交膜,膜上浅色部分是保留了杂交膜原有特性的点样孔,深色部分则为被石蜡覆盖的疏水区域。经过预处理的杂交膜的点样点位置、大小和形状规范统一,使用时可根据需要选择不同孔径的膜。

|
| A:点样点孔径1.8-2.4 mm的NC膜;B:点样点孔径1.2-1.7 mm的NC膜;C:点样点孔径1.8-2.4 mm的PVDF膜;D:点样点孔径1.2-1.7 mm的PVDF膜 图 1 预处理后的杂交膜 |
将荧光染料IRDye800标记的山羊抗鼠抗体直接点在普通PVDF膜和经预处理的PVDF膜上,待膜干后用Odyssey CLX成像仪检测。结果(图 2)显示,经过预处理的膜上样品点形状整齐规范,且随着点样体积的增加荧光信号增强,而普通杂交膜上样品点大小明显随点样体积变化,并呈现不规则的形状。
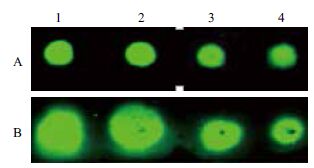
|
| A :预处理PVDF 杂交膜;B :普通PVDF 膜;1-4 :点样体积分别为2 μL、2×1 μL、1 μL、0.5 μL 图 2 预处理膜(A)和常规膜(B)手工点样结果的比较 |
采用尿素硫脲法进行了水稻、小麦和大豆叶片蛋白质样品制备,SDS-PAGE分析(图 3)显示蛋白质提取物条带多,得率高。结果说明,尿素硫脲法提取的3种植物叶片蛋白较完整,可以用于点杂交预处理膜的进一步实验验证。

|
| 1 :水稻;2 :小麦;3 :大豆 图 3 水稻、小麦和大豆叶片全蛋白的SDS-PAGE 分析 |
将多次提取的水稻、小麦和大豆蛋白分别点在经过预处理的NC膜和PVDF膜上,与水稻看家蛋白抗体Anti-HSP杂交,结果(图 4)显示在预处理PVDF膜上的水稻和小麦点样点均有较强信号,而在预处理NC膜的杂交信号较弱,其中大豆的信号几乎检测不到。
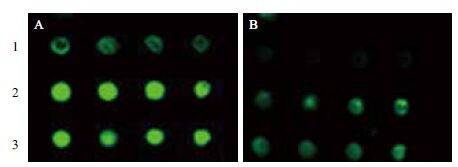
|
| 1 :大豆蛋白;2 :小麦蛋白;3 :水稻蛋白;A :预处理PVDF 膜;B :预处理NC 膜;点样体积:0.5 μL 图 4 水稻、小麦和大豆叶片蛋白与Anti-HSP 的预处理膜 点杂交 |
目前文献报道的手工点杂交实验普遍存在通量低和可视性较差等问题[5, 6],主要原因是样品在杂交膜上容易扩散和难以保证点样点规整一致。基于自动点样和扫描技术的高通量芯片分析技术解决了上述问题,在生物学和医药研究中发挥着重要的作用[10, 11, 12, 13],但芯片技术在便捷性和成本方面并无优势可言。
利用模具和石蜡对NC膜和PVDF膜进行预处理,使膜上除点样点外的区域具有疏水性,确保样品富集和吸附在点样部位,避免了手工点样时样品容易扩散和点样点不统一规范等问题。模具的孔径和孔间距可依据实际需要调整,以制备15×20 cm的预处理膜为例,采用孔距4.5 mm,孔径2.4 mm的柱状凸起模具,可得到1 452个点样孔,若孔距3.0 mm,孔径1.0 mm,则可制作出有3 300个点样孔的膜。采用更简单的方法,即使用底面平整的V底384孔深孔板做模具,则在7×14 cm的膜上可点384个样品。需要注意的是,石蜡加热熔化后,宜保持石蜡液体的温度高于熔点5℃左右,温度太高或太低均可能导致处理失败。涂布石蜡液时,还必须确保模具和膜的紧密接触,防止石蜡液渗入模具凸起部位和杂交膜之间。杂交膜经预处理后,仅在点样部位保留了杂交膜原有特性,可根据样品数裁剪所需要的预处理膜,实验成本低廉,操作简便。
直接点样检测和实际样品的点杂交实验证明,使用预处理NC膜和PVDF膜能保证点样点的位置、大小和形状统一规范,还能增加点样密度和点样体积。提取水稻、小麦和大豆叶片全蛋白进行的点杂交验证中,重复样品在预处理NC膜和PVDF膜上均得到类似的结果,其中水稻和小麦点样点的信号明显强于大豆信号,说明这种改进的手工点杂交实验流程可用于实际样品分析。验证结果还显示,经预处理的NC膜与普通膜的蛋白结合特性相似,检测灵敏度相对较低。
4 结论通过柱状凸起模具限定点样点的大小、排列方式和密度,利用石蜡的疏水特性防止非点样部位吸附样品,使预处理杂交膜的后续使用更方便。利用本方法获得的预处理杂交膜适用于手工点杂交实验,为解决点杂交实验过程中存在的问题提供了新的 选择。
| [1] | 夏佩莹, 李凤云, 汪万英, 等. HPV核酸探针斑点杂交技术在诊断尖锐湿疣中的应用[J]. 蚌埠医学院学报, 2000(3):163-164. |
| [2] | Wang X, Teng D, Guan Q, et al. Detection of genetically modified crops using multiplex asymmetric polymerase chain reaction and asymmetric hyperbranched rolling circle amplification coupled with reverse dot blot[J]. Food Chemistry, 2015, 173:1022-1029. |
| [3] | Lin M, Zhu J, Wang Q, et al. Development and evaluation of a reverse dot blot assay for the simultaneous detection of common alpha and beta thalassemia in Chinese[J]. Blood Cells, Molecules, and Diseases, 2012, 48(2):86-90. |
| [4] | Chang HJ, Huang MY, Yeh CS, et al. Rapid diagnosis of tuberculosis directly from clinical specimens using a gene chip[J]. Clinical Microbiology and Infection, 2010, 16(8):1090-1096. |
| [5] | Shi J, Birnbaumer L, Large WA, et al. Myristoylated alanine-rich C kinase substrate coordinates native TRPC1 channel activation by phosphatidylinositol 4, 5-bisphosphate and protein kinase C in vascular smooth muscle[J]. The FASEB Journal, 2014, 28(1):244-255. |
| [6] | Zhang CY, Chen GF, Liu Y, et al. Simultaneous detection of harmful algae by multiple polymerase chain reaction coupled with reverse dot blot hybridization[J]. Harmful Algae, 2014, 35:9-19. |
| [7] | Herman EM. Genetic modification removes an immunodominant allergen from soybean[J]. Plant Physiology, 2003, 132(1):36-43. |
| [8] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1):248-254. |
| [9] | Cheley S, Anderson R. A reproducible microanalytical method for the detection of specific RNA sequences by dot-blot hybridization[J]. Analytical Biochemistry, 1984, 137(1):15-19. |
| [10] | 蔡锦达, 齐建虹, 顾豪. 基于ARM9的滚筒式生物芯片点样仪的研发[J]. 仪器仪表学报, 2013(10):2198-2204. |
| [11] | 张润香. 中低密度生物芯片点样仪研制及亲疏水基底研究[D]. 厦门:厦门大学, 2007. |
| [12] | Li Y, Yu X, Guo X, et al. Gene chip analysis of the retrotransposons in rice implanted by the N+ ion beam[J]. Procedia Environmental Sciences, 2012, 12:1197-1202. |
| [13] | Liang Z, Dong M, Cheng Q, et al. Gestational diabetes mellitus screening based on the gene chip technique[J]. Diabetes Research and Clinical Practice, 2010, 89(2):167-173. |




