2. 山西农业大学信息学院,太谷 030800
2. College of Information,Shanxi Agricultural University,Taigu 030800
杂种优势(Hybrid vigor或Heterosis)是生物界普遍存在的一种现象,指两个具有不同性状的亲本杂交而产生的杂种,在生长势、抗逆性、繁殖力、适应性、产量和品质等方面优于亲本的现象[1]。从Shull[2]提出杂种优势这一概念起始,针对杂种优势现象已提出了一些假设,包括显性、超显性和上位性等。然而到目前为止,杂种优势形成的分子机理仍不清楚。
玉米是杂种优势利用最早,并在世界范围内普及推广取得最有成效的作物。目前,玉米基因组测序已经完成[3],基因信息数据库也有不少,如MaizeGDB(http://www.maizegdb.org/),PlantGDB(http://www.plantgdb.org/ZmGDB),Plant Proteome Database(http://ppdb.tc.cornell.edu),TIGR Maize Database(http://maize.jcvi.org)和Maize Assembled Genomic Island(http://magi.plantgenomics.iastate.edu/)等,基因序列信息极大丰富,这为玉米杂种优势形成的分子机理的解析奠定了基础。有关玉米杂种优势形成的分子机理的研究已有大量报道,涉及杂种优势QTL的定位和克隆[4]、杂交种与亲本之间的基因表达谱分析[5]、等位基因变异[6]、表观遗传调控[7]及基因组遗传变异[8]等多个方面。
蛋白质是生命现象的直接体现者,蛋白质组学技术是一种高通量的研究手段,对玉米杂种优势表现进行蛋白质组学研究有助于深入解析杂种优势形成的分子机制。在NCBI和中国知网文献数据库以杂种优势、玉米,蛋白质组学、玉米以及杂种优势、蛋白质组学、玉米为关键词进行综合搜索,结果在外文和中文数据库中分别找到204、191、10篇和294、75、6篇文献(图 1),说明在国内外已有大量关于玉米杂种优势的研究报道,但是蛋白质组学技术在玉米杂种优势上的应用研究还不是很多。进一步分析发现,有关玉米杂种优势的蛋白质组学研究主要涉及根系、叶片、种子胚和幼穗等性状。
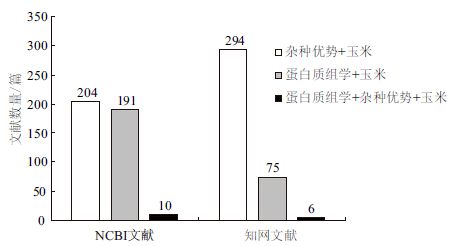 |
| 图 1 NCBI 和中国知网文献数据库文章数目统计结果 |
一般来说,亲缘关系越远,遗传差异越大,杂种优势越明显。早期,美国玉米带玉米的杂种优势表现归功于北方硬粒和南方马齿之间巨大的遗传差异,从而使两个杂种优势群的标准测验种B73和Mo17组配的杂交种具有较大的杂种优势,并且成为美国玉米带很长一段时间内主推的杂交种[9]。Hoecker等[10]对4个德国自交系及其杂交产生的12个正反交杂交种的根系性状进行了研究,结果显示,侧根密度的中亲优势值在12个杂交种中为51%-130%,发芽后3-7 d的杂交种初生根长度的中亲优势值为17%-25%。王元东等[11]采用NcⅡ遗传交配设计,在北京的春、夏两个环境背景下,分析了9个P群自交系及来自我国主要杂种优势群的8个骨干自交系的杂交种表现。研究发现,P群自交系与我国塘四平头、旅大红骨、改良Reid、改良Lancaster等主要杂种优势类群的8个骨干自交系均具有较强的杂种优势,是一个相对独立的新的杂种优势群,其中P群种质与国内塘四平头群骨干系和旅大红骨群骨干系产量杂种优势表现最为突出[11]。Springer和Stupar[12]总结前人研究结果,对玉米B73/Mo17杂交组多个性状进行了统计分析,结果显示穗粒重杂种优势最高,籽粒产量和苗期生物量次之,而开花期和节间数杂种优势为最低。综合来看,这些结果说明不同组合杂种优势值存在较大差异,而即使同一组合,不同性状的杂种优势表现程度也不一致。
2 玉米杂种优势的蛋白质组学研究 2.1 对种子胚的研究种子胚是植物的雏形,对植物起始分化起决定性作用。目前,种子发育生物学是分子生物学领域研究的热点之一,同时也是蛋白质组学研究的重要方向。
2.1.1 对发育早期胚的研究研究表明,玉米种子胚在授粉后6 d和8 d即表现出杂种优势[13, 14],说明杂种优势出现在玉米胚发育的早期。Marcon等[15]以玉米正反交杂交种及其亲本UH005和UH250授粉后25 d和35 d未成熟胚为材料,统计分析发现,随着时间的推移,相较25 d,在授粉后的35 d,当代种子胚杂种优势值降低了一半左右,同样说明种子胚的杂种优势集中体现在发育的早期。原因可能在于种子成熟过程中受种皮等的影响,导致胚的杂种优势表现越来越不明显。同时显微观察发现,杂交种中根原基的出现要远远早于亲本,接着利用双向电泳技术构建了亲本和正反交杂交种授粉后25 d和35 d未成熟胚的蛋白差异表达谱,分析结果显示,非加性表达模式的蛋白占总蛋白的24%(141/597),涉及显性、超显性和部分显性3种表达模式。这些结果说明在种子胚发育的早期,在亲本和杂交种中的蛋白水平已经发生了明显的变化,而差异表达的蛋白可能与幼胚杂种优势的表现有关。蛋白功能鉴定结果表明,在幼胚杂种优势形成过程当中,一些葡萄糖代谢途径的蛋白发挥重要作用[15]。
2.1.2 对萌动胚的研究种子萌发是植物生命循环的关键时期,是植株建成的第一步,萌发的好坏直接影响到植物后续的生长和发育。Fu等[16]以郑单958、农大108、豫玉22、浚单20及浚单18等5个强优势组合萌动24 h的种子胚为材料,建立了玉米萌动胚的蛋白差异表达谱,分析发现,相较于每个杂交种的两个亲本,在上述5个杂交种中分别检测到257、363、351、242和244个蛋白点表现出非加性表达模式,均占总蛋白点数的40%以上。最近,Guo等[17]以玉米自交系综3、87-1及其杂交种为研究对象,对种子萌发速率统计分析发现,杂交种较两个亲本的种子萌发速率更快。进一步将干种子胚和萌动24 h的胚进行分离,建立亲本和杂交种蛋白差异表达谱,分析结果显示,在干种子胚和萌动24 h的胚中分别检测到134(11.75%)和191(13.24%)个蛋白点发生了差异表达,虽然差异表达的蛋白比例非常接近,但是同一表达模式的比例却相距甚远。例如,在自交系及其杂交种干种子胚和萌动24 h的胚中,加性表达的蛋白点数分别为71个(52.99%)和125个(65.45%),非加性表达的蛋白点数分别为63个和66个,其中,在杂交种萌动24 h的胚中超高亲和偏高亲表达的蛋白点数为36,远远高于干种子中的同类模式的差异表达蛋白点数(18个),而在干种子中表达模式为超低亲表达和偏低亲表达的蛋白点数为42个,是萌动24 h的胚中的两倍。对比两个研究发现,对不同组合的同一性状研究结果也不相同,如Fu等[16]在5个杂交组合里检测到40%以上的蛋白点为非加性表达,而Guo等[17]发现不超过6%(63/1140)的蛋白点在杂交种和亲本中表现出非加性表达模式,进一步说明了杂种优势分子机制的复杂。
蛋白功能鉴定结果表明,在萌动的胚的杂种优势形成上,一些氧化胁迫响应蛋白,如解毒蛋白(GST)、过氧化氢酶和烃基酸氧化酶等发挥重要作用,另外,涉及赤霉素和ABA信号通路的一些蛋白可能发挥着关键作用,如F-box蛋白(FBP)、GA受体蛋白、GTP结合蛋白和Rab28等[16, 17],甚至细胞分裂旺盛也可能是形成萌动胚的杂种优势的原因,如Guo等[17]检测到ACT2在杂交种中为超显性表达模式,结合转基因手段对ZmACT2基因进行了功能鉴定,结果发现异位表达该基因的拟南芥种子的萌发速率较野生型显著提高。同时这些结果也表明,杂种优势的形成是个复杂的过程,需要多个蛋白的参与,包括代谢、转录和蛋白翻译等功能的蛋白协助来完成[16, 17]。
2.2 对根系的研究根系是为植物提供水分和矿质营养的主要器官,在植物生长和发育过程中发挥重要的作用。鉴于玉米初生根对于植株的生长至关重要,Hochholdinger等[18]提出玉米苗期的初生根可作为早期形态学、组织学和生理学的研究分析模型。研究表明,玉米杂交一代苗期根系具有明显的杂种优势,但不同根系性状的优势表现因发育时期不同而不同[19]。Romagnoli等[20]以发芽24 h长出的初生根为材料,采用体外翻译的方法研究发现,在玉米杂交种中有33%的蛋白上调或特异表达。Hoecker等[21]以杂交种与亲本发芽后3.5 d的初生根为材料,分析发现,150个蛋白(49.3%)差异表达,其中76个为杂种增强或减弱表达。我们研究报道,在杂交种豫玉22及其亲本发芽后8 d的根系中有15.38%(172/1118)的蛋白点发生了明显的表达变化,其中10个蛋白杂种特异表达,其余蛋白点的表达水平在亲本的变异范围之内,涉及多种表达模式,其中单亲沉默类型为最多,占差异表达蛋白点的49.42%[22]。最近,Marcon等[23]以经典玉米自交系B73、Mo17及其正反交杂交种发芽后2-4 cm的种子根为研究对象,采用LC-MS技术对种子根中的蛋白进行了分离和鉴定,结果共检测到1 918个蛋白点,其中85个蛋白点至少在一个杂交种中表现为非加性表达模式。
核糖体蛋白是组成核糖体的重要成员之一,参与了蛋白质的生物合成。我们研究发现,核糖体蛋白L14e、L8e、S4和S8在玉米杂交种与亲本苗期根系中差异表达,其中L14e蛋白为杂种特异表达,L8e和S4蛋白为单亲沉默,S8为中亲表达[22]。Marcon等[23]研究也发现,核糖体蛋白在杂交种和亲本的种子根中表现为高亲或超高亲表达模式。据此推测,核糖体蛋白在玉米杂交种与亲本根系中差异表达可能与杂交种根系快速生长有关,进而造成了玉米根系杂种优势的表现。
2.3 在叶片上的研究叶片是维管植物营养器官之一,能够进行光合作用合成有机物,并有蒸腾作用,提供根系从外界吸收水和矿质营养的动力。有关玉米叶片杂种优势的蛋白质组学研究还较少,仅我国科学工作者有研究报道。如郭宝健等[24]首次以发芽第5天的第3片叶基部为材料,采用双向电泳技术,建立了玉米强优势杂交种Mo17×B73及其亲本的蛋白差异表达谱,结果显示,在检测到的630个蛋白质点中,有52个蛋白质点在杂交种与亲本之间的差异表达,涉及单亲沉默(15个)、偏高亲(13个)、偏低亲(8个)、杂种上调(6个)、杂种下调(7个)和杂种特异表达模式(3个)等6种表达类型。另外,Guo等[25]进一步分离了玉米杂交种和亲本第3片叶基部的细胞核,并进行了蛋白质组学分析,结果总共检测到441个蛋白点在核内表达,其中,52个蛋白点在杂交种和亲本中发生了差异表达,16个为非加性表达模式。蛋白功能鉴定结果显示,一个肌动蛋和一个组蛋白赖氨酸甲基转移酶EZ3在杂交种叶片中为偏高亲表达[24],而3个肌动蛋白和一个乙酰辅酶A合成酶在杂交种叶片的细胞核内也为偏高亲表达模式[25]。基于以上研究推测,在玉米叶片杂种优势形成的过程中,肌动蛋白在杂交种中的表达上调可能有利于细胞的形态建成,从而促进杂交种叶片的生长发育,而蛋白赖氨酸甲基转移酶EZ3和乙酰辅酶A合成酶在杂交种中的高丰度表达可能会促进杂交种中组蛋白的修饰过程,从而导致表观遗传现象出现。
2.4 在雌穗上的研究研究表明,在产量构成因素中,玉米杂交种在穗粒数上的优势最为明显[26, 27]。雌穗是产生籽粒的唯一器官,目前,有关玉米穗粒数杂种优势的分子机理研究仍主要依赖QTL和基因芯片等技术,已经定位了一些与产量相关联的QTL[26],也筛选出了一些差异表达基因[28, 29],但是在蛋白水平上的研究迄今仅有两篇。鉴于玉米开花期的幼穗代谢活力异常旺盛,其大小与产量显著相关的原因[30],所以两篇报道所用材料均为开花期的玉米雌穗。
Dahal等[30]以一个低杂优杂交种(B73×N192)和两个高杂优杂交种(B73×Mo17和B73×NC350)刚刚发生花丝的雌穗为研究对象,利用2D DIGE结合LC-Q-TOF MS鉴定技术研究发现,相较于低杂优杂交种B73×N1926,在两个高杂优杂交种中有6个蛋白点发生了差异表达,其中翻译延伸因子2亚基、t结合蛋白γ亚基和一个未知蛋白等3个蛋白在B73×Mo17和B73×NC350两个杂交种中的表达丰度要低于B73×N192杂交种,而甘油醛3磷酸脱氢酶(GADPH)、r40c1蛋白和谷胱甘肽S转移酶等3个蛋白则正好相反。此外,相较于低杂优杂交种B73×N1926,在B73×Mo17杂交种中的6个蛋白点和B73×NC3507杂交种中的7个蛋白点的表达水平发生了改变,其中在B73×Mo17杂交种中的6个蛋白有3个(3磷酸甘油酸激酶、DREPP2蛋白和细胞质苹果酸脱氢酶)为上调表达,另外3个(ATP依赖CLP蛋白酶、丝氨酸羟基脱氢酶和GST IIIA)为下调表达,而在B73×NC350杂交种中差异表达的7个蛋白中,2个β葡萄糖苷酶、果糖激酶1、线粒体MDH蛋白和肌动蛋白解聚因子3等5个蛋白上调表达,其余2个蛋白(类r40c1蛋白和盐胁迫响应蛋白)下调表达。进一步分离雌穗线粒体蛋白质组分析发现,在检测到的846个蛋白点中,有27个蛋白在高杂优杂交种和低杂优杂交种中发生了差异表达,其中9个蛋白点在两个高杂优杂交种中均为上调表达,分别是琥珀酸脱氢酶黄素蛋白、醛脱氢酶2、二氢硫辛酰胺脱氢酶、甲酸盐脱氢酶1、NADH脱氢酶I 24 kD亚基、脂肪酶、富甘氨酸RNA结合蛋白和两个未知蛋白,5个为下调表达,包括复合体I 75 kD亚基、茉莉酸诱导蛋白、GRBP7和两个未知蛋白。
最近,郭宝健等[31]以玉米强优势杂交种豫玉22及其亲本综3和87-1的花器官形成期雌穗为材料,采用高通量的2-DE和MALDI TOF MS技术进行研究。结果发现,在检测到的1 290个蛋白点中,有114个(8.84%)在杂交种与亲本之间的表达差异达到显著水平,其中65个蛋白点可解释为显性效应,另外34个可解释为超显性效应,其余为加性表达。蛋白鉴定结果表明,104个差异表达蛋白点涉及代谢、信号转导、能量、转录、蛋白质合成、蛋白运输与储藏、细胞生长与分裂、细胞结构、抗病防御、次生代谢、转座子及功能未知和假定蛋白等12个功能类别,其中海藻糖合酶和6-磷酸海藻糖合酶为单亲表达型,可能导致杂交种中海藻糖代谢途径的改变,从而影响玉米杂交种雌穗的发育,进而导致产量杂种优势的出现。
综上所述,在杂交种和亲本的幼穗中,大量蛋白发生了表达变化,其中参与糖酵解、TCA循环以及海藻糖代谢途径的蛋白可能在玉米穗粒数杂种优势的形成过程中起关键作用,同时这些结果也印证了杂种优势形成的分子机理异常复杂的说法,即使对于同一性状采用不同组合结果可能也有所不同。
3 结语杂种优势是生物界普遍存在的一种现象,虽然在农业生产中已广泛应用,但杂种优势形成的分子机理仍不清楚。玉米是杂种优势利用最早,并在世界范围内普及推广最有成效的作物。利用蛋白质组学技术,对玉米杂种优势形成的分子机理研究已经展开,涉及根系、叶片、种子胚等多个性状。综合来看,鉴定出的蛋白多为结构蛋白,而一些参与转录、翻译调控的蛋白则较少,这可能与这些调控蛋白存在特殊的亚细胞结构内,而且表达量较低有关。基于此,针对特定组织器官,分离出其亚细胞结构(叶绿体、线粒体和细胞核等)内的蛋白质,才有可能筛选到重要的调控因子,再结合全蛋白质组进行分析,或许能够更清楚地揭示调控蛋白和结构蛋白之间的关系。此外,蛋白质组学技术是一种高通量的研究手段,一次可以鉴定数千个蛋白,众多蛋白质在特定性状上的作用仅仅停留在推测水平上。转基因或基因沉默手段是鉴定基因生物学功能的有效方法,并有部分研究报道针对筛选出的基因进行了生物学功能鉴定[17],但也是选取了一两个基因。若想通过转基因或者基因沉默手段,同时进行成百上千个基因的生物学功能鉴定是绝对不可能的,这就要求蛋白质组学与表型组学、基因组学、代谢组学、转录组学等各相关学科联合起来,筛选出重要的调控基因,构建合理的分子调控网络,再有针对性的进行生物学功能鉴定,从多角度全面解释玉米杂种优势形成的分子机理。
| [1] | Shull GH. The composition of a field of maize[J] . Journal of Heredity, 1908(1):296-301. |
| [2] | Chen ZJ. Molecular mechanisms of polyploidy and hybrid vigor[J] . Trends in Plant Science, 2010, 15(2):57-71. |
| [3] | Schnable PS, Ware D, Fulton RS, et al. The B73 maize genome:complexity, diversity, and dynamics[J] . Science, 2009, 326(5956):1112-1115. |
| [4] | Pea G, Aung HH, Frascaroli E, et al. Extensive genomic characteriz-ation of a set of near-isogenic lines for heterotic QTL in maize(Zea mays L.)[J] . BMC Genomics, 2013, 14(1):61-75. |
| [5] | Ding HP, Qin C, Luo XR, et al. Heterosis in early maize ear inflorescence development:a genome-wide transcription analysis for two maize inbred lines and their hybrid[J] . International Journal of Molecular Sciences, 2014, 15(8):13892-13915. |
| [6] | Wei XX, Wang XF. A computational workflow to identify allele-specific expression and epigenetic modification in maize[J] . Genomics, Proteomics & Bioinformatics, 2013, 11(4):247-252. |
| [7] | Zhang M, Xie SJ, Dong XM, et al. Genome-wide high resolution parental-specific DNA and histone methylation maps uncover patterns of imprinting regulation in maize[J] . Genome Research, 2014, 24(1):167-176. |
| [8] | Lai JS, Li RQ, Xu X, et al. Genome-wide patterns of genetic variation among elite maize inbred lines[J] . Nature Genetics, 2010, 42(11):1027-1030. |
| [9] | 杨培珠, 钟国祥, 谢虹, 等. 玉米种质资源的背景与利用现状[J] . 中国农学通报, 2011, 27(5):25-28. |
| [10] | Hoecker N, Keller B, Piepho HP, et al. Manifestation of heterosis during early maize(Zea mays L.)root development[J] . Theoretical and Applied Genetics, 2006, 112(3):421-429. |
| [11] | 王元东, 陈绍江, 段民孝, 等. 玉米P群自交系与国内传统骨干系的杂种优势表现及其配合力分析[J] . 玉米科学, 2006, 14(4):21-25. |
| [12] | Springer NM, Stupar RM. Allelic variation and heterosis in maize:how do two halves make more than a whole?[J] . Genome Research, 2007, 17(3):264-275. |
| [13] | Wang FH. Embryological development of inbred and hybrid Zea mays L.[J] . American Journal of Botany, 1947:113-125. |
| [14] | Meyer S, Pospisil H, Scholten S. Heterosis associated gene expression in maize embryos 6 days after fertilization exhibits additive, dominant and overdominant pattern[J] . Plant Molecular Biology, 2007, 63(3):381-391. |
| [15] | Marcon C, Schu?tzenmeister A, Schu?tz W, et al. Nonadditive protein accumulation patterns in maize(Zea mays L.)hybrids during embryo development[J] . Journal of Proteome Research, 2010, 9(12):6511-622. |
| [16] | Fu Z, Jin X, Ding D, et al. Proteomic analysis of heterosis during maize seed germination[J] . Proteomics, 2011, 11(8):1462-1472. |
| [17] | Guo BJ, Chen YH, Zhang GP, et al. Comparative proteomic analysis of embryos between a maize hybrid and its parental lines during early stages of seed germination[J] . PLoS One, 2013, 8(6):e65867. |
| [18] | Hochholdinger F, Guo L, Schnable PS. Lateral roots affect the proteome of the primary root of maize(Zea mays L.)[J] . Plant Molecular Biology, 2004, 56(3):397-412. |
| [19] | Hochholdinger F. The maize root system:morphology, anatomy, and genetics[M] //Bennetzen JL, Hake SC(leds7). Handbook of maize:its biology, New York:Springer, 2009:145-160. |
| [20] | Romagnoli S, Maddaloni M, Livini C, et al. Relationship between gene expression and hybrid vigor in primary root tips of young maize(Zea mays L.)plantlets[J] . Theoretical and Applied Genetics, 1990, 80(6):769-775. |
| [21] | Hoecker N, Lamkemeyer T, Sarholz B, et al. Analysis of nonadditive protein accumulation in young primary roots of a maize(Zea mays L.)F1-hybrid compared to its parental inbred lines[J] . Proteomics, 2008, 8(18):3882-3894. |
| [22] | 冯万军, 张义荣, 姚颖垠, 等. 玉米杂交种与亲本苗期根系蛋白差异表达谱分析[J] . 自然科学进展, 2009, 19(6):619-627. |
| [23] | Marcon C, Lamkemeyer T, Malik WA, et al. Heterosis-associated proteome analyses of maize(Zea mays L.)seminal roots by quantitative label-free LC-MS[J] . Journal of Proteomics, 2013, 93:295-302. |
| [24] | 郭宝健, 隋志鹏, 李洋洋, 等. 玉米杂交种与亲本苗期叶片差异表达蛋白谱分析[J] . 中国农业科学, 2013, 46(14):3046-3054. |
| [25] | Guo BJ, Chen YH, Li C, et al. Maize(Zea mays L.)seedling leaf nuclear proteome and differentially expressed proteins between a hybrid and its parental lines[J] . Proteomics, 2014, 14(9):1071-1087. |
| [26] | Tang JH, Yan JB, Ma XQ, et al. Dissection of the genetic basis of heterosis in an elite maize hybrid by QTL mapping in an immortalized F2 population[J] . Theoretical and Applied Genetics, 2010, 120(2):333-340. |
| [27] | Ma XQ, Tang JH, Teng WT, et al. Epistatic interaction is an important genetic basis of grain yield and its components in maize[J] . Molecular Breeding, 2007, 20(1):41-51. |
| [28] | Li B, Zhang DF, Jia GQ, et al. Genome-wide comparisons of gene expression for yield heterosis in maize[J] . Plant Molecular Biology Reporter, 2009, 27(2):162-176. |
| [29] | Pea G, Ferron S, Gianfranceschi L, et al. Gene expression non-additivity in immature ears of a heterotic F1maize hybrid[J] , Plant Science, 2008, 174(1):17-24. |
| [30] | Dahal D, Mooney BP, Newton KJ. Specific changes in total and mitochondrial proteomes are associated with higher levels of heterosis in maize hybrids[J] . The Plant Journal, 2012, 72(1):70-83. |
| [31] | 郭宝健, 宋方威, 冯万军, 等. 玉米杂交种与亲本雌穗花器官形成期蛋白差异表达谱分析[J] . 作物学报, 2013, 39(5):845-854. |




