20世纪80年代以来,随着人类对微观世界的深入探索和研究,纳米技术成为一种备受关注的新兴技术,而纳米生物学被认为是纳米技术中最有潜力的领域之一。生物系统经过数百万年进化出了各种各样的纳米粒子:它们可能存在于细胞内或细胞外,可以由有机物或者无机物合成,并具有广泛的生物学功能[1]。天然纳米粒子大都由生物系统组装而成,功能各异,从简单的储存矿质元素到复杂的调控细胞信号传导都有它们的存在。常见的天然生物纳米粒子主要有脂质体蛋白、热休克蛋白、铁蛋白和数以万计的病毒等[2]。
作为天然合成的无机纳米粒子之一,铁蛋白纳米笼是一个古老而庞大的家族,广泛存在于厌氧和好氧微生物及从古生菌和细菌到高等动、植物体内,是生命活动所必需的蛋白之一[3]。当前的铁蛋白纳米笼的应用主要包括微量血清铁蛋白的临床检查、作为营养物质补充机体铁需求、纳米材料平台,纳米材料的生物呈递等[4]。本文将重点介绍铁蛋白在疾病诊断与治疗以及药物呈递与疫苗开发上的应用。
1 铁蛋白简介铁蛋白首先被发现并分离于马的脾脏组织[5],之后陆续在人类等哺乳动物[6, 7, 8]、植物[9]和微生物[10, 11]等多种生物体内发现了铁蛋白。自然合成的铁蛋白主要由一个矿物质内核和一个蛋白外壳组成。蛋白外壳由24个铁蛋白亚基自组装而成,其中每3个亚基组成一个三聚体亚单位,8个三聚体再组装成一个外径12 nm,内径8 nm的球形空心纳米笼状结构[12](图 1-A)。矿物质内核处于纳米笼状结构之中,其主要成分为水铁矿(5Fe2O3·9H2O),主要为起抗氧化剂作用的氧化结合位点[13]。内核中还包括不同数量的磷酸盐,植物和细菌的铁磷比大约为1∶1,而动物为1∶8[14]。铁蛋白纳米笼有许多基于蛋白的催化位点,可以用1-2个Fe2+以O2和H2O2为底物进行配位[15, 16]。催化启动利用新陈代谢产生的水合氧化铁合成铁蛋白的偶联反应。通常把没有矿物质内核的铁蛋白称为去铁铁蛋白[17]。去铁铁蛋白可以通过重组合成或者将矿物质内核溶解后分离获得。
 |
| 图 1 人铁蛋白内表面和外表面剖面图(A)铁蛋白H-亚基和L-亚基示意图(B) |
哺乳动物铁蛋白外壳通常由H和L两种亚基共同组成(图 1-B)。通常把由心脏中分离获得的铁蛋白称为H铁蛋白,而从肝脏中分离得到的铁蛋白称为L铁蛋白。此外,也有把分子量较大的铁蛋白称为H铁蛋白,而较小的称为L铁蛋白[16, 18]。不同组织铁蛋白中H和L亚基的比例不同,同时机体病理变化等也可以影响H和L亚基的比例[18]。H亚基和L亚基的区别在于H亚基含有亚铁氧化酶活性中心,从而在铁蛋白矿质内核形成过程中把二价铁离子氧化为三价铁离子[19, 20],而L亚基只起到辅助协同作用[21]。另外,根据铁蛋白的分布位置,可以分为胞内铁蛋白和分泌铁蛋白[22]。胞内铁蛋白主要包括胞质铁蛋白、线粒体铁蛋白和细胞核铁蛋白[23]。分泌铁蛋白则主要分布于血清、关节滑液和脑脊液中[24, 25, 26]。
铁蛋白非常稳定,能够耐受高温(70-80℃)和多种变性剂而不影响其天然蛋白结构[27, 28]。铁蛋白对pH敏感,在pH 2.0 的酸性条件下蛋白壳发生解体,而当pH 恢复到生理条件(pH 7.0)时,解体的蛋白亚基又能重新组装成完整的铁蛋白[29, 30]。铁蛋白可以由蛋白亚基自组装而成的特点使人们可以通过原核表达系统大批量生产重组铁蛋白。而基于其耐高温的特性使其可以通过简单的升温进行分离纯化,同时可以通过改变溶液的pH使其解聚和重组装向铁蛋白腔内装载药物或纳米颗粒[31]。铁蛋白外壳不仅可以通过化学方法进行修改,而且还可以通过基因融合进行修饰。铁蛋白纳米颗粒因其结构上的特殊性使其外表面、内表面和铁内核均可以被用于修饰(图 2)[30],事实上任何靶向标志物的配体均能用于铁蛋白纳米颗粒的修饰,这些独特的理化性质使其成为理想的多功能纳米载体。
1991年,英国巴斯大学Stephen Mann 实验室利用天然马脾铁蛋白为模板在马脾铁蛋白的空腔内合成磁性铁核[32, 33],这项工作开辟了仿生合成纳米颗粒的新领域。仿生合成的磁性铁蛋白具有生物相容性好,分散性好,粒径均一,易于靶向修饰等特点。目前国内外学者广泛应用的方法是利用大肠杆菌重组表达人H-铁蛋白获得空壳铁蛋白,并以此为模板仿生合成磁性铁蛋白[34]。这种方法是由Trevor Douglas 实验室于2006年建立的,其大大简化了铁蛋白的仿生合成步骤,极大地推动了铁蛋白在生物医学领域的应用。
2 铁蛋白的生物学功能铁蛋白的生物功能有可能起源于机体有效的调控环境中铁和铁与氧之间的一些特殊的化学反应的变化,从而避免自由基的副作用和生成难以溶解的铁锈。在厌氧生物体内存在的铁蛋白证明了矿物质内核的可逆合成的重要性。铁蛋白还可能是植物利用光合作用产生生命赖以生存的氧气的关键因子。而对哺乳动物而言,铁蛋白的缺失是致命的。铁蛋白对于人类和微生物的生存都有重要的作用[4]。
在正常条件下,铁蛋白的主要作用为维持机体内环境的铁平衡。作为机体最重要的必需微量元素之一,铁是许多蛋白质和辅酶的组成成分[17, 35],并参与机体多个氧化还原反应。此外,铁蛋白还可以通过捕捉和隔绝细胞内的不稳定铁而实现解毒功能。游离的二价铁离子可以导致DNA、脂质和蛋白质的损伤[36]。而铁蛋白中H 亚基具有亚铁氧化酶活性位点,能够将毒性极大的二价铁离子氧化为毒性较小的三价铁离子[20, 32],从而保护DNA和蛋白质免于亚铁离子的损伤[37, 38]。
研究表明,血清铁蛋白含量与很多疾病有关,血清铁蛋白的含量通常被作为缺铁性贫血和先天性血红蛋白缺乏症的检测指标,并且血清铁蛋白含量已经成为临床疾病监测和肿瘤筛查及复发的检测标志[39, 40]。临床实验研究表明睾丸生殖细胞瘤[41]、黑色素瘤[42, 43]、脑部恶性肿瘤[44]、肺癌[45]和急性白血病[46, 47]患者的血清铁蛋白含量均显著升高。血清铁蛋白作为肿瘤标志物已经成为肿瘤筛查的一个常规指标。此外,H-铁蛋白对恶性肿瘤的发生可能起到重要作用,并对于多种癌症可能是一个潜在的生物标志物。Wang 等[48]研究发现,血清铁蛋白H亚基的含量在致瘤细胞系和许多恶性肿瘤中显著增高。
H-铁蛋白的受体(TfR1)也是肿瘤标志分子,目前已广泛用于肿瘤检测与靶向治疗以及多种癌症预后指标。相比于正常细胞,TfR1 在肿瘤细胞中的表达量提高了100 倍[49, 50]。TfR1 的抗体及其天然配体或TfR1偶联细胞毒性药物或放射性核素,已被用于肿瘤靶向治疗[51]。另外,TfR1还可以作为人H-铁蛋白纳米颗粒的标靶,从而使纳米药物的靶向治疗成为可能。
3 铁蛋白纳米粒子在疾病的诊断及治疗中的应用 3.1 铁蛋白纳米粒子在疾病诊断检测中的应用经过修饰或标记的纳米颗粒已经被广泛用于肿瘤等疾病的诊断、治疗及预后,但是这种修饰往往会改变其本身所具有的理化性质,最终使疾病诊断灵敏度和特异性降低[52, 53]。相比于其他纳米粒子,仿生合成的磁性铁蛋白具有生物相容性好,易于靶向修饰等特点。同时,由于H-铁蛋白的受体TfR1是肿瘤标志分子之一,仿生合成的H-铁蛋白其蛋白外壳本身不需要任何修饰即可直接靶向肿瘤组织,从而具有高特异性和灵敏度[54]。此外,磁性铁蛋白的Fe3O4内核具有过氧化物酶活性[55],这使其既可以特异性的靶向肿瘤细胞,又可以催化双氧水环境中的底物TMB 和DAB,发生与过氧化物酶相同的显色反应。作为国内外病理诊断常用的技术手段,免疫组化是目前公认的金标准[56]。传统的免疫组化通常利用TfR1抗体特异性识别肿瘤细胞,再通过生物素标记的二抗识别一抗,然后辣根过氧化物酶标记的链霉素与生物素结合,最后利用过氧化物酶氧化显色底物来实现对肿瘤组织的检测。这种免疫染色法步骤复杂,操作繁琐,大大降低了检测效率。基于铁蛋白可以靶向肿瘤并可以使其可视化的特性,中国科学院生物大分子研究实验室Fan等[57]针对肿瘤检测发展了一种基于铁蛋白纳米粒子的免疫组化技术。这种技术灵敏度高,特异性强,操作简单,成本低廉,有望成为一种新型广谱性肿瘤诊断工具。
核磁共振成像(MRI)在无损成像的同时,还能提供较高的高空间分辨率以及解剖和生理学上的有关信息[58],被广泛用于软组织损伤、机体炎症反应检测及肿瘤检测等疾病的诊断。Dreher等[59]研究发现粒径在11-15 nm 之间的颗粒易于在肿瘤中积累。仿生合成的磁性铁蛋白外径为12 nm,非常有利于在肿瘤细胞的渗透和积累。Fe3O4内核粒径在4-7 nm 左右,具有超顺磁性,使其可以发展为MRI 显影剂。此外,铁蛋白是人体的天然蛋白质,因此具有天然的低毒和低免疫反应的特性[2, 60]。结合H-铁蛋白可以直接靶向识别肿瘤细胞的特点,使铁蛋白成为一种理想的应用于体内肿瘤成像的MRI显影剂。有学者甚至研究通过使体内的肿瘤细胞过表达H-铁蛋白,并直接应用于核磁共振,从而实现体内肿瘤成像和检测淋巴结肿瘤的转移[61, 62]。但是,由于铁蛋白在免疫调控和炎症发生等多方面均有作用,体内过表达铁蛋白的安全性尚不确定,同时通过内源性的铁蛋白不易于获得明确的检测信号。
除了利用H-铁蛋白本身靶向识别肿瘤细胞外,学者还通过基因工程在H-铁蛋白上融合表达其他在肿瘤细胞高表达蛋白的配体。肿瘤新生血管内皮细胞和肿瘤细胞高表达整合素分子αvβ3,Douglas 实验室通过在H-铁蛋白蛋白壳上融合表达可以结合整合素分子αvβ3的RGD-4C来靶向结合肿瘤细胞[34]。促黑激素(MSH)及其受体或者表皮生长因子(EGF)及其受体以及一段结合Fc 段的多肽也可以通过基因改造引入铁蛋白外壳,使铁蛋白纳米颗粒靶向肿瘤细胞[63, 64]。此外,研究人员还通过化学修饰结合基因工程合成一种嵌合的笼状铁蛋白纳米颗粒,用于增加铁蛋白的多功能性和多模态成像。这种嵌合铁蛋白充分利用了铁蛋白3个界面均可被修饰的特性(图 3),显著提高了肿瘤成像的分辨率和灵敏度。
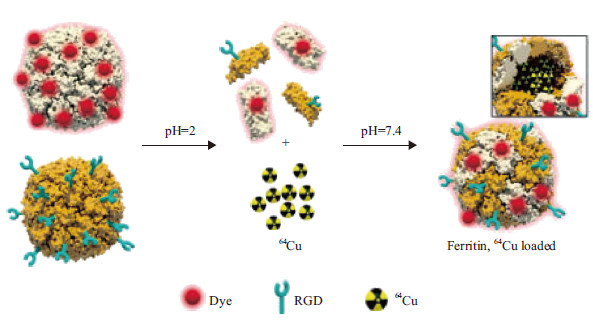 |
| 图 3 多功能嵌合H-铁蛋白纳米颗粒的制备过程 |
首先分别通过基因工程和化学修饰的方法将蛋白肽段RGD-4C 和荧光分子Cy5.5标记到铁蛋白蛋白壳表面,然后将其混合物放于pH2.0环境下解聚,并与64Cu2+ 共孵育,再将环境pH值恢复到7.4使铁蛋白自组装得到表面同时具有肽段RGD-4C 和荧光分子Cy5.5,同时内腔结合有64Cu2+ 的铁蛋白纳米颗粒[31]。
近来,在肿瘤微环境中高表达的一些蛋白酶和活性蛋白的底物成为靶向肿瘤的新策略。研究人员以基质金属蛋白酶(MMP)的底物连接荧光分子和铁蛋白壳,通过化学修饰的方法连接到铁蛋白纳米颗粒的外表面,制备出嵌合铁蛋白荧光成像试剂。嵌合铁蛋白荧光成像纳米颗粒仅可以被肿瘤区域富集的MMP 裂解并激活,从而对肿瘤部位进行特异性成像[65]。随后,聂广军实验室利用类似的方法,将肿瘤微环境中肿瘤相关成纤维细胞活化蛋白α(FAP-α)的底物结合到铁蛋白上,并利用它与肿瘤微环境中富集的FAP-α作用实现对肿瘤微环境的特异性成像[66]。
磁性铁蛋白纳米颗粒是一个理想的核磁共振成像(MRI)造影剂。磁性铁蛋白纳米颗粒成像通过减弱T2 或T2*加权信号强度,使肿瘤区域相比正常组织的信号减弱而出现阴影。但是这种阴影也可能因为伪影而产生假阳性,使得核磁共振很难获得肿瘤诊断的准确信息[34, 58]。因此,人们尝试通过基因工程或化学修饰在铁蛋白纳米颗粒表面引入荧光蛋白或染料,从而将核磁共振成像与荧光成像结合起来,组成多模态成像技术[34, 67]。但是由于光线无法有效的穿透皮肤和深层组织,在成像时无法获得足够的荧光信号强度。于是研究人员又用Cy5.5荧光分子标记H-铁蛋白开发了近红外荧光成像和近红外荧光结合正电子发射断层扫描成像的多模态成像[31]。此外,在铁蛋白内核加载功能性造影剂如钆[Gd(III)]的螯合物和放射性同位素等也可以实现肿瘤诊断的多模式成像[68, 69, 70]。
Douglas和McConnell 实验室联合发现人H-铁蛋白除了可以靶向结合肿瘤细胞,还易于被巨噬细胞吞噬,从而使磁共振造影可以用于评估炎症状态,如动脉粥样硬化斑块恶化及恢复[58, 71, 72]。此外,铁蛋白纳米颗粒也可被用于干细胞的研究,即通过干细胞中高表达的内源性铁蛋白作为造影剂,实现无创的体内实时成像,追踪细胞的增殖、分化和迁移[73]。组织特异性高表达受体也可以借助铁蛋白的靶向结合用于组织器官的成像,如利用富含L亚基的铁蛋白靶向结合鼠肾脏高表达的L-铁蛋白受体Scara5,从而实现肾脏造影成像。聂广军实验室利用金纳米簇固有的光致发光特性及铁蛋白本身的靶向性在去铁马蜱铁蛋白内合成纳米金簇,可用于肾脏的远红外荧光成像[74]。
利用铁蛋白的蛋白壳易于进行各种化学修饰和标记的特征,Lin 等利用生物素(Biotin)-链霉素(Streptavidin)的亲和作用开发了一系列基于铁蛋白的生物大分子检测系统,即分别用生物素标记铁蛋白外壳和目的分子,再利用链霉素和生物素的亲和作用,将目的分子同铁蛋白连接。目前,利用铁蛋白及生物素-链霉素系统建立了一系列的高灵敏度生物大分子检测系统。例如,利用寡聚核苷酸链和目的DNA杂交的方法实现对目的DNA 的检测[75];利用双抗夹心免疫分析法检测人血浆铜蓝蛋白;利用生物标记物的高灵敏度电化学免疫分析法检测TNF-α 及MCP-1 等[76]。 此外,Zhao 等[77]还通过HRP和Aptamer双标铁蛋白建立了一种针对凝血酶的高灵敏度检测系统。
相对于化学修饰,标记蛋白与铁蛋白亚基融合表达的最大优势是解决了被标记蛋白方向随机导致检测灵敏度降低的问题。2007 年,韩国大学的研究人员通过将特异性抗原与铁蛋白融合表达,利用抗原抗体的特异性结合实现了对I 型糖尿病相关蛋白谷氨酸脱羧酶自身抗体及乙肝表面抗原的(10-18 mol/L)超高灵敏度检测,并在病人血清中得到验证[78]。最近,Lee 实验室通过在H-铁蛋白蛋白壳表面展示HIV病毒表面抗原gp41 和修格兰氏症候群相关抗原Ro/La,并通过一步共聚法构建了基于铁蛋白的水凝胶检测系统。带有相关抗原的铁蛋白在水凝胶里面结构稳定,分布均匀,可以将临床上难于区分的AIDS病造成的类修格兰氏症候群与真正的修格兰氏症候群区分开来[79]。
3.2 铁蛋白纳米粒子在疾病治疗中的应用理想的药物纳米载体必须能靶向特定细胞和携带高剂量的治疗药物,同时还应具有较好的生物相容性和优越的物理化学性质[80]。铁蛋白生物相容性好,分散性好,粒径均一,易于在肿瘤细胞中渗透和积累的特点使其成为理想的药物纳米载体。同用于疾病诊断的各种活性蛋白和小分子一样,用于治疗疾病的抗体和毒素等蛋白类药物和小分子药物也可通过基因融合和化学修饰与铁蛋白结合,并通过铁蛋白或铁蛋白携带的抗体特异性的作用于癌细胞等病变细胞,从而实现疾病的高效低毒性治疗。
对蛋白类药物而言,相对于化学修饰,采用与铁蛋白亚基融合表达方法的最大优势是解决了化学标记时,被标记蛋白方向随机,从而降低检测灵敏度的问题。在标记蛋白与铁蛋白亚基融合表达以后,铁蛋白亚基自组装的同时,可以将融合蛋白以同样的方式展示在蛋白壳的外表面。最近,中科院生物物理研究所开发携带阿霉素的H-铁蛋白,并成功的通过单次注射即可特异性结合和杀死癌细胞[80]。
针对疾病最好的治疗方案莫过于防患未然,而针对各种疾病的疫苗正是发挥预防作用的主力军。传统的疫苗多为减毒活疫苗,包括天然减毒株和基因重组弱毒株等。应用减毒株疫苗的最大缺陷是减毒株在易感群体中有恢复毒力作用的风险,并可能导致肠套叠等未知副作用。因此,生产安全、高效及廉价的基因工程疫苗成为新的需求。而由24个亚基自组装而成的铁蛋白纳米粒子正是一个理想的抗原呈递和疫苗开发平台。同时,铁蛋白耐高温及对pH敏感的特点又可以被用于口服疫苗的开发。2006年,美国新世纪医药公司(New Century Pharmaceuticals)在铁蛋白L 亚基的N 端融合表达HIV-1 病毒的Tat 肽段,并用自组装纳米疫苗口服免疫小鼠引起高效的免疫应答[81]。2013年,NIH 过敏与传染病研究所的疫苗研究中心Kanekiyo等又通过将流感病毒血凝素HA与幽门螺杆菌铁蛋白亚基N端融合,用这种铁蛋白肌肉注射免疫雪貂成功产生中和抗体(图 4-A)。血凝抑制实验发现相对于普通疫苗,单独应用铁蛋白免疫并不能显著的提高抑制血凝滴度。但是当铁蛋白联合Ribi等免疫佐剂使用时,其抑制血凝滴度可以提高7.2倍。同时还发现这种铁蛋白疫苗大大的增加了疫苗的广谱性,且对动物内源铁蛋白不产生免疫反应(图 4-B)。之后通过对雪貂血清中免疫相关细胞因子CD4和CD8的检测发现经过两次免疫之后机体成功获得了自主免疫能力[82]。随后,韩国纳米生物科学与化工学院利用铁蛋白作为基于树突状细胞的疫苗的抗原呈递平台。韩国蔚山国家科学技术研究所Han等[83]发现铁蛋白可以将OT-1和OT-2肽段成功的呈递于树突状细胞,并在体内和体外都可以诱导T细胞抗原特异性因子CD4和CD8的增殖。
利用基因重组技术生产铁蛋白纳米疫苗抗原呈递平台可以避免传统疫苗在鸡胚或细胞中生产易于携带外源病毒的潜在危险,同时还允许通过修饰提高其免疫原性。这种方法可以广泛应用于类似病原体疫苗的开发和抗肿瘤药物的呈递,为抗原呈递和疫苗开发提供了一种新平台。
4 结语铁蛋白纳米粒子是一个古老而庞大的家族,广泛存在于各种生物体内。铁蛋白具有生物相容性好、药物承载量大、易于进行各种化学修饰和标记及靶向修饰等特点,在转化医学领域具有极大的应用前景。在过去的几年里,针对天然纳米颗粒的合成和结构特点已经进行了很多的研究。以铁蛋白为基础的纳米技术为疾病的诊断和治疗领域带来了福音。生物自身合成的纳米粒子具有粒径均一、分散性好、低免疫排斥和易于靶向修饰等特点,这些属性都已经开始被用于疾病的体外和体内诊断及治疗。大量的研究已经证明了使用铁蛋白纳米粒子结合特异性抗原、配体和小分子等用于药物呈递和细胞成像的可行性。铁蛋白纳米颗粒已经被证明是一个强大的抗原呈递和药物输送的平台。铁蛋白纳米粒子在生物医疗领域的应用具有巨大的潜力,随着人们对铁蛋白纳米颗粒的进一步了解及纳米颗粒合成方法的进一步提升,铁蛋白纳米颗粒在生物医学领域的应用将会进一步扩大。
| [1] | Lippert PC, Zachos JC. A biogenic origin for anomalous fine-grained magnetic material at the Paleocene-Eocene boundary at Wilson Lake, New Jersey[J]. Paleoceanography, 2007, 22(4). DOI: 10.1029/2007PA001471. |
| [2] | Stanley S. Biological nanoparticles and their influence on organisms[J]. Curr Opin Biotechnol, 2014, 28C: 69-74. |
| [3] | Theil EC, Behera RK, Tosha T. Ferritins for Chemistry and for Life[J]. Coord Chem Rev, 2013, 257(2): 579-586. |
| [4] | Theil EC. Ferritin protein nanocages-the story[J]. Nanotechnol Percept, 2012, 8(1): 7-16. |
| [5] | Laufberger V. Sur la cristallisation de la ferritine[J]. Bull Soc Chim Biol, 1937, 19: 1575-1582. |
| [6] | Gerrity RG, Thomas K, Rosenthal J, et al. Accumulation of ferritin in the aortic intima of hyperlipemic swine[C]. New York: Journal of Cell Biology, 1981: A417. |
| [7] | Worwood M, Aherne W, Dawkins S, et al. The characteristics of ferritin from human tissues, serum and blood cells[J]. Clin Sci Mol Med, 1975, 48: 441-451. |
| [8] | Hampton JC. An electron microscope study of the source and distribution of ferritin in hepatic parenchymal cells of the newborn rabbit[J]. Blood, 1960, 15: 480-490. |
| [9] | Proudhon D, Briat JF, Lescure AM. Iron induction of ferritin synthesis in soybean cell suspensions[J]. Plant Physiol, 1989, 90(2): 586-590. |
| [10] | David CN, Easterbrook K. Ferritin in the fungus Phycomyces[J]. J Cell Biol, 1971, 48(1): 15-28. |
| [11] | Andrews SC, Harrison PM, Guest JR. Cloning, sequencing, and mapping of the bacterioferritin gene(bfr)of Escherichia coli K-12[J]. J Bacteriol, 1989, 171(7): 3940-3947. |
| [12] | Towe KM. Structural distinction between ferritin and iron-dextran(imferon). An electron diffraction comparison[J]. J Biol Chem, 1981, 256(18): 9377-9378. |
| [13] | Harrison PM, Fischbach FA, Hoy TG, et al. Ferric oxyhydroxide core of ferritin[J]. Nature, 1967, 216(5121): 1188-1190. |
| [14] | Theil EC. Ferritin protein nanocages use ion channels, catalytic sites, and nucleation channels to manage iron/oxygen chemistry[J]. Curr Opin Chem Biol, 2011, 15(2): 304-311. |
| [15] | Schwartz JK, Liu XS, Tosha T, et al. Spectroscopic definition of the ferroxidase site in M ferritin: comparison of binuclear substrate vs cofactor active sites[J]. J Am Chem Soc, 2008, 130(29): 9441-9450. |
| [16] | Barnés CM, Theil EC, Raymond KN. Iron uptake in ferritin is blocked by binding of[Cr(TREN)(H2O)(OH)] 2+, a slow dissociating model for[Fe(H2O)6] 2+[J]. Proceedings of the National Academy of Sciences, 2002, 99(8): 5195-5200. |
| [17] | Harrison PM, Arosio P. The ferritins: molecular properties, iron storage function and cellular regulation[J]. Biochim Biophys Acta, 1996, 1275(3): 161-203. |
| [18] | Torti FM, Torti SV. Regulation of ferritin genes and protein[J]. Blood, 2002, 99(10): 3505-3516. |
| [19] | Lawson DM, Artymiuk PJ, Yewdall SJ, et al. Solving the structure of human H ferritin by genetically engineering intermolecular crystal contacts[J]. Nature, 1991, 349(6309): 541-544. |
| [20] | Cozzi A, Corsi B, Levi S, et al. Overexpression of wild type and mutated human ferritin H-chain in HeLa cells: in vivo role of ferritin ferroxidase activity[J]. J Biol Chem, 2000, 275(33): 25122-25129. |
| [21] | Levi S, Yewdall SJ, Harrison PM, et al. Evidence that H- and L-chains have co-operative roles in the iron-uptake mechanism of human ferritin[J]. Biochemistry J, 1992(288): 591-596. |
| [22] | Meyron-Holtz EG, Moshe-Belizowski S, Cohen LA. A possible role for secreted ferritin in tissue iron distribution[J]. J Neural Transm, 2011, 118(3): 337-347. |
| [23] | Arosio P, Ingrassia R, Cavadini P. Ferritins: a family of molecules for iron storage, antioxidation and more[J]. Biochim Biophys Acta, 2009, 1790(7): 589-599. |
| [24] | Beck JR, Meier FA, French EE, et al. Serum-ferritin[J]. Lancet, 1979, 1(8125): 1080. |
| [25] | Blake DR, Bacon PA, Eastham EJ, et al. Synovial fluid ferritin in rheumatoid arthritis[J]. Br Med J, 1980, 281(6242): 715-716. |
| [26] | Sindic CJ, Collet-Cassart D, Cambiaso CL, et al. The clinical relevance of ferritin concentration in the cerebrospinal fluid[J]. J Neurol Neurosurg Psychiatry, 1981, 44(4): 329-333. |
| [27] | Santambrogio P, Pinto P, Levi S, et al. Effects of modifications near the 2-, 3- and 4-fold symmetry axes on human ferritin renaturation[J]. Biochem J, 1997, 322(Pt 2): 461-468. |
| [28] | Stefanini S, Cavallo S, Wang CQ, et al. Thermal stability of horse spleen apoferritin and human recombinant H apoferritin[J]. Arch Biochem Biophys, 1996, 325(1): 58-64. |
| [29] | Kang S, Oltrogge LM, Broomell CC, et al. Controlled assembly of bifunctional chimeric protein cages and composition analysis using noncovalent mass spectrometry[J]. J Am Chem Soc, 2008, 130(49): 16527-16529. |
| [30] | Uchida M, Kang S, Reichhardt C, et al. The ferritin superfamily: Supramolecular templates for materials synthesis[J]. Biochim Biophys Acta, 2010, 1800(8): 834-845. |
| [31] | Lin X, Xie J, Niu G, et al. Chimeric ferritin nanocages for multiple function loading and multimodal imaging[J]. Nano Lett, 2011, 11(2): 814-819. |
| [32] | Heywood BR. Synthesis of inorganic nanophase materials in supramolecular protein cages[J]. Nature, 1991, 349(6311): 684-687. |
| [33] | Mann S, Archibald DD, Didymus JM, et al. Crystallization at inorganic-organic interfaces: biominerals and biomimetic synthesis[J]. Science, 1993, 261(5126): 1286-1292. |
| [34] | Uchida M, Flenniken ML, Allen M, et al. Targeting of cancer cells with ferrimagnetic ferritin cage nanoparticles[J]. J Am Chem Soc, 2006, 128(51): 16626-16633. |
| [35] | Andrews NC. Forging a field: the golden age of iron biology[J]. Blood, 2008, 112(2): 219-230. |
| [36] | Cadenas E. Biochemistry of oxygen toxicity[J]. Annu Rev Biochem, 1989, 58: 79-110. |
| [37] | Alkhateeb AA, Connor JR. Nuclear ferritin: A new role for ferritin in cell biology[J]. Biochim Biophys Acta, 2010, 1800(8): 793-797. |
| [38] | Levi S, Arosio P. Mitochondrial ferritin[J]. Int J Biochem Cell Biol, 2004, 36(10): 1887-1889. |
| [39] | Knovich MA, Storey JA, Coffman LG, et al. Ferritin for the clinician[J]. Blood Rev, 2009, 23(3): 95-104. |
| [40] | Jezequel P, Campion L, Spyratos F, et al. Validation of tumor-associated macrophage ferritin light chain as a prognostic biomarker in node-negative breast cancer tumors: A multicentric 2004 national PHRC study[J]. Int J Cancer, 2012, 131(2): 426-437. |
| [41] | Volpino P, Cangemi V, Caputo V, et al. Clinical usefulness of serum ferritin measurements in lung cancer patients[J]. J Nucl Med Allied Sci, 1984, 28(1): 27-30. |
| [42] | Gray CP, Arosio P, Hersey P. Association of increased levels of heavy-chain ferritin with increased CD4+ CD25+ regulatory T-cell levels in patients with melanoma[J]. Clin Cancer Res, 2003, 9 (7): 2551-2559. |
| [43] | Fantechi E, Innocenti C, Zanardelli M, et al. A smart platform for hyperthermia application in cancer treatment: cobalt-doped ferrite nanoparticles mineralized in human ferritin cages[J]. ACS Nano, 2014, 8(5): 4705-4719. |
| [44] | Almeida SM, Cunha S, Yamada E, et al. Quantification of cerebrospinal fluid ferritin as a biomarker for CNS malignant infiltration[J]. Arq Neuropsiquiatr, 2008, 66(3B): 720-724. |
| [45] | Szymendera JJ, Kozlowicz-Gudzinska I, Madej G, et al. Clinical usefulness of serum ferritin measurements in patients with testicular germ cell tumors[J]. Oncology, 1985, 42(4): 253-258. |
| [46] | Zhang XZ, Su AL, Hu MQ, et al. Elevated serum ferritin levels in patients with hematologic malignancies[J]. Asian Pac J Cancer Prev, 2014, 15(15): 6099-6101. |
| [47] | Matzner Y, Konijn AM, Hershko C. Serum ferritin in hematologic malignancies[J]. Am J Hematol, 1980, 9(1): 13-22. |
| [48] | Wang W, Knovich MA, Coffman LG, et al. Serum ferritin: Past, present and future[J]. Biochim Biophys Acta, 2010, 1800(8): 760-769. |
| [49] | Daniels TR, Delgado T, Helguera G, et al. The transferrin receptor part Ⅱ: targeted delivery of therapeutic agents into cancer cells[J]. Clin Immunol, 2006, 121(2): 159-176. |
| [50] | Reissmann KR, Dietrich MR. On the presence of ferritin in the peripheral blood of patients with hepatocellular disease[J]. J Clin Invest, 1956, 35(6): 588-595. |
| [51] | Daniels TR, Bernabeu E, Rodriguez JA, et al. The transferrin receptor and the targeted delivery of therapeutic agents against cancer[J]. Biochim Biophys Acta, 2012, 1820(3): 291-317. |
| [52] | Chen H, Yeh J, Wang L, et al. Reducing non-specific binding and uptake of nanoparticles and improving cell targeting with an antifouling peo-b-p gamma amps copolymer coating[J]. Biomaterials, 2010, 20(31): 5397-5407. |
| [53] | Doshi N, Mitragotri S. Designer biomaterials for nanomedicine[J]. Advanced Functional Materials, 2009, 19(24): 3843-3854. |
| [54] | Fan K, Cao C, Pan Y, et al. Magnetoferritin nanoparticles for targeting and visualizing tumour tissues[J]. Nat Nanotechnol, 2012, 7(7): 459-464. |
| [55] | Gao L, Zhuang J, Nie L, et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J]. Nat Nanotechnol, 2007, 2(9): 577-583. |
| [56] | O'Leary TJ. Standardization in immunohistochemistry[J]. Appl Immunohistochem Mol Morphol, 2001, 9(1): 3-8. |
| [57] | Fan K, Cao C, Pan Y, et al. Magnetoferritin nanoparticles for targeting and visualizing tumour tissues[J]. Nat Nanotechnol, 2012, 7(7): 459-464. |
| [58] | Uchida M, Terashima M, Cunningham CH, et al. A human ferritin iron oxide nano-composite magnetic resonance contrast agent[J]. Magn Reson Med, 2008, 60(5): 1073-1081. |
| [59] | Dreher MR, Liu W, Michelich CR, et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers[J]. J Natl Cancer Inst, 2006, 98(5): 335-344. |
| [60] | Lee LA, Wang Q. Adaptations of nanoscale viruses and other protein cages for medical applications[J]. Nanomedicine, 2006, 2(3): 137-149. |
| [61] | Gilad AA, Winnard PJ, van Zijl PC, et al. Developing MR reporter genes: promises and pitfalls[J]. NMR Biomed, 2007, 20(3): 275-290. |
| [62] | Cohen B, Ziv K, Plaks V, et al. Ferritin nanoparticles as magnetic resonance reporter gene[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2009, 1(2): 181-188. |
| [63] | Li X, Qiu L, Zhu P, et al. Epidermal growth factor-ferritin H-chain protein nanoparticles for tumor active targeting[J]. Small, 2012, 8(16): 2505-2514. |
| [64] | Kang HJ, Kang YJ, Lee YM, et al. Developing an antibody-binding protein cage as a molecular recognition drug modular nanoplatform[J]. Biomaterials, 2012, 33(21): 5423-5430. |
| [65] | Lin X, Xie J, Zhu L, et al. Hybrid ferritin nanoparticles as activatable probes for tumor imaging[J]. Angew Chem Int Ed Engl, 2011, 50(7): 1569-1572. |
| [66] | Ji T, Zhao Y, Wang J, et al. Tumor fibroblast specific activation of a hybrid ferritin nanocage-based optical probe for tumor microenvironment imaging[J]. Small, 2013, 9(14): 2427-2431. |
| [67] | Li K, Zhang ZP, Luo M, et al. Multifunctional ferritin cage nanostructures for fluorescence and MR imaging of tumor cells[J]. Nanoscale, 2012, 4(1): 188-193. |
| [68] | Aime S, Frullano L, Geninatti CS. Compartmentalization of a gadolinium complex in the apoferritin cavity: a route to obtain high relaxivity contrast agents for magnetic resonance imaging[J]. Angew Chem Int Ed Engl, 2002, 41(6): 1017-1019. |
| [69] | Geninatti CS, Bussolati B, Tei L, et al. Magnetic resonance visualization of tumor angiogenesis by targeting neural cell adhesion molecules with the highly sensitive gadolinium-loaded apoferritin probe[J]. Cancer Res, 2006, 66(18): 9196-9201. |
| [70] | Huang P, Rong P, Jin A, et al. Dye-loaded ferritin nanocages for multimodal imaging and photothermal therapy[J]. Adv Mater, 2014, 26(37): 6401-6408. |
| [71] | Terashima M, Uchida M, Kosuge H, et al. Human ferritin cages for imaging vascular macrophages[J]. Biomaterials, 2011, 32(5): 1430-1437. |
| [72] | Kitagawa T, Kosuge H, Uchida M, et al. RGD-conjugated human ferritin nanoparticles for imaging vascular inflammation and angiogenesis in experimental carotid and aortic disease[J]. Mol Imaging Biol, 2012, 14(3): 315-324. |
| [73] | Naumova AV, Reinecke H, Yarnykh V, et al. Ferritin overexpression for noninvasive magnetic resonance imaging-based tracking of stem cells transplanted into the heart[J]. Mol Imaging, 2010, 9(4): 201-210. |
| [74] | Sun C, Yang H, Yuan Y, et al. Controlling assembly of paired gold clusters within apoferritin nanoreactor for in vivo kidney targeting and biomedical imaging[J]. J Am Chem Soc, 2011, 133(22): 8617-8624. |
| [75] | Li M, Mann S. DNA-directed assembly of multifunctional nanoparticle networks using metallic and bioinorganic building blocks[J]. J Mater Chem, 2004, 14(14): 2260-2263. |
| [76] | Liu G, Wu H, Wang J, et al. Apoferritin-templated synthesis of metal phosphate nanoparticle labels for electrochemical immunoassay[J]. Small, 2006, 2(10): 1139-1143. |
| [77] | Zhao J, Liu M, Zhang Y, et al. Apoferritin protein nanoparticles dually labeled with aptamer and horseradish peroxidase as a sensing probe for thrombin detection[J]. Anal Chim Acta, 2013, 759: 53-60. |
| [78] | Lee SH, Lee H, Park JS, et al. A novel approach to ultrasensitive diagnosis using supramolecular protein nanoparticles[J]. FASEB J, 2007, 21(7): 1324-1334. |
| [79] | Lee EJ, Ahn KY, Lee JH, et al. A novel bioassay platform using ferritin-based nanoprobe hydrogel[J]. Adv Mater, 2012, 24(35): 4739-4744, 4730. |
| [80] | Liang M, Fan K, Zhou M, et al. H-ferritin-nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection[J]. Proc Natl Acad Sci USA, 2014, 111(41): 14900-14905. |
| [81] | Li CQ, Soistman E, Carter DC. Ferritin nanoparticle technology. A new platform for antigen presentation and vaccine development[J]. Industrial Biotechnology, 2006, 2(2): 143-147. |
| [82] | Kanekiyo M, Wei CJ, Yassine H M, et al. Self-assembling influenza nanoparticle vaccines elicit broadly neutralizing H1N1 antibodies[J]. Nature, 2013, 499(7456): 102-106. |
| [83] | Han J, Kang YJ, Shin C, et al. Ferritin protein cage nanoparticles as versatile antigen delivery nanoplatforms for dendritic cell(DC)-based vaccine development[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2014, 10(3): 561-569. |






