2. 河北省科学院生物研究所 河北省主要农作物病害微生物控制工程技术研究中心,石家庄 050081;
3. 河北农业大学生命科学学院,保定 071001
2. Biology Institute, Hebei Academy of Sciences, Hebei Engineering and Technology Center of Microbiological Control on Main Crop Disease, Shijiazhuang 050081;
3. College of Life Sciences, Agricultural University of Hebei, Baoding 071001
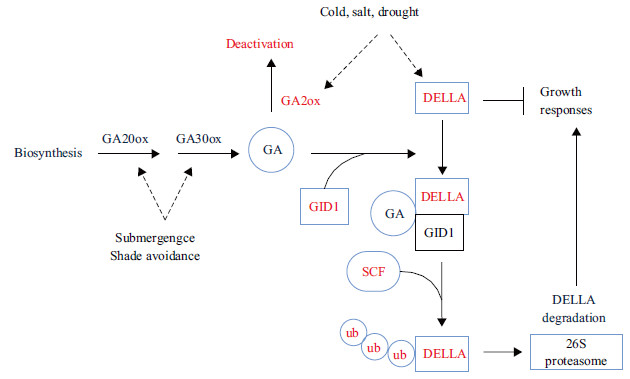
植物的生长发育受到多种激素的调控,这些激素可以在其合成部位附近或者远离合成部位发挥作用,介导植物程序性生长发育以对非生物胁迫做出响应[1]。赤霉素(GA)主要通过促进细胞分裂来促使植物生长发育及其不同生长时期进行转化,包括调控种子休眠到发芽、从幼苗到成年植株以及营养生长到生殖生长的转化。GA是植物正常生长发育所不可缺少的一种激素,刘永庆等[2]研究表明番茄种子胚根尖细胞的DNA复制对于种子发芽非常重要,而GA则是启动其复制的关键因素。植物常通过调整体内激素的代谢和信号来改变形态和生理机能,提高胁迫耐受性。干旱、低温、弱光照和水淹是几种常见的非生物胁迫,Franklin[3]发现植物在弱光照条件下通常向光照充足处生长。Bailey-Serres等发现,在水淹或其他逆境中植物经常通过减产集中自身营养物质的方式抵抗非生物胁迫[4, 5]。非生物胁迫下,植物激素合成以及信号转导通路相互联系,形成了特定的抗胁迫机制。如图 1所示,GA参与的抗胁迫机制主要包括两种形式,其一是通过诱导基因GA20ox和GA3ox上调,促进GA合成进而促使植物生长发育实现的;其二是上调具有抑制GA活性的基因GA2ox的基因表达,降低GA生物活性,造成DELLA积累,抑制植物生长发育。近来,研究发现DELLA蛋白也参与了其他激素信号通路,这为GA信号与其他激素信号通路的相互联系提供了一种新机制[6]。
1 赤霉素生物合成代谢与信号转导赤霉素是一类四环双萜类羧酸,只有包括GA1、GA4等在内的一小部分有生物活性[8]。GA主要在植物的茎间和根间合成,成熟叶片内合成少量GA,且基本不运输到其他组织中。质体、内质网以及细胞质基质是GA在细胞内的合成场所,其主要由牻牛儿牻牛儿基焦磷酸(GGDP)这一GA生物合成的前体物质经过多步酶促反应逐步形成GA的最初产物GA12-醛,进一步转化成GA12,GA12在GA13氧化酶的作用下转变为GA53,细胞质基质中3种氧化酶GA20-oxidase、GA3-oxidase和GA2-oxidase催化氧化GA12和GA53形成其他种类GAs[9]。
GA主要通过对信号转导后期各酶酶活的调控来控制GA的生物合成。其中细胞色素P450单加氧酶和可溶性2-酮戊二酸依赖性双加氧酶是起关键作用的酶类,编码该双加氧酶基因包括GA20ox和GA3ox[10]。GA20ox和GA3ox是植物生长发育和环境信号调节GA生物合成途径的主要位点,而GA2ox基因主要对GA生物活性进行调控,使有活性的GA失活[11]。拟南芥共有5 个GA2-oxidase能降低GA的生物活性。
GA信号转导通路包括活性GA的合成、感应、信号转导以及GA的失活。DELLA蛋白是GRAS家族的一个亚基,其N端包括一个保守的结构域。DELLA与GID1是GA信号转导通路的主要组成部分,其中DELLA起关键调控作用,GID1是GA的受体。GA能够引起对植物生长有抑制作用的DELLA降解。GA与GID1结合成复合物,使GID1构象发生变化,从而与DELLA的N末端结合,导致DELLA被SCF泛素化而降解。当GA含量低时,GID1不与其结合,信号通路阻遏蛋白DELLA积累,从而激发DELLA介导的对植物生长的抑制[12]。植物在非生物胁迫条件下通过调控GA生物合成、代谢与信号转导,提高其胁迫耐受性。
2 GA调控植物生长以响应非生物胁迫 2.1 响应水淹胁迫多个水稻品系抗水淹胁迫的模型表明GA信号调控植物生长发育且能提高植物对非生物胁迫的耐受性[13]。长期生长于水淹环境中的水稻,其节间在水淹信号的作用下迅速伸长,使得水稻的根长出水面,避免水淹的“伤害”。研究发现水淹信号诱导植物乙烯含量增加[14]。植物内源乙烯积累会使得乙烯反应因子(ERF)结构域蛋白SNORKEL1和SNORKEL2表达上调,从而导致节间伸长,节间伸长也直接或者间接使得植物内源活性GA积累[15]。然而Sub1A这一作用因子调控植物适应短时间的水淹胁迫。一旦水淹,携带Sub1A的植物不会立刻响应水淹胁迫。Fukao等[16]研究发现水稻Sub1A基因虽然不能促进节间伸长,却能够抑制芽的伸长且促进水稻积累碳水化合物,利于水淹后水稻的恢复,并且研究发现Sub1A对于水淹胁迫的响应主要是提高叶子的存活率且利于增加叶子数目。可见,Sub1A在某种程度上提高植物的水淹胁迫耐受性。水淹胁迫下,水稻DELLA蛋白SLR1以及GA信号的抑制子SLRL1限制植物茎的生长以利于植物从水淹胁迫中恢复[4]。
2.2 响应弱光照胁迫光照对于植物生长发育至关重要,一旦被遮挡,植物会感受光谱和光强的变化,从而改变自身形态向光照充足处生长以躲避弱光照胁迫[17]。生长素、乙烯、油菜素内酯及GA等多种激素共同调控植物茎、下胚轴和叶柄伸长,从而使植物响应弱光照胁迫[18, 19]。叶绿素对于红光有较强的吸收,由于周围植被的遮挡,到达植物感知范围的红光衰减为远红外光。植物内源感光体光敏色素PhyB识别这种远红外光,Pf和Pfr是两种可见的光敏色素[20]。实验证明拟南芥叶片中的感光信号通路汇聚在bHLH转录因子PIF4和PIF5上[20]。PhyB介导的植物逃避弱光照的反应需要GA信号以及生长素的参与[21]。PIF转录因子在其Pfr形式下被PhyB磷酸化失去活性,而远红光条件下,PhyB转化为无活性Pr形式,PIFs仍具有活性。PIF4与DELLA蛋白结合,导致PIF4不能转录,激活GA信号通路[22]。对DELLA蛋白的研究发现,GA信号调控DELLA蛋白降解,促进PIF4的功能。有研究表明黑暗时,IF1结合到DELLA基因GAI和RGA的启动子上,激活它们的表达来抑制GA的响应,PIF1也能够抑制GA生物合成基因GA3ox1和GA3ox2的表达,并促进GA水解酶基因GA2ox2的表达,从而减少有活性GA的生物合成[23]。活性GA减少,受体GID1与GA结合,DELLA蛋白积累,从而抑制植物生长。
2.3 响应轻度渗透胁迫研究拟南芥幼苗对渗透胁迫的耐受性发现,非生物胁迫诱导GA调控植物生长停滞以增强胁迫耐受性[24]。将拟南芥幼苗置于低浓度甘露醇溶液中,渗透压影响叶片细胞分裂并且导致叶片失水,使得叶片面积明显缩小。对单独某种植物激素对于渗透胁迫的响应进行研究,结果表明乙烯和GA主要调控了细胞分裂和细胞体积扩大,而ABA介导了植物成熟细胞响应轻度渗透胁迫[25]。此外,植物对轻度渗透胁迫的快速细胞反应已经使得人们开始猜测植物激素信号来自植物其他组织,而非自身从头合成途径[26]。
对轻度渗透胁迫引起植物生长停滞现象进行深入研究发现,胞周期停滞导致细胞停止分裂。渗透胁迫引起乙烯相关转录的减少,从而使得细胞停止分裂,然而细胞分化却未受影响。GA机制相关基因的表达、DELLA调控的转录以及RGA的积累与乙烯和GA对于细胞周期的作用一致。研究发现乙烯和GA通过控制有丝分裂对细胞周期进行调控[24]。乙烯和GA介导的对于渗透胁迫的响应可能由ERF6转录因子联系起来[27]。DELLA将不同植物激素响应渗透胁迫的机制联系起来,DELLA的上调或者下调都影响植物对于轻度渗透胁迫的响应。ERF6作为ERF亚家族转录因子,参与调节GA2ox6的表达,调控GA合成以响应轻度渗透胁迫。
2.4 响应土壤干旱胁迫土壤干旱是作物减产的关键因素,对植物的影响程度取决于土壤的性质和干旱程度[28]。干旱的土壤由于板结、阻力大,不利于植物根的生长,导致水和营养物质难以到达植物根部[29, 30]。土壤干旱给植物带来多种非生物胁迫,阻力、水分和营养物质对于植物的影响很难单独区分出来。对于适度干旱的土壤,机械阻力很可能是限制根系生长的主要因素;相反,在没有机械阻力的情况下,即使水分亏缺,植物的根系也会生长或者保持不变。对土生植物而言,非生物胁迫通常影响其芽的伸长,对水生植物则是减缓其叶的生长[31]。机械阻力大的土壤抑制叶片细胞的大小和数目从而限制叶的生长[32]。然而,如何感知土壤阻力大小以及阻力大的土壤如何影响芽生长和发育的研究还不是很清楚[33]。
已有文献常用渗透胁迫表征干旱胁迫。最近有研究表明,轻度渗透胁迫和干旱胁迫都能引起拟南芥GA2ox表达下调,此基因调控GA失去活性,其下调引起植株内GA积累,同时还发现拟南芥的根和芽的生长都受到了抑制[34]。对大麦进行研究发现,板结土壤诱导根产生的某种信号抑制了其叶的生长。有研究称乙烯和ABA是根产生的抑制生长信号,但是最新的研究表明GA同样也是抑制生长的信号[35]。通过不断增加土量保持种植小麦的土壤水分和营养物质不变发现,由于土壤板结,小麦叶片生长停滞,通过向土壤中施加GA,叶片恢复正常生长。停止对几种正常生长15 d的拟南芥赤霉素相关基因突变株浇水10 d,GA20ox基因过表达与GA2ox、GA3ox下调都能引起GA含量增多,且由于GA含量的变化导致植物的抗盐胁迫能力不同。这些转基因植物芽等幼嫩部位能合成GA,不需要根为其提供GA[36]。叶片中的GA调节机制可能与根部的其他信号作用相关,而非GA信号。
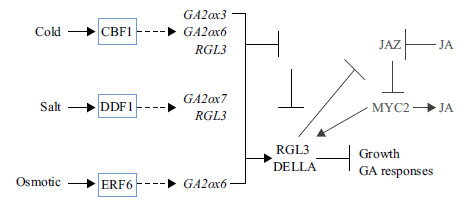
3 非生物胁迫中GA合成和信号的调节对于非生物胁迫调控GA代谢和信号转导通路的研究已经比较清晰(图 2)。Sub1A是转录因子ERF亚家族中的成员,拟南芥ERF转录因子通过调控GA响应非生物胁迫,这与Sub1A调控活性GA减少,抑制水淹水稻芽生长以响应水淹胁迫的结论相符合[37, 38]。ERF的一个亚家族转录因子DREB1/CBF,调节控制GA生物活性的基因GA2ox3和GA2ox6以及DELLA相关基因RGL3的表达。盐胁迫和低温胁迫条件下,CBF调控GA2ox3和GA2ox6表达上调,活性GA降解,GA与受体GID结合,DELLA未能泛素化而积累,从而抑制拟南芥生长[39, 40]。同理,盐胁迫条件下DDF1转录因子诱导ATGA2ox7和RGL3基因表达上调,抑制拟南芥的生长发育。转录因子ERF家族中的ERF6对不同胁迫的响应大不相同,这就使得其调控的GA2ox家族各基因在不同胁迫条件下差异表达,导致GA存在不同抗胁迫机制[41]。研究发现RGL3可以诱导JA信号通路,而JA信号又能作用于DELLA从而抑制植物生长,这与GA调控DELLA响应胁迫非常相似。这说明JA和GA在响应非生物胁迫中存在联系[38]。GA对于非生物胁迫的响应不是独立的,而是与ABA、JA、生长素、乙烯及油菜素内酯协调配合共同调控。
4 DELLA限制生长以响应非生物胁迫GA对调节植物生长发育起重要作用,与GA紧密相关的DELLA蛋白在某种程度上介导了植物生长停滞,提高了对非生物胁迫的耐受性。盐处理拟南芥幼苗,结果显示其内部有活性的赤霉素含量降低,DELLA蛋白积累,此结果符合GA在非生物胁迫中抑制植物生长的结论[42]。研究证明盐胁迫条件下,小麦DELLA基因表达上调,其株高及干物质量减少(待发表)。目前,对DELLA功能以及盐胁迫条件下DELLA与植物生长发育之间的关系研究得很清楚。通过检测盐胁迫条件下GA相关基因的突变体发现,DELLA蛋白在GA缺陷型ga1突变体中积累,在GA不敏感型gai-1突变体中趋于稳定水平,但在低盐胁迫条件下DELLA功能缺失型突变体的存活率降低[43]。拟南芥della突变株的生理参数与其胁迫耐受性密切相关,这表明DELLA蛋白抑制植物生长以应对非生物胁迫[44]。另外,寒冷条件下della突变体存活率降低也能得出DELLA的功能有助于提高植物的胁迫耐受性的结论。以上两种情况,盐胁迫和低温胁迫诱导DREB1/C的结合因子(CBF)家族转录因子对GA2ox基因上调,GA2ox基因的上调导致植物内源活性物质GA的减少[45]。
对拟南芥DELLA介导的转录调控进行分析,发现DELLA对非生物胁迫做出的应激反应是控制植株的氧化系统[45]。早有研究表明ROS是植物遭遇生物或者非生物胁迫下积累的有害物质,DELLA可以抑制活性氧(ROS)的积累。DELLA调控细胞分裂,在轻度渗透胁迫下,DELLA的积累使得细胞有丝分裂终止[46]。研究发现胁迫条件下,拟南芥della突变体细胞数目会由于DELLA活性缺失而减少[24]。在胁迫和非胁迫状态下,DELLA起了不同的作用,即DELLA调控非胁迫条件下生长率以及非生物胁迫条件下植物的生长受限[38, 39, 40]。
5 赤霉素和其他植物激素信号通路的交互作用在某些情况下,赤霉素和其他激素信号相互配合,共同响应非生物胁迫。传统的应激激素ABA和乙烯在许多通路中与GA有交集。向拟南芥幼苗施加ABA,DELLA蛋白的积累,其根生长受到限制,然而della突变体的根生长所受到的抑制程度相对较低。然而向GA合成缺陷突变体ga1-3施加低浓度GA,依然不能使DELLA积累。以上结果表明DELLA的积累和GA活性水平相关,而非与DELLA自身是否稳定相关[47]。ABA受体突变体abi1-1中ABA的积累没有引起DELLA的积累[48],这就说明ABA介导的生长受限在某种程度上是依赖DELLA的,并且需要ABI1信号参与。
水稻被淹部位乙烯的积累是GA响应非生物胁迫的最初信号,乙烯的积累也能诱导ABA的合成。Sub1A这一ERF蛋白亚基,对ABA、乙烯、油菜素内酯以及GA介导的信号通路起调节作用,它能抑制活性GA的积累,能提高植物对于包括水淹及干旱等多种非生物胁迫的耐受性[49]。乙烯使得ABA合成减少,诱导GA3ox表达,使得GA合成增加。ABA浓度降低会导致GA3ox和GA20ox基因表达下调,进而抑制GA合成[41]。本实验室研究发现,在盐胁迫条件下,N-酰基高丝氨酸内酯这类革兰氏阴性细菌分泌的小分子物质激发拟南芥DELLA介导的生长受限,提高拟南芥对盐胁迫耐受性(待发表)。我们猜测N-酰基高丝氨酸内酯与GA合成或者信号通路相关,这与赤霉素通过与多种植物激素共同调控植物胁迫耐受性的结论相一致。
6 小结越来越多的证据表明降低GA信号是植物应对非生物胁迫最普遍的反应,GA2ox基因编码了促使GA失去活性的酶。植物在非生物胁迫条件下GA2ox基因表达上调,增加促使GA失活的酶的合成,从而达到降低GA信号的作用。研究拟南芥响应非生物胁迫时,发现编码生长抑制子的DELLA相关基因RGL3同样能降低胁迫条件下GA信号。某些情况下这些基因直接作用于胁迫介导的AP2/ERF型转录因子。对于GA信号和胁迫耐受性之间的关系有待继续研究。
此外,由于DELLA蛋白介导的多种激素通路之间具有一定联系,GA与多种植物激素相互配合调控非生物胁迫。GA广泛参与各类生物和非生物胁迫,了解GA在响应胁迫中的作用对于逆境中提高植物的生长速度和胁迫耐受性是非常重要的。
| [1] | 康云艳, 郭世荣, 段九菊. 新型植物激素与蔬菜作物抗逆性关系研究进展[J]. 中国蔬菜, 2007, 5:39-42. |
| [2] | 刘永庆. 预浸和发芽过程中番茄种子细胞核的倍性变化[J]. 植物生理学报, 1995, 21(1):15-21. |
| [3] | Franklin KA. Shade avoidance[J]. New Phytol, 2008, 179(5):930-944. |
| [4] | Bailey-Serres J, Voesenek LA. Life in the balance:a signaling network controlling survival of flooding[J]. Curr Opin Plant Biol, 2010, 13(5):489-494. |
| [5] | Skirycz A, Inzé D. More from less:plant growth under limited water[J]. Curr Opin Biotechnol, 2010, 21(2):197-203. |
| [6] | Bai MY, Shang JX, Oh E, et al. Brassinosteroid, gibberellin and phytochrome impinge on a common transcription module in Arabidopsis[J]. Nat Cell Biol, 2012, 14(8):810-817. |
| [7] | Ellen HC, Stephen G. The role of gibberellin signalling in plant responses to abiotic stress[J]. J Exp Bot, 2014, 217:67-75. |
| [8] | 潘瑞炽. 植物生理学[M]. 第6版. 北京:高等教育出版社, 2008:167-280. |
| [9] | 李强, 吴建民, 梁和, 等. 高等植物赤霉素生物合成及其信号转导途径[J]. 生物技术通报, 2014(10):16-22. |
| [10] | 岳川, 曾建明, 曹红利, 等. 高等植物赤霉素代谢及其信号转导通路[J]. 植物生理学报, 2012, 48(2):118-128. |
| [11] | O’Neill DP, Davidson SE, Clarke VC, et al. Regulation of the gibberellin pathway by auxin and DELLA proteins[J]. Planta, 2010, 232(5):1141-1149. |
| [12] | Hirano K, Kouketu E, Katoh H, et al. The suppressive function of the rice DELLA protein SLR1 is dependent on its transcriptional activation activity[J]. Plant J, 2012, 71(3):443-453. |
| [13] | Achard P, Gusti A, Cheminant S, et al. Gibberellin signaling controls cell proliferation rate in Arabidopsis[J]. Curr Biol, 2009, 19(14):1188-1193. |
| [14] | Fukao T, Bailey-Serres J. Submergence tolerance conferred by Sub1A is mediated by SLR1 and SLRL1 restriction of gibberellin responses in rice[J]. Proc Natl Acad Sci USA, 2008, 105(43):16814-16819. |
| [15] | Hattori Y, Nagai K, Furukawa S, et al. The ethylene response factors SNORKEL1 and SNORKEL2 allow rice to adapt to deep water[J]. Nature, 2009, 460(7258):1026-1030. |
| [16] | Fukao T, Yeung E, Bailey-Serres J. The submergence tolerance regulator SUB1A mediates crosstalk between submergence and drought tolerance in rice[J]. Plant Cell, 2011(23):412-427. |
| [17] | Keuskamp DH, Sasidharan R, Pierik R. Physiological regulation and functional significance of shade avoidance responses to neighbors[J]. Plant Signal Behav, 2010, 5(6):655-662. |
| [18] | Stamm P, Kumar PP. The phytohormone signal network regulating elongation growth during shade avoidance[J]. J Exp Bot, 2010, 61(11):2889-2903. |
| [19] | Rockwell NC, Su YS, Lagarias JC. Phytochrome structure and signaling mechanisms[J]. Annu Rev Plant Biol, 2006, 57:837-858. |
| [20] | Keller MM, Jaillais Y, Pedmale UV, et al. Cryptochrome 1 and phytochrome B control shade-avoidance responses in Arabidopsis via partially independent hormonal cascades[J]. Plant J, 2011, 67(2):195-207. |
| [21] | Djakovic-Petrovic T, de Wit M, Voesenek LA, et al. DELLA protein function in growth responses to canopy signals[J]. Plant J, 2007, 51(1):117-126. |
| [22] | Feng SH, Martinez C, Gusmaroli G, et al. Coordinated regulation of Arabidopsis thaliana development by light and gibberellins[J]. Nature, 2008, 451(7177):475-479. |
| [23] | 潘教文, 赵术珍, 张烨. 光敏色素互作因子(PIFs)对植物生长发育的调控[J]. 山东农业科学, 2014, 46(6):150-156. |
| [24] | Skirycz A, Claeys H, De Bodt S, et al. Pause-and-stop:the effects of osmotic stress on cell proliferation during early leaf development in Arabidopsis and a role for ethylene signaling in cell cycle arrest[J]. Plant Cell, 201, 23(5):1876-1888. |
| [25] | Atwell BJ. The effect of soil compaction on wheat during early tillering[J]. New Phytol, 1990, 115(10):29-35. |
| [26] | Verelst W, Skirycz A, Inzé D. Acid act at different developmental stages to instruct the adaptation of young leavesto stress[J]. Plant Signal Behav, 2010, 5(4):473-475. |
| [27] | Dubois M, Skirycz A, Claeys H, et al. ETHYLENE RESPONSE FACTOR 6 acts as central regulator of leaf growth under water limiting conditions in Arabidopsis thaliana[J]. Plant Physiol, 2013, 162(1):319-332. |
| [28] | Chapman N, Whalley WR, Lindsey K, et al. Water supply and not nitrate concentration determines primary root growth in Arabidopsis[J]. Plant Cell Environ, 2011, 34(6):1630-1638. |
| [29] | Gao W, Ren T, Bengough AG, et al. Predicting penetrometer resistance from the compression characteristic of soil[J]. Soil Sci Soc Am J, 2012, 76(34):361-369. |
| [30] | Passioura JB. Soil structure and plant growth[J]. J Soil Res, 1991, 29(6):717-728. |
| [31] | Liu FL, Jensen CR, Andersen MN, et al. Hydraulic and chemical signals in the control of leaf expansion and stomatal conductance in soybean exposed to drought stress[J]. Funct Plant Biol, 2003, 30(16):65-73. |
| [32] | Beemster GTS, Masle J. Effects of soil resistance to root penetration on leaf expansion in wheat(Triticum aestivum L. ):composition, number and size of epidermal cells in mature blades[J]. J Exp Bot, 1996, 47(11):1651-1662. |
| [33] | Christmann A, Weiler EW, Steudle E, et al. A hydraulic signal in root-to-shoot signalling of water shortage[J]. Plant J, 2007, 52(1):167-174. |
| [34] | Krugman T, Peleg Z, Quansah L, et al. Alteration in expression of hormone-related genes in wild emmer wheat roots associated with drought adaptation mechanisms[J]. Funct Inteqr Genomics, 2011, 11(4):565-583. |
| [35] | Hussain A, Black CR, Taylor IB, et al. Soil compaction. A role for ethylene in regulating leaf expansion and shoot growth in tomato?[J]. Plant Physiol, 1999, 121(4):1227-1237. |
| [36] | Kaneko M, Itoh H, Inukai Y, et al. Where do gibberellin biosynthesis and gibberellins signaling occur in rice plants?[J]. Plant J, 2003, 35(1):104-115. |
| [37] | Xu K, Xu X, Fukao T, et al. Sub1A is anethylene-response-factor-like gene that confers submergence tolerance to rice[J]. Nature, 2006, 442(7103):705-708. |
| [38] | Achard P, Gong F, Cheminant S, et al. The cold-inducible CBF1 factor-dependent signaling pathway modulates the accumulation of the growth-repressing DELLA proteins via its effect on gibberellin metabolism[J]. Plant Cell, 2008, 20(8):2117-2129. |
| [39] | Magome H, Yamaguchi S, Hanada A, et al. dwarf and delayed-flowering 1, a novel Arabidopsis mutant deficient in gibberellin biosynthesis because of overexpression of a putative AP2 transcription factor[J]. Plant J, 2004, 37(5):720-729. |
| [40] | Magome H, Yamaguchi S, Hanada A, et al. The DDF1 transcriptional activator upregulates expression of a gibberellin-deactivating gene, GA2ox7, under high-salinity stress in Arabidopsis[J]. Plant J, 2008, 56(4):613-626. |
| [41] | Achard P, Cheng H, De Grauwe L, et al. Integration of plant respon-ses to environmentally activated phytohormonal signals[J]. Science, 2006, 311(5757):91-94. |
| [42] | 王彦波, 鲜开梅, 张永华, 等. 赤霉素的应用研究进展[J]. 北方园艺, 2007(6):74-75. |
| [43] | Vettakkorumakankav NN, Falk D, Saxena P, et al. Acrucial role for gibberellins in stress protection of plants[J]. Plant Cell Physiol, 1999, 40(23):542-548. |
| [44] | Achard P, Renou JP, Berthomé R, et al. Plant DELLAs restrain growth and promote survival of adversity by reducing the levels of reactive oxygen species[J]. Curr Biol, 2008, 18(9):656-660. |
| [45] | Ubeda-Tomás S, Federici F, Casimiro I, et al. Gibberellin signaling in the endodermis controls Arabidopsis root meristem size[J]. Curr Biol, 2009, 19(14):1194-1199. |
| [46] | Zentella R, Zhang ZL, Park M, et al. Global analysis of DELLA direct targets in early gibberellin signaling in Arabidopsis[J]. Plant Cell, 2010, 19(10):3037-3057. |
| [47] | Leung J, Merlot S, Giraudat J, et al. The Arabidopsis ABSCISIC ACIDINSENSITIVE2(ABI2)and ABI1 genes encode homologous protein phosphatases 2C involved in abscisic acid signal transduction[J]. Plant Cell, 1997, 9(5):759-771. |
| [48] | Jung KH, Seo YS, Walia H, et al. The submergence tolerance regulator Sub1A mediates stress-responsive expression of AP2/ERF transcription factors[J]. Plant Physiol, 2010, 152(3):1674-1692. |