2.上海交通大学生物医学工程学院,上海 200030
2. School of Biomedical Engineering, Shanghai Jiao Tong University, Shanghai 200030
肿瘤靶向基因治疗成功的关键是调控治疗基因在肿瘤细胞中特异高效地表达。目前,已有的调控手段主要是转录水平的调控,即通过使用肿瘤细胞中被特异性激活的启动子起始治疗基因在肿瘤细胞中的特异性转录[1, 2, 3]。此外,原癌基因的mRNA 5'非翻译区(5'untranslated region,5'UTR)中通常存在多种RNA高级结构[4],这些结构在肿瘤细胞中由于翻译起始因子的过表达[5, 6]失去了原有的阻止下游基因进行蛋白翻译的功能,使得原癌基因在肿瘤细胞中处于过表达的状态。利用这一特性,将治疗基因置于这类5'UTR的下游可以在翻译水平实现治疗基因在肿瘤细胞中的特异性表达[7, 8]。另一方面,原癌基因mRNA 3'非翻译区(3'UTR)中包含多种抑癌microRNA(miRNA)的识别结合位点[9]。在肿瘤细胞中由于抑癌miRNA的表达下调,在转录后水平上失去了对多种原癌基因mRNA的降解或抑制蛋白翻译的功能[10]。利用抑癌miRNA的表达差异,将原癌基因的3'UTR置于治疗基因的下游可以提高其mRNA在肿瘤细胞中的稳定性和翻译效率[11, 12]。
结合上述3种调控机制的优点,本研究首次构建一种同时包含上述3种调控元件的嵌合型靶向调控元件,使用原癌基因Survivin启动子,c-Myc和HIF-1α 5'UTR及p110δ 3'UTR在转录水平、翻译水平及转录后水平上共同调控治疗基因单纯疱疹病毒-1(HSV-1)胸腺激酶(thymidine kinase,TK)的表达,以前列腺癌细胞系为例,实现治疗基因在肿瘤细胞中的特异高效表达,旨在为基因靶向治疗应用于包括前列腺癌在内的诸多肿瘤提供一种全新的策略。
1 材料与方法 1.1 材料前列腺细胞系LNCaP、PC3,正常前列腺上皮细胞系(对照)PNT1B均购于美国菌种保藏中心(ATCC),RPMI-1640和DMEM基础培养基及胎牛血清均购于Gibco公司;X-tremeGENE HP DNA 转染试剂购于罗氏公司;mRNA逆转录和qRT-PCR 试剂盒均购于TaKaRa公司;microRNA逆转录试剂盒、Taqman MicroRNA Assay试剂盒及特异性逆转录引物均购于Applied Biosystem公司;用于质粒构建的限制性内切酶均购于New England Biolabs公司;用于质粒构建的T4连接酶购于TaKaRa公司;感受态细胞DH5α、DNA琼脂糖胶回收及质粒抽提纯化试剂盒购于Tiangen公司;Western Blot显影检测试剂盒购于millipore公司;HIF-1α抗体购于Proteintech公司,c-Myc抗体购于Cell Signaling Technology公司,Survivin、p110δ、GAPDH抗体购于Santa Cruz公司;羊抗兔二抗购于Cell Signaling Technology公司;双荧光素酶报告检测试剂盒、检测用内参质粒pcmv-RL均购于Promega公司;细胞存活检测试剂MTT购于碧云天生物技术研究所;引物及DNA片段的合成和质粒测序由上海生工公司完成;流式细胞分析使用BD Accui C6流式细胞仪;荧光素酶活性使用Berthold lumat LB9507 luminometer进行检测;MTT细胞存活实验使用Bio-tek公司酶标仪(synergy)检测吸光度值;Western Blot显影成像使用Bio-Rad公司化学发光仪Bio-Rad ChemiDoc XRS检测。
1.2 方法 1.2.1 质粒构建原始质粒pEF-MCS为本实验室保存质粒。将该质粒及合成的Survivin启动子序列(999 bp)通过EcoR I/Hind III双酶切后连接入质粒中并替换原有EF1α启动子(持家基因启动子431 bp,对照)得到包含有肿瘤特异性激活启动子的质粒,命名为pSuv-MCS。将pSuv-MCS、合成的c-Myc 5'UTR片段(461 bp)及HIF-1α 5'UTR片段(594 bp)通过Hind III/BamH I双酶切后分别连接入质粒pSuv-MCS中得到同时包含肿瘤特异性激活启动子及原癌基因5'UTR的质粒,分别命名为pSuv-5UC-MCS、pSuv-5UH-MCS。将pSuv-5UC-MCS质粒和HIF-1α 5'UTR片段通过BamH I/Nco I双酶切后连接入质粒pSuv-5UC-MCS中得到串联排列c-Myc及HIF-1α 5'UTR的质粒,命名为pSuv-5UC-H-MCS。此外,通过Nco I/Xba I双酶切质粒pFUGW、pFULW以及sHSV-TK(3种质粒均为本实验室保存)分别获得增强型绿色荧光蛋白(EGFP,740 bp)片段、荧光素酶(luciferase,1 600 bp)片段以及单纯疱疹病毒-1胸腺激酶(HSV-1 TK,1 145 bp)片段。将上述构建的质粒及pEF-MCS同样通过Nco I/Xba I双酶切后插入相应的报告基因(EGFP,luciferase)或治疗基因(HSV-1 TK),获得用于后续实验的表达载体,分别命名为pEF-GFP / -luc / -TK;pSuv-GFP / -luc / -TK;pSuv-5UC-GFP / -luc / -TK;pSuv-5UH-GFP / -luc / -TK;pSuv-5UC-H-GFP / -luc / -TK。对于pSuv-5UC-H-GFP / -luc / -TK三种质粒,通过Nhe I/EcoR V双酶切三者及合成的p110δ 3'UTR(1 057 bp)片段,连接入质粒后得到包含有肿瘤特异性激活启动子、原癌基因5'UTR和3'UTR的嵌合型表达载体,分别命名为pSuv-5UC-H-3UP-GFP / -luc / -TK。各相关质粒包含的元件结构简图可如图 1所示。
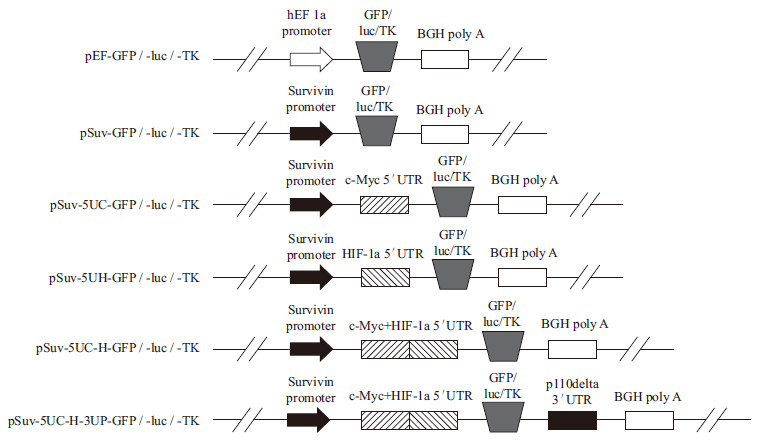 |
| 图 1 包含嵌合型调控元件的EGFP 报告基因、荧光素酶报告基因、TK 杀伤基因表达载体质粒结构简图 |
人前列腺癌细胞系PC3使用含10%胎牛血清的DMEM培养基;LNCaP和PNT1B使用含10%胎牛血清的RPMI-1640培养基,在37℃含5% CO2的恒温培养箱中进行常规氧含量条件下培养。进行低氧培养时需将培养气体条件更改为94% N2∶5% CO2∶1%O2的混合气体,其余条件保持不变。进行细胞转染时,先取5×104细胞于24孔板中贴壁培养24 h,每孔使用2 μg质粒、3 μL转染试剂按照相关的操作说明书操作。转染后48 h进行后续的相关检测。另外,对于含有荧光素酶报告基因的质粒,需同时转染内参质粒pcmv-RL(2 ng/孔)用于双荧光素酶报告检测。
1.2.3 双荧光素酶报告检测该检测按照相关的操作说明书操作。简单而言,将转染后48 h的细胞用PBS清洗两次并加入1x裂解液(试剂盒中包含)室温下裂解10 min,依次检测构建的表达载体中所含的萤火虫荧光素酶报告基因活性以及内参质粒中所含的海肾荧光素酶报告基因活性。按照操作说明计算相对荧光素酶活性的数值。
1.2.4 流式细胞分析将细胞转染表达EGFP报告基因的质粒后48 h,收集细胞并计数至细胞浓度为1×106/mL。使用BD Accui C6流式细胞仪,选取GFP通道并设置相关参数后分析GFP阳性细胞数量。每组实验重复3次平行样,每次均记录总量为105个活细胞,使用Flowjo软件分析GFP阳性细胞比例。
1.2.5 细胞存活检测在相应细胞系中转染表达治疗基因(TK)的表达载体,48 h后更换新鲜培养基并加入更昔洛韦(GCV)至终浓度10 μg/mL(Sigma-Aldrich)。给药48 h后去除死亡的细胞,并再次更换新鲜培养基后,于每孔中加入10 μL MTT检测试剂,在恒温培养箱中孵育3 h,使用酶标仪在490 nm波长处检测相应的吸光度值,每组实验重复3次平 行样。
1.2.6 qRT-PCR使用Trizol试剂(Invitrogen)提取各细胞系中的总RNA后按mRNA逆转录试剂盒提供的相关操作方法将mRNA逆转录为cDNA,使用SYBR-Green(TOYOBO)进行实时定量PCR反应。各基因检测结果使用GAPDH进行标准化处理。对于miR-7,使用microRNA逆转录试剂盒及特异性逆转录引物进行逆转录反应,使用Taqman MicroRNA Assay试剂盒进行实时定量 PCR 反应。检测结果使用U44 snRNA作为内参进行标准化处理。qRT-PCR使用的引物序列,见表 1。
收集1×107细胞使用100 μL RIPA裂解液(150 mmol/LNaCl,1% Triton-X 100,0.1%SDS,10 mmol/L Tris-HCl PH7.4,1 mmol/L PMSF)在冰上裂解20 min,离心收集上清后与上样缓冲液(TaKaRa)混匀煮沸进行SDS-PAGE电泳并转移至硝酸纤维素膜。在含5% BSA的TBST(10 mmol/L Tris-HCl pH7.4,150 mmol/L/LNaCl,0.05% Tween-20)中将含有蛋白样品的硝酸纤维素膜封闭1 h后,依次分别加入相应的一抗及二抗孵育。使用TBST洗涤后进行显影检测并用Bio-Rad ChemiDoc XRS化学发光仪成像。
1.2.8 肿瘤表达特异性计算及相关统计分析使用“相对表达率(Relative ratio)”表示目的基因在肿瘤细胞系中的表达特异性。相对表达率=目的基因在肿瘤细胞系中的表达量/目的基因在正常细胞系对照中的表达量。对于EGFP报告基因,使用GFP阳性细胞比例指针其表达量;对于荧光素酶报告基因,使用相对荧光素酶活性指针其表达量。使用t检验分析不同组间的显著性差异,当P < 0.05时定义为有显著差异,标记为“*”;当P < 0.01时定义为有极显著差异,标记为“**”。
2 结果 2.1 前列腺癌细胞系中鉴定相关基因的内源表达在前列腺癌细胞系LNCaP、PC3,正常前列腺上皮细胞系PNT1B中通过qRT-PCR 及Western blot,分别在mRNA水平、蛋白水平上检测原癌基因Survivin,c-Myc,HIF-1α,p110δ和抑癌miRNA miR-7在3种细胞系中的表达情况。qRT-PCR的结果(图 2)显示,与正常细胞系PNT1B相比,Survivin,c-Myc,HIF-1α和p110δ的mRNA表达在LNCaP中均显著上调,同时miR-7的表达则显著下调。在PC3中,虽然Survivin 和p110δ的mRNA表达显著上调,但是HIF-1α的表达仅略高于对照而c-Myc的表达则低于对照。在蛋白水平上Western blot检测同样得到相似的结果(图 2)。
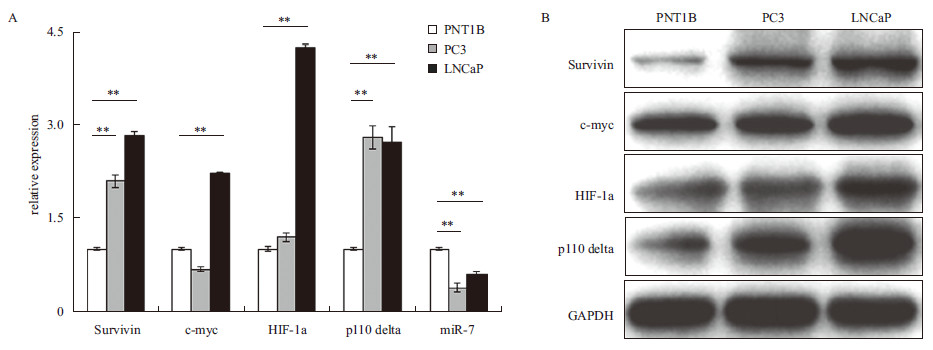 |
| ** :P < 0.01图 2 survivin、c-Myc、HIF-1α、p110δ、miR-7 在前列腺癌细胞系PC3、LNCaP 以及正常前列腺上皮细胞系PNT1B 中的mRNA 水平(A)及蛋白水平(B)的内源表达 |
将包含上述调控元件的EGFP表达载体分别转染PNT1B和LNCaP 细胞,经流式细胞仪检测GFP阳性的细胞比率(图 3-A),并计算EGFP基因在LNCaP细胞中的表达特异性。结果(图 3-B)显示,在常氧培养条件下,使用持家基因EF1α启动子驱动EGFP的表达不具有肿瘤特异性(相对表达率=98%);使用肿瘤特异性Survivin启动子后,肿瘤表达特异性上升为143%。在此基础上加入c-Myc 5'UTR进行翻译水平调控后,肿瘤表达特异性进一步上升为211%;然而改用HIF-1α 5'UTR后发现未能进一步提高肿瘤表达特异性(相对表达率=130%)。将两种5'UTR串联使用后,发现可以提高肿瘤表达特异性至230%;在此基础上继续加入p110δ 3'UTR进行转录后水平调控后,肿瘤表达特异性显著提高至420%,验证了在转录水平、翻译水平和转录后水平上进行联合调控后,在常氧培养条件下能够实现目的基因在肿瘤细胞中的特异性表达。
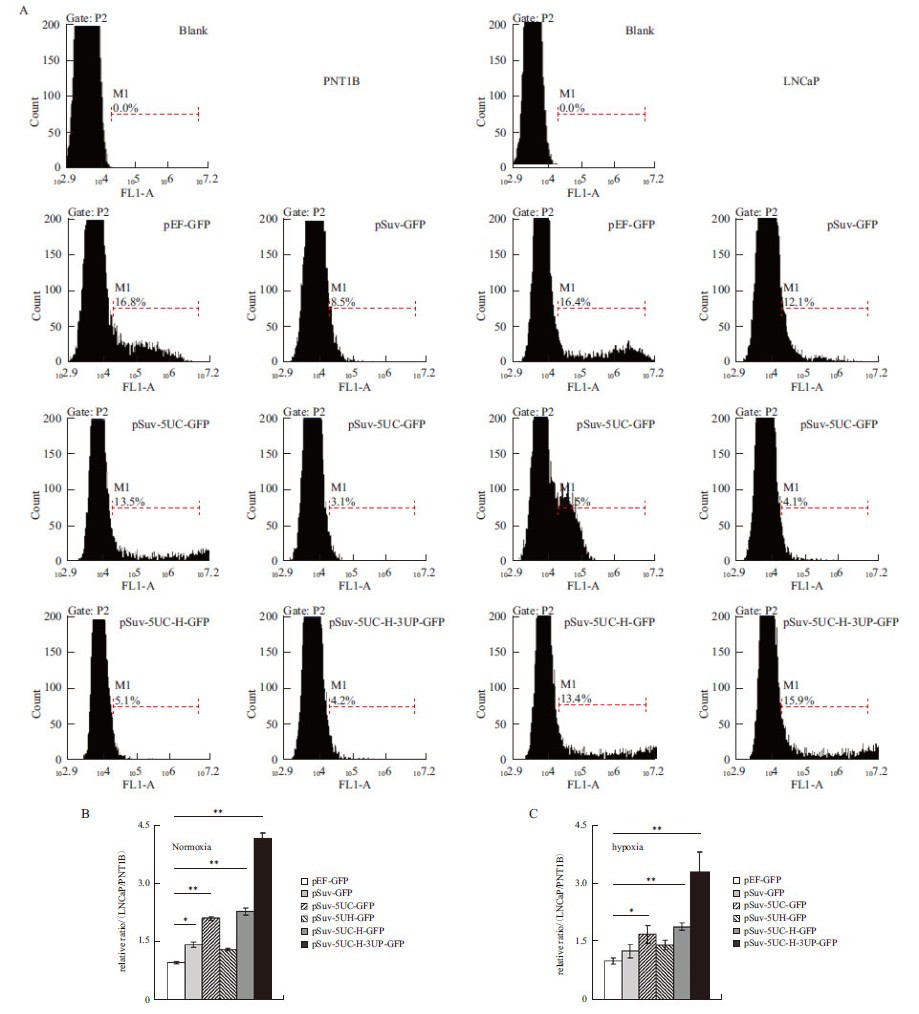 |
| A :流式细胞检测相应的表达质粒分别转染PNT1B 及LNCaP 细胞后,细胞中EGFP 基因的表达情况,所有检测均重复3 个平行样,选取 其一列示图中;B :在常氧培养条件下,嵌合型调控元件能有效提高EGFP 基因在LNCaP 细胞中的表达特异性;C :在低氧培养条件下, 嵌合型调控元件同样可以提高EGFP 基因在LNCaP 细胞中的表达特异性;* :P < 0.05,** :P < 0.01图 3 嵌合型调控元件在常氧培养及低氧培养条件下报告基因EGFP 在LNCaP 中的特异性表达情况 |
另一方面,为了进一步考察HIF-1α 5'UTR在翻译水平上对目的基因的调控作用,在低氧培养条件下再次进行上述实验。结果(图 3-C)显示,在Survivin启动子联合HIF-1α 5'UTR调控下(pSuv-5UH-GFP),EGFP的肿瘤特异性表达有所上升(140%,常氧条件下为130%,图 3-B,3-C),暗示了该5'UTR在低氧条件下能够更加有效地发挥其调控作用。尽管如此,在串联使用c-Myc、HIF-1α 5'UTR以及进一步追加p110δ 3'UTR的情况下,EGFP的肿瘤特异性表达相比常氧条件下均有所降低(对于pSuv-5UC-H-GFP,190%比230%;对于pSuv-5UC-H-3UP-GFP,330%比420%,图 3-B,3-C)。上述结果表明,构建的嵌合型调控元件在常氧和低氧条件下均能有效地实现目的基因在肿瘤细胞中的特异性表达。
2.3 双荧光素酶报告系统检测荧光素酶报告基因的肿瘤细胞特异性表达将包含上述调控元件的荧光素酶表达载体分别转染PNT1B和LNCaP 细胞,使用luminometer检测并计算相对荧光素酶活性。结果(图 4)显示,常氧条件下使用Survivin启动子联合c-Myc 5'UTR调控(pSuv-5UC-luc),荧光素酶的肿瘤表达特异性提高至183%;串联使用HIF-1α 5'UTR后(pSuv-5UC-H-luc)进一步提高至215%,显著优于仅使用HIF-1α 5'UTR进行翻译水平调控(相对表达率=127%)。进一步加入p110δ 3'UTR实现嵌合型调控后(pSuv-5UC-H-3UP-luc),荧光素酶的肿瘤表达特异性显著提高至480%。上述实验通过定量分析,进一步验证了构建的嵌合型调控元件可以发挥肿瘤细胞特异性表达调控的作用。
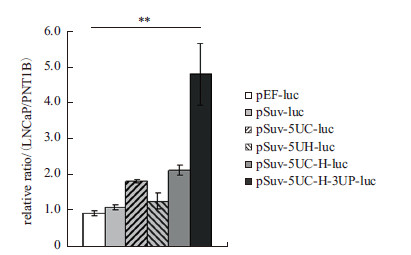 |
| ** :P < 0.01图 4 在常氧培养条件下,荧光素酶报告基因在LNCaP 细 胞中的表达特异性情况 |
将包含上述调控元件的治疗基因(TK)表达载体分别转染PNT1B和LNCaP 细胞,在加入TK底物GCV 48 h后使用MTT试剂检测细胞存活情况。结果(图 5)显示,在正常细胞PNT1B中加入GCV未引起细胞大量死亡(平均细胞存活率97.5%±2.13%),在LNCaP细胞中加入GCV后,随着使用的调控元件增加,细胞存活率逐次降低。当使用Survivin启动子、联合c-Myc串联HIF-1α 5'UTR以及p110δ 3'UTR实现嵌合型调控后,肿瘤细胞对TK激活GCV导致的细胞毒性能够产生最大的应答,其细胞存活率显著下调至61.2%±3.09%。这些结果表明,构建的嵌合型调控元件可以调控治疗基因在肿瘤细胞中的异性表达,发挥肿瘤细胞特异的杀伤作用。
 |
| * :P < 0.05,** :P < 0.01图 5 在常氧培养条件下,TK 杀伤基因在LNCaP 细胞中 的特异性表达情况 |
实现杀伤基因在肿瘤细胞中特异高效表达是肿瘤靶向研究的核心目标[13]。本研究在已有研究的基础上,构建了一种嵌合型肿瘤靶向表达调控元件,通过在转录水平、翻译水平和转录后水平上进行联合调控,以前列腺癌细胞系为例,实现了对肿瘤细胞的特异性杀伤。
在本研究中,我们使用Survivin基因的启动子调控目的基因的转录。Survivin在多种肿瘤中均发现与抗凋亡[14]、肿瘤转移[15]以及放化疗抵抗相关[16]。本研究中同样发现其在前列腺癌细胞系中处于高表达的状态,暗示了该基因的启动子在肿瘤细胞中被特异性激活,能够高效特异地启动下游基因的转录。同时,本研究中将c-Myc 5'UTR与HIF-1α 5'UTR串联,在翻译水平上共同发挥在正常细胞中阻止蛋白翻译的作用。作为与肿瘤增殖、肿瘤血管生长密切相关的两个原癌基因[17, 18],已有研究发现两者的5'UTR中均存在“内部核糖体进入位点”(internal ribosome entry sites,IRESs)这一顺式作用元件[19, 20]。在肿瘤细胞中由于翻译起始因子的过表达[6],可以通过该位点启动mRNA的翻译[20]。本研究中使用两者的5'UTR实现了目的基因在肿瘤细胞中的高效翻译。另外,本研究的结果显示在低氧环境下单独使用HIF-1α 5'UTR较常氧环境能提高报告基因EGFP在肿瘤细胞中的表达[相对表达率140%(低氧):130%(常氧)]。但是在单独使用c-Myc 5'UTR以及串联两者进行翻译调控时,常氧环境对于提高目的基因在肿瘤细胞中的相对表达率更有利。暗示了在前列腺癌细胞系中,该元件中c-Myc 5'UTR较之HIF-1α 5'UTR发挥主要的翻译水平调控的作用。在此基础上,本研究进一步引入p110δ 3'UTR在转录后水平上增强目的基因在肿瘤细胞中的特异性表达。我们的前期研究发现,p110δ作为磷酸肌醇-3激酶(PI3K)的重要催化亚基[21]在肝癌细胞中高表达,并受microRNA-7(miR-7)负调控[22]。在本研究中,我们同样发现相对于正常前列腺上皮细胞系对照,p110δ在前列腺癌细胞系中处于高表达而miR-7则处于低表达,暗示了通过与p110δ 3'UTR互作,miR-7可以在正常细胞中靶向引起目的基因mRNA的降解或翻译抑制而不影响其在肿瘤细胞中的稳定性。本研究的结果显示,当加入p110δ 3'UTR构成完整的嵌合型调控元件后,报告基因EGFP和荧光素酶的肿瘤细胞相对表达率分别提高到420%及480%,杀伤基因作用下的肿瘤细胞存活率降低到61%。这些结果表明,相较单一水平的表达调控该嵌合型调控元件实现了在多个水平上的联合调控,可以有效地提高目的基因的肿瘤靶向性表达。
此外,针对不同组织来源的肿瘤特性,将该嵌合型调控元件的组分进行替换后,可以应用于前列腺癌以外的其他肿瘤,具有广泛的应用前景。
4 结论本研究成功构建了一种嵌合型表达调控元件,能够在转录水平、翻译水平及转录后水平上联合调控目的基因的表达,实现了目的基因在肿瘤细胞中的特异性表达。
| [1] | Lie-A-Ling M, Bakker CT, Deurholt T, et al. Selection of tumour specific promoters for adenoviral gene therapy of cholangiocarcinoma[J]. J Hepatol, 2006, 44(1):126-133. |
| [2] | Foka P, Pourchet A, Hernandez AR, et al. Novel tumour-specific promoters for transcriptional targeting of hepatocellular carcinoma by herpes simplex virus vectors[J]. J Gene Med, 2010, 12(12):956-967. |
| [3] | Fang L, Shanqu L, Ping G, et al. Gene therapy with RNAi targeting UHRF1 driven by tumor-specific promoter inhibits tumor growth and enhances the sensitivity of chemotherapeutic drug in breast cancer in vitro and in vivo[J]. Cancer Chemother Pharmacol, 2012, 69(4):1079-1087. |
| [4] | Lukowski SW, Rothnagel JA, Trezise AE. CFTR mRNA expression is regulated by an upstream open reading frame and RNA secondary structure in its 5' untranslated region[J]. Hum Mol Genet, 2015, 24(4):899-912. |
| [5] | Wolfe AL, Singh K, Zhong Y, et al. RNA G-quadruplexes cause eIF4A-dependent oncogene translation in cancer[J]. Nature, 2014, 513(7516):65-70. |
| [6] | Spilka R, Ernst C, Mehta AK, et al. Eukaryotic translation initiation factors in cancer development and progression[J]. Cancer Lett, 2013, 340(1):9-21. |
| [7] | DeFatta RJ, Li Y, De Benedetti A. Selective killing of cancer cells based on translational control of a suicide gene[J]. Cancer Gene Ther, 2002, 9(7):573-578. |
| [8] | Moussavi M, Moshgabadi N, Fazli L, et al. Fibroblast growth factor and ornithine decarboxylase 5'UTRs enable preferential expression in human prostate cancer cells and in prostate tumors of PTEN(-/-)transgenic mice[J]. Cancer Gene Ther, 2012, 19(1):19-29. |
| [9] | Cipollini M, Landi S, Gemignani F. MicroRNA binding site polymorphisms as biomarkers in cancer management and research[J]. Pharmgenomics Pers Med, 2014, 7:173-1791. |
| [10] | Valinezhad Orang A, Safaralizadeh R, Kazemzadeh-Bavili M. Mechanisms of miRNA-mediated gene regulation from common downregulation to mRNA-specific upregulation[J]. Int J Genomics, 2014:970607. |
| [11] | Mazzacurati L, Marzulli M, Reinhart B, et al. Use of miRNA response sequences to block off-target replication and increase the safety of an unattenuated, glioblastoma-targeted oncolytic HSV[J]. Mol Ther, 2015, 23(1):99-107. |
| [12] | Li JM, Kao KC, Li LF, et al. MicroRNA-145 regulates oncolytic herpes simplex virus-1 for selective killing of human non-small cell lung cancer cells[J]. Virol J, 2013, 10:241. |
| [13] | Lai YH, Lin CC, Chen SH, et al. Tumor-specific suicide gene therapy for hepatocellular carcinoma by transcriptionally targeted retroviral replicating vectors[J]. Gene Ther, 2015, 22(2):155-162. |
| [14] | Habibie, Yokoyama S, Abdelhamed S, et al. Survivin suppression through STAT3/β-catenin is essential for resveratrol-induced melanoma apoptosis[J]. Int J Oncol, 2014, 45(2):895-901. |
| [15] | Kogo R, How C, Chaudary N, et al. The microRNA-218-Survivin axis regulates migration, invasion, and lymph node metastasis in cervical cancer[J]. Oncotarget, 2015, 6(2):1090-1100. |
| [16] | Paik S, Shak S, Tang G, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer[J]. N Engl J Med, 2004, 351(27):2817-2826. |
| [17] | Hynes NE, Stoelzle T. Key signalling nodes in mammary gland development and cancer:Myc[J]. Breast Cancer Res, 2009, 11(5):210. |
| [18] | Meijer TW, Kaanders JH, Span PN, et al. Targeting hypoxia, HIF-1, and tumor glucose metabolism to improve radiotherapy efficacy[J]. Clin Cancer Res, 2012, 18(20):5585-5594. |
| [19] | Shi Y, Frost P, Hoang B, et al. MNK kinases facilitate c-myc IRES activity in rapamycin -treated multiple myeloma cells[J]. Oncogene, 2013, 32(2):190-197. |
| [20] | Lang KJ, Kappel A, Goodall GJ. Hypoxia-inducible factor-1alpha mRNA contains an internal ribosome entry site that allows efficient translation during normoxia and hypoxia[J]. Mol Biol Cell, 2002, 13(5):1792-1801. |
| [21] | Sujobert P, Bardet V, Cornillet-Lefebvre P, et al. Essential role for the p110delta isoform in phosphoinositide 3-kinase activation and cell proliferation in acute myeloid leukemia[J]. Blood, 2005, 106(3):1063-1066. |
| [22] | Fang Y, Xue JL, Shen Q, et al. MicroRNA-7 inhibits tumor growth and metastasis by targeting the phosphoinositide 3-kinase/Akt pathway in hepatocellular carcinoma[J]. Hepatology, 2012, 55(6):1852-1862. |





