食管癌是最常见的消化道恶性肿瘤之一,在疾病的晚期才会出现明显的临床症状,现在的治疗手段虽取得显著疗效,但患者的愈后仍然较差。食管癌基因学方面的研究虽然已经获得了一些关键的进展,但是食管癌相关确切的生物学分子及相关的基因调控网络在食管癌发生、发展中的具体作用和明确的机制有待继续深入研究。为了早期筛查、早期发现、早期诊断以及早期治疗食管癌,我们仍需对食管癌开展大量的研究工作。ERK1/2 MAPK信号传导通路是引起细胞增殖最为重要的信号传导通路之一,并且一些关键生长因子及原癌基因和癌基因通过该级联反应转导,促进细胞生长和分化。前期研究工作已发现miR-21过表达可能通过促进ERK1/2 MAPK信号通路活化,促进食管鳞状细胞癌(ESCC) 细胞增殖、抑制细胞凋亡和加速细胞周期,最终导致 ESCC细胞异常生长[1, 2]。本研究对ERK1/2 MAPK信号传导通路在ESCC中对细胞增殖、周期和凋亡等生物效应的影响进行分析,并阐述其作用机制。
1 材料与方法 1.1 材料食管鳞癌细胞系Eca109(中国科学院上海生命科学研究院细胞资源中心),胎牛血清(FBS)、DMEM培养基(Gibco公司),U0126(Promega公司),用234 µL二甲基亚砜(DMSO)重悬1mg U0126,即可得到浓度为10 mmol/L的储存液,无抗无血清DMEM培养液稀释U0126储存液成所需浓度工作液,顺铂(齐鲁药业有限公司),Trizol、WesternBreeze 免疫检测试剂盒(Invitrogen公司),DMSO(Sigma公司),PrimeScriptTM one step RT-PCR kit反转录试剂盒、SYBR Premix(大连宝生物公司),RIPA裂解液、BCA蛋白定量试剂盒(博迈德公司),ERK1/2抗体(Celling Signaling Technology 公司),β-tubulin抗体(Santa Cruz Biotechnology公司),RT-PCR引物由TaKaRa公司设计并合成。
1.2 方法 1.2.1 细胞培养和U0126干预5×105细胞/孔接种6孔板,含有5% FBS的DMEM培养液,37℃、5% CO2的培养箱内孵育,正常培养24 h达到80%汇合,用磷酸缓冲液(PBS)洗去悬浮细胞,20 μmol/L浓度的MAPK(ERK1/2)抑制剂U0126干预Eca109细胞。
1.2.2 细胞转染对数生长期的Eca109细胞转染前1 d以5×105细胞/孔的密度接种6孔板,当细胞融合度达到80%时进行转染。pCMV-miR-21转染按Lipofectamine 2000说明书步骤进行。
1.2.3 平板克隆实验 Eca109细胞以5×102细胞/孔的密度接种于6孔培养板中,正常培养过夜,更换培养液。分别于转染后24、72、120、168、216和264 h在显微镜下观察细胞克隆形成的数量及大小,随机选取10个视野进行观察并计数。
1.2.4 细胞凋亡检测收集6孔板内细胞到1.5 mL的离心管中,1 000 r/min离心5 min,弃去废旧的培养液。用预冷的PBS洗2次,1 000 r/min离心5 min。按照细胞凋亡试剂盒步骤准备样品,尽快进入流式细胞室,离心管中细胞悬液用200-400目筛网过滤,获得单细胞悬液,488 nm兴奋并在530 nm和575 nm检测荧光测定细胞凋亡。
1.2.5 细胞周期实验 消化收集细胞,离心15 min,PBS洗两遍,弃上清。1 mL预冷的PBS充分悬浮细胞,之后缓慢加入3 mL无水乙醇(-20℃预冷),终浓度为70%-75%,-4℃固定过夜。800 r/min离心15 min收集固定细胞,加入3 mL PBS室温再水化15 min,800 r/min,离心5 min,PBS清洗。0.5 mL PBS重悬细胞,加入25 μL PI(1 mg/mL)至终浓度为50 μg/mL和 5 μL RnaseA(10 mg/mL)至终浓度100 µg/mL,37℃温浴避光30 min。200-400目筛网过滤细胞,获得单细胞悬液,流式细胞仪测定细胞周期。
1.2.6 qRT-PCR扩增Trizol方法抽提细胞中的总RNA,反转录试剂盒将RNA反转录为cDNA。qRT-PCR反应体系为20 µL,模板2 µL(2 µg),上下游引物各0.5 µL(10 pmol),SYBR 10 µL、ddH2O 7 µL,反应参数为95℃预变性10 min;95℃变性15 s,60℃退火30 s,40个循环。
1.2.7 Western-blot1×106个细胞加入RIPA裂解液80 µL,12 000 r/min离心5 min,收集上清,BCA法测定蛋白质浓度。取50 µg蛋白质于10%十二烷基磺酸钠(SDS)聚丙烯酰胺凝胶中,25 mA/胶恒定电流电泳至分离胶底端;80 V恒定电压、常温、100 min转至PVDF膜上,封闭1 h。加入β-tubulin、t-ERK1/2、p-ERK抗体(1∶1 000稀释于一抗稀释液中)于4℃过夜。加入通用性二抗,室温反应2 h,显色试剂作用直至条带出现,ddH2O终止显色反应。信号条带利用Quantity one软件进行灰度扫描。
1.2.8 统计学分析所有数据采用SPSS 17.0统计软件(Chicago,IL,USA)进行统计学处理,计算结果均以表示,组间比较采用单因素方差分析或LSD t检验。
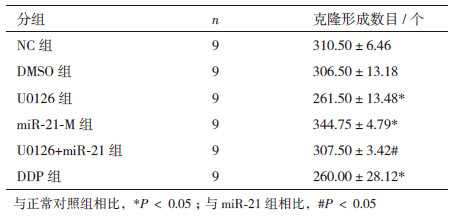
2 结果 2.1 ERK1/2促进Eca109细胞增殖如表 1、图 1所示,正常对照组和DMSO组Eca109细胞克隆形成出现早,数量多,直径大,U0126组Eca109细胞克隆形成时间晚,数量减少,直径小。与正常对照组相比,U0126组Eca109细胞克隆形成数目减少了15.783%(P<0.05);与miR-21组相比,U0126+ miR-21组细胞克隆形成数目降低了12.11%(P<0.05);结果表明ERK1/2 MAPK信号通路抑减弱Eca109细胞克隆形成能力,而且抑制由miR-21过表达诱导的细胞克隆形成。
 |
| 图 1 ERK1/2 MAPK 信号通路调控细胞克隆形成 |
如表 2、图 2所示,与正常对照组相比,U0126组Eca109细胞凋亡增加了357.24%(P<0.05);与miR-21组相比,U0126+miR-21组细胞凋亡增加了410.13%(P<0.05)。结果表明ERK1/2 MAPK信号通路抑制可以促进Eca109细胞凋亡,而且可以反转由miR-21过表达诱导的细胞凋亡抑制作用。
 |
| 图 2 ERK1/2 MAPK 信号通路调控Eca109 细胞凋亡 |
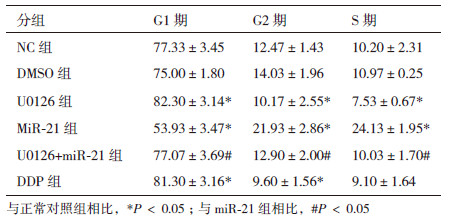
结果如表 3、图 3所示,与正常对照组相比,U0126组G1期细胞增加了6.42%(P<0.05),G2期减少了18.45%(P<0.05),S期减少了26.15%(P<0.05);与miR-21组相比,U0126+ miR-21组G1期细胞增加了42.89%(P<0.05),G2期减少了41.18%(P<0.05),S期减少了58.43%(P<0.05)。结果表明ERK1/2 MAPK通路抑制能够促进Eca109大量停滞于细胞周期G1期,抑制细胞进入S期G2期,因此抑制细胞增殖能力;而且可以反转由miR-21过表达诱导的细胞周期改变。
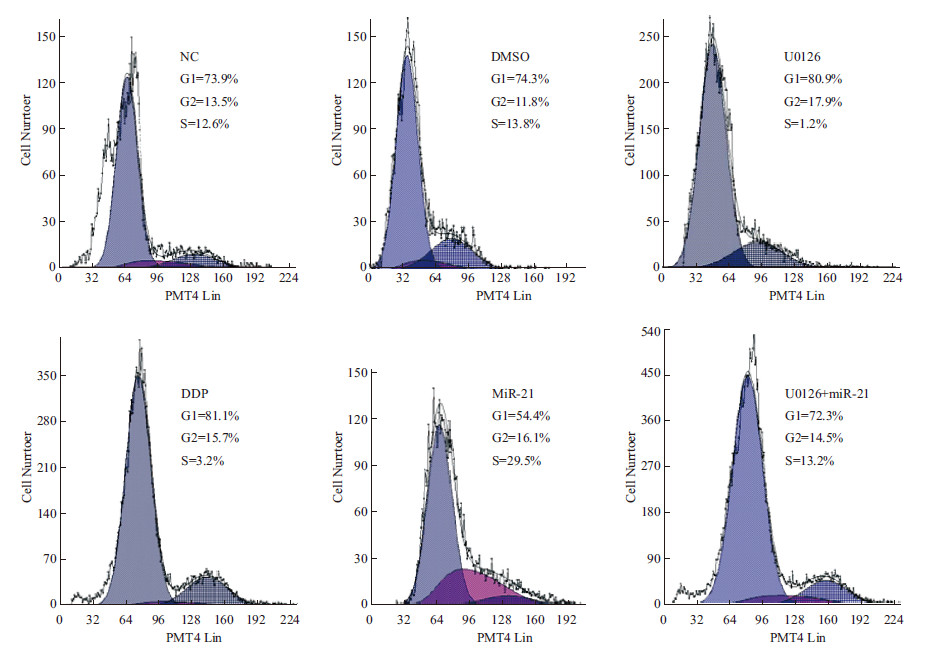 |
| 图 3 ERK1/2 MAPK通路调控Eca109细胞周期 |
如表 4、图 4所示,与正常对照组相比,U0126组Eca109细胞中miR-21表达降低了93.77%(P<0.05);转染质粒pCMV-miR-21使miR-21表达增加了13.33倍(P<0.05)。与miR-21组相比,U0126+miR-21组细胞中miR-21表达减少了93.26%(P<0.05)。结果表明ERK1/2 MAPK信号通路抑制显著下调Eca109细胞中内源性miR-21表达,而且抑制外源性miR-21表达。
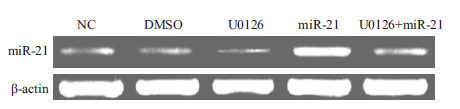 |
| 图 4 各组Eca109细胞中miR-21表达 |
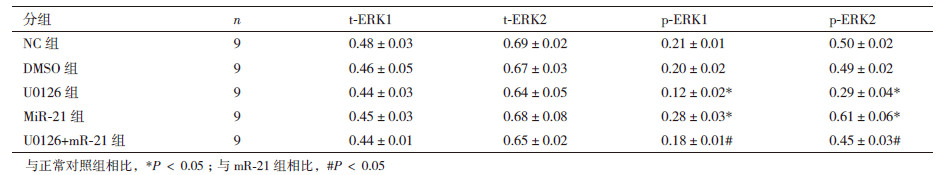
如表 5,图 5所示,与正常对照组相比,U0126组Eca109细胞中p-ERK1/2表达明显抑制(P < 0.05);miR-21组中p-ERK1/2表达明显增高(P < 0.05)。与miR-21组相比,U0126+miR-21组中p-ERK1/2表达明显抑制(P < 0.05)。结果表明ERK1/2 MAPK信号通路抑制在转录后水平抑制Eca109细胞中ERK1/2 MAPK信号传导通路活化,而且可以反转由miR-21过表达诱导的ERK1/2 MAPK信号通路活化。
 |
| 图 5 各组在转录后水平对ERK1/2 MAPK信号通路活化的影响 |
我们在前期研究工作中发现,ERK1/2在ESCC组织中明显高表达[3],并且促进Eca109细胞增殖和迁移[4],而肿瘤细胞克隆形成、细胞周期和细胞周期都可影响细胞增殖能力。因此,我们检测ERK1/2对Eca109细胞克隆形成、细胞周期和细胞凋亡的调控作用及相关机制。平板克隆形成实验不仅可以检测贴壁和有增殖活力的单个肿瘤细胞形成克隆的能力,而且可以帮助评价单个肿瘤细胞的增殖能力。文献报道ERK1/2在恶性间皮细胞瘤[5]、间变性大细胞淋巴瘤[6]和肝癌[7]等肿瘤体外细胞实验中促进细胞克隆形成。本实验结果发现正常对照组和DMSO组Eca109细胞克隆形成出现早,数量多,直径大;U0126组Eca109细胞克隆形成时间晚,数量减少,直径小,细胞克隆形成数目显著减少;实验结果发现ERK1/2 MAPK信号通路抑不仅减弱Eca109细胞克隆形成能力,而且反转由miR-21过表达诱导的细胞克隆形成作用。
ERK1/2 MAPK信号通路在卵巢癌[8]、恶性胶质细胞瘤[9]、表皮样癌[10]、非小细胞肺癌[11]和子宫内膜癌[12]等肿瘤体外细胞实验中显著抑制细胞凋亡,促进细胞增殖。因此我们检测ERK1/2 MAPK信号通路对Eca109细胞凋亡的调控。结果发现ERK1/2 MAPK信号通路抑制不仅促进Eca109细胞凋亡,而且可以反转由miR-21过表达诱导的细胞凋亡抑制作用。
ERK1/2 MAPK信号通路在人类肝细胞癌[13, 14]、胰腺癌[15]、肝细胞癌[16]、胶质瘤[17, 18]、非小细胞肺癌[19]等体外细胞实验中抑制细胞凋亡,促进细胞增殖。因此,我们检测ERK1/2 MAPK信号通路对Eca109细胞周期的调控。结果发现ERK1/2 MAPK信号通路抑制能够促进Eca109大量停滞于细胞周期G1期,抑制细胞进入S期G2期,因此抑制细胞增殖能力;而且U0126可以反转由miR-21过表达诱导的细胞周期改变。
在体外培养的血管内皮细胞中采用ERK1/2 抑制剂干预后,miR-21表达水平降低[20],ERK1/2 MAPK 通路在胶质瘤[21]和乳腺癌[22]中可以通过促进miR-21表达增强肿瘤细胞的增殖和侵袭能力。我们研究发现ERK1/2 MAPK信号通路抑制显著下调Eca109中内源性miR-21表达,而且可以抑制外源性miR-21表达。进一步研究发现ERK1/2 MAPK信号抑制在转录后水平反转由miR-21过表达诱导的ERK1/2 MAPK信号通路活化。
食管癌的癌前病变常常与不同领域的变化有关,单一的一种生物学记标分子鉴定、确诊食管癌远远不够,缺乏足够的敏感性和特异性,因此临床上需要多种生物学标记分子同时应用。我们相信随着基因组学、蛋白组学和各种分子生物学技术的快速发展,ESCC发生发展中及相关的作用机制将会越来越清楚。
4 结论ERK1/2 MAPK通路抑制可减弱Eca109细胞克隆形成和增殖,促进细胞凋亡,减慢细胞周期,并且可以反转由miR-21过表达诱导的Eca109细胞增殖、凋亡和周期的变化;ERK1/2 MAPK信号通路抑制可以下调内源性miR-21表达和反转外源性miR-21诱导的ERK1/2 MAPK信号通路活化。
实验结果提示ERK1/2 MAPK通路抑制可能通过下调Eca109细胞中miR-21表达阻碍Eca109细胞增殖、促进细胞凋亡和减慢细胞周期,最终导致ESCC细胞生长抑制。
| [1] | 刘凤霞, 张盼盼, 李建勇, 等. MicroRNA-21通过正调控ERK1/2通路促进食管鳞状细胞癌的增殖和迁移[J]. 生物技术通报, 2013(12):189-193. |
| [2] | 刘凤霞, 牛淑亮, 李建勇, 陈胜国. MicroRNA-21在食管鳞状细胞癌中的作用及机制[J]. 中国公共卫生, 2014, 30(增刊):11-15, |
| [3] | Zheng ST, Huo Q, Tuerxun A, et al. The expression and activation of ERK/MAPK pathway in human esophageal cancer cell line EC9706[J]. Mol Biol Rep, 2011;38(2)865-72. |
| [4] | 刘凤霞, 牛淑亮, 李建勇, 等. ERK1/2 MAPK 通路在Eca109细胞体外增殖和迁移中的作用及其机制[J]. 基础医学与临床, 2014, 34(3):345-349. |
| [5] | Shukla A, Hillegass JM, MacPherson MB, et al. ERK2 is essential for the growth of human epithelioid malignant mesotheliomas[J]. Int J Cancer, 2011, 129(5):1075-1086. |
| [6] | Ito M, Zhao N, Zeng Z, et al. Synergistic growth inhibition of anaplastic large cell lymphoma cells by combining cellular ALK gene silencing and a low dose of the kinaseinhibitor U0126[J]. Cancer Gene Ther, 2010, 17(9):633-644. |
| [7] | Bessard A, Frémin C, Ezan F, et al. RNAi-mediated ERK2 knockdown inhibits growth of tumor cells in vitro and in vivo[J]. Oncogene, 2008, 27(40):5315-5325. |
| [8] | Chen C, Chang YC, Lan MS, et al. Leptin stimulates ovarian cancer cell growth and inhibits apoptosis by increasing cyclin D1 and Mcl-1 expression via the activation of the MEK/ ERK1/2 and PI3K/Akt signaling pathways[J]. Int J Oncol, 2013, 42(3):1113-1119. |
| [9] | Cha JH, Choi YJ, Cha SH, et al. Allicin inhibits cell growth and induces apoptosis in U87MG human glioblastoma cells through an ERK-dependent pathway[J]. Oncol Rep, 2012, 28(1):41-48. |
| [10] | Burova EB, Smirnova IS, Gonchar IV, et al. Inhibition of the EGF receptor and ERK1/2 signaling pathways rescues the human epidermoid carcinoma A431 cells from IFNγ-induced apoptosis[J]. Cell Cycle, 2011, 10(13):2197-2205. |
| [11] | Yang TY, Chang GC, Chen KC, et al. Sustained activation of ERK and Cdk2/cyclin-A signaling pathway by pemetrexed leading to S-phase arrest and apoptosis in human non-small cell lung cancer A549 cells[J]. Eur J Pharmacol, 2011, 663(1-3):17-26. |
| [12] | Tong JS, Zhang QH, Huang X, et al. Icaritin causes sustained ERK1/2 activation and induces apoptosis in human endometrial cancer cells[J]. PLoS One, 2011, 6(3):e16781. |
| [13] | Yan DM, Dai RY, Duan CY, et al. Cross-talk between PI3K/Akt and MEK/ERK pathways regulates human hepatocellular carcinoma cell cycle progression under endoplasmic reticulum stress[J]. Zhonghua Gan Zang Bing Za Zhi, 2010, 18(12):909-914. |
| [14] | Dai R, Chen R, Li H. Cross-talk between PI3K/Akt and MEK/ERK pathways mediates endoplasmic reticulum stress-induced cell cycle progression and cell death in human hepatocellular carcinoma cells[J]. Int J Oncol, 2009, 34(6):1749-1757 |
| [15] | Zhang T, Li Y, Zhu Z, Gu M, et al. MEK inhibition potentiates the activity of Hsp90 inhibitor 17-AAG against pancreatic cancer cells[J]. Mol Pharm, 2010, 7(5):1576-1584. |
| [16] | Li X, Lv Y, Yuan A, et al. Gastrin-releasing peptide promotes the growth of HepG2 cells via EGFR-independent ERK1/2 activation[J]. Oncol Rep, 2010, 24(2):441-448. |
| [17] | Zhang H, Li W, Sun S, et al. Inhibition of sphingosine kinase 1 suppresses proliferation of glioma cells under hypoxia by attenuating activity of extracellular signal-regulated kinase[J]. Cell Prolif, 2012, 45(2):167-175. |
| [18] | Glassmann A, Reichmann K, Scheffler B, et al. Pharmacological targeting of the constitutively activated MEK/MAPK-dependent signaling pathway in glioma cells inhibits cell proliferation and migration[J]. Int J Oncol, 2011, 39(6):1567-1575. |
| [19] | Zou ZQ, Zhang LN, Wang F, et al. The novel dual PI3K/mTOR inhibitor GDC-0941 synergizes with the MEK inhibitor U0126 in non-small cell lung cancer cells[J]. Mol Med Rep, 2012, 5(2):503-508. |
| [20] | Sabatel C, Malvaux L, Bovy N, et al. MicroRNA-21 exhibits antiangiogenic function by targeting RhoB expression in endothelial cells[J]. PLoS One, 2011, 6(2):e16979. |
| [21] | Kwak HJ, Kim YJ, Chun KR, et al. downregulation of Spry2 by miR-21 triggers malignancy in human gliomas[J]. Oncogene, 2011, 30(21):2433-2442. |
| [22] | Huang TH, Wu F, Loeb GB, et al. Up-regulation of miR-21 by HER2/neu signaling promotes cell invasion[J]. J Biol Chem, 2009, 284(27):18515-18524. |