糖苷生物碱是茄科植物中典型的次生代谢产物,存在于茄科植物的所有组织中,包括叶子、根、花、果实和块茎,常被称作甾族糖苷生物碱或茄属糖苷生物碱[1, 2]。迄今为止,已经有100多种糖苷生物碱从茄属的350多种植物中分离和鉴定出来,而且每年还不断发现新的糖苷生物碱。甾族糖苷生物碱拥有十分广泛的生物活性,对病毒、细菌、真菌、疟原虫、昆虫、其他植物以及哺乳动物和人都具有毒性,是植物为了防御微生物、动物及昆虫的侵袭而自我合成的一种产物。同时,也具有广泛的药理学活性,如抗病毒、抗真菌和抗癌等。发芽的马铃薯和未成熟的番茄中含有大量的甾族糖苷生物碱,食用不当会导致中毒甚至死亡,因此关于植物中糖苷生物碱的分布、含量、生物活性及合成代谢途径的研究一直是本领域的研究热点。其作为一种食物中的抗营养因子,如何降低其含量就成为该类食品主要安全问题。糖苷生物碱生物合成分子机理的研究将为优良品种的培育提供理论依据。本文就糖苷生物碱的生物活性和生物合成途径的研究进展进行综述。
1 甾族糖苷生物碱的化学结构糖苷生物碱的化学结构由亲水性的寡糖链和疏水性的含氮甾体生物碱骨架(又称糖苷配基)构成。糖链多为三糖或四糖,以氧糖苷键与糖苷配基的C-3相连接。
1.1 糖苷生物碱配基糖苷生物碱配基的结构大致分为茄次碱烷、螺旋甾碱烷和其他甾体衍生物3类,结构如图 1所示。
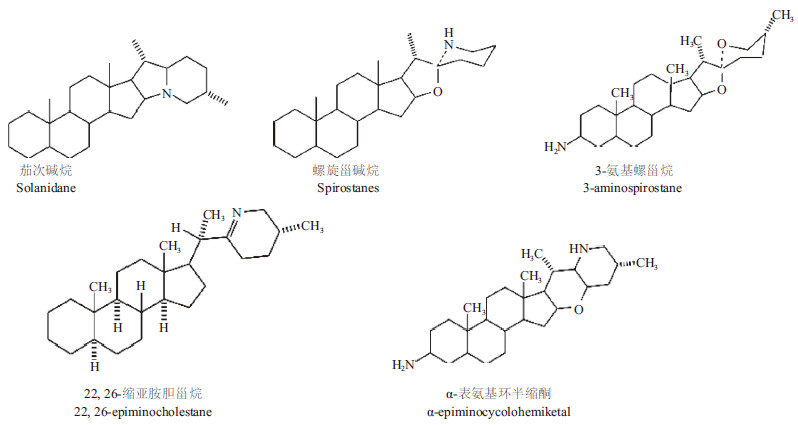 |
| 图 1 糖苷生物碱配基结构 |
组成糖苷生物碱寡糖链的单糖一般为葡萄糖、半乳糖、鼠李糖、木糖和阿拉伯糖,通常由三糖或四糖构成分枝糖链。图 2所示3种糖链:茄三糖(Solatriose)、卡茄三糖(Chacotriose)和番茄四糖(Lycotetraose)最常见。
 |
| 图 2 糖苷生物碱糖链的组成和结构 |
茄科植物中的糖苷生物碱具有广泛的抗癌活性,一直以来是研究的热点之一。在以前的研究中可知,白英中的糖苷生物碱——千年不烂心碱能抑制小鼠中的恶性肿瘤[3],一种茄属植物(Solanum sodomaeum)中含有的澳洲茄边碱和澳洲茄碱能有效治疗包括基层细胞癌和鳞状细胞癌的恶性人皮肤癌[4]。龙葵是东南亚常见的草药,其提取物可以诱导乳腺癌、肝癌细胞生长抑制和凋亡[5, 6],水提取物可以抑制黑素瘤转移[7]。在中医里,龙葵已经被用作胃肠癌治疗的药物[8]。Ding等[9]提取了龙葵中的糖苷生物碱,通过体外实验的方法,验证了甾族糖苷生物碱的抗肿瘤活性。龙葵中的主要生物活性物质是茄碱和茄边碱。研究表明,α-茄碱能抑制人体结肠、肝脏、子宫颈、淋巴和胃中癌细胞的生长[10, 11, 12],其对肝癌细胞的抑制作用甚至强于阿霉素和喜树碱两种抗癌药物的抑制作用,同时α-茄碱也可以阻碍人类黑色素瘤细胞的迁移和入侵[13]。Kuo等[14]研究了人肝癌细胞(Hep3B)经α-澳洲茄边碱处理后的细胞形态、DNA含量、基因表达的变化。经α-澳洲茄边碱处理后的Hep3B细胞出现了染色质凝聚、DNA断裂现象,并在DNA柱形图中出现了一个sub-G1峰,这些变化表明α-澳洲茄边碱通过细胞程序性死亡诱导细胞死亡。另外,α-澳洲茄边碱处理后的Hep3B细胞能提高TNFR I和II表达,说明TNFR I和II与α-澳洲茄边碱诱导凋亡的机制有关。α-茄碱在一个乳腺癌动物模型中通过诱导细胞凋亡,抑制细胞增殖和血管生成发挥了抗癌和化疗的作用[15]。Shen等[16]研究了α-茄碱对人类前列腺癌细胞PC-3运动性的抑制机制,表明α-茄碱降低了PC-3细胞的生存能力。在体内和体外实验中,α-茄碱对胰腺癌的有益作用也得到了验证[17]。因此,α-茄碱可能在癌症化疗上有潜力。Shieh等[18]的研究表明α-番茄碱可以通过钝化FAK/PI3K/Akt信号通路和降低NF-κB的结合活性来抑制人类肺癌NCI-H460细胞的入侵和转移。
2.2 抗真菌茄属植物中的茄碱对植物本身是一种天然的屏障,具有杀虫和抗真菌功能[19]。糖苷生物碱抗真菌主要作用机制是:糖苷生物碱能与真菌细胞膜上的甾醇类物质形成复合物,破坏膜的完整性,使膜的正常功能丧失。早在20世纪,就有研究报道马铃薯中的糖苷生物碱查茄碱和茄碱具有抵御真菌侵染的作用[20]。Kumar等[21]研究发现,澳洲茄胺能抑制真菌细胞膜必需成分麦角甾醇的生物合成,而其抗真菌活性与酮康唑类似。Munafo等[22]从百合花中提取出了5种甾族糖苷生物碱,所有的组分都显示了对真菌生长的抑制作用。Sandrock等许多人研究证明,番茄碱对植物病原菌具有广泛的抑制作用,而且其对番茄致病菌和非致病菌的抑制作用存在着差异,番茄碱对番茄非致病菌如大豆壳针孢和玉米大斑病菌等具有较强的抑制作用,而对番茄致病菌如番茄壳针孢和交链孢等的抑制作用较弱[23, 24]。
2.3 抗病毒Thome 等[25]的研究表明,卡茄碱、茄碱和番茄碱能够有效对抗单纯疱疹病毒,其抗性机理在于糖链部分在糖苷生物碱与病毒的膜糖受体相互作用中起重要作用,使用含有α-澳洲茄边碱的面霜进行局部涂抹,可以治疗带状疱疹病毒(Herpes zoster verus,HZV)、单纯疱疹病毒(HSV)和生殖疱疹病毒(HGV),一般3-10 d可以治愈。而含有茄边碱和澳洲茄碱的面霜也可以用于治疗带状疱疹病毒、单纯疱疹病毒和生殖器疱病毒的感染者,3-10 d 治愈[26]。
2.4 抗氧化Huang等[27]使用SH-SY5Y细胞系作为体外实验模型,使用过氧化氢诱导SH-SY5Y细胞系产生神经毒性,研究了从排风藤中分离出的番茄碱对细胞的保护作用,结果表明番茄碱具有很强的抗氧化能力,具有神经保护功能。
2.5 抗炎作用肌肉注射、皮下注射及口服番茄碱都能对小鼠的水肿产生抑制作用,且作用与剂量有依赖关系[28]。对豚鼠注射番茄碱能够对抗组织胺和缓激肽引起的豚鼠毛细血管渗透性增高[29]。但糖苷生物碱对人类的炎症和变态反应的作用还需进一步研究。
2.6 降低血浆低密度脂蛋白(LDL)和胆固醇Friedman等[30]利用番茄碱在体外能与胆固醇结合形成不溶的复合物的性质,通过实验证明番茄碱与胆固醇形成的复合物很难被血液吸收。说明番茄碱能够降低食物中胆固醇的吸收及血浆中胆固醇和三酸甘油酯的水平。
2.7 抗原虫作用原生动物克鲁斯锥虫能侵染人类,使人患锥虫病,这种病在拉丁美洲广泛分布。糖苷生物碱查茄碱、边缘茄碱和番茄碱在微摩尔浓度下就能抑制克鲁斯锥虫生长[31]。番茄碱还能够抑制原虫纤毛虫的生长,其半数有效浓度值为16.5 μmol/L[32]。
2.8 强心作用Nishie等[33]的研究显示,番茄碱口服给药使青蛙产生了心动过速的现象。Bergers等[34]的研究表明,茄碱和番茄碱在低浓度时能够增加小鼠心肌细胞的收缩频率。
2.9 对植物的化感效应化感作用是指一种植物(包括微生物)通过向环境释放某些化学物质,在其周围形成一个微环境区域,从而抑制或促进该区域内其他植物(或微生物)生长的现象[35]。Roddick[36]发现番茄中的番茄碱具有防御其他植物入侵的作用,Fukuhara和Kubo[37]检测了茄边碱和茄碱对生菜幼苗的化感作用,结果表明二者均能抑制幼苗的生长。Fukuhara等[38]从茄科植物Solanum arundo Mattei的根皮中分离鉴定出一种糖苷生物碱,这种糖苷生物碱抑制莴苣幼苗的生长。Ye等[39]从生长于亚洲东南部的茄科植物白英(Solanum lyratum)中分离鉴定出2种糖苷生物碱,并且验证了这2种糖苷生物碱对南苜蓿和麦仙翁的胚根生长均有抑制作用。
3 甾族糖苷生物碱的生物合成途径 3.1 甾族糖苷生物碱的前体近年来,分子遗传学技术得到了迅猛的发展,随着拟南芥基因组的测序完成,DNA或转座子标记突变体的可用性和正义、反义稳定转化DNA的多种可能性使研究甾醇生物合成途径中表达或沉默某种基因成为可能[40]。2003年,Arnqvist等[41]利用转基因马铃薯超表达了GmSMT1 cDNA,用来研究有毒的糖苷生物碱的生物合成途径。研究表明,可以通过减少游离胆固醇的含量来减少糖苷生物碱的合成,支撑了胆固醇是糖苷生物碱合成的前体物质这个观点。为了进一步研究甾族糖苷生物碱合成的初始物质,Petersson等[42]通过氘原子示踪法标记了马铃薯嫩枝中的胆固醇,3-5周后通过GC-MS和LC-MS/MS进行分析,结果证实了胆固醇是糖苷生物碱合成特定的前体物质。
3.2 甾族糖苷生物碱的合成甾族生物碱在合成甾族糖苷生物碱的过程中需要糖基转移酶的参与,为了研究茄科植物中甾族糖苷生物碱的合成途径,Itkin等[43]研究了番茄GLYCOALKALOID METABOLISM1(GAME1)基因。结果表明,GAME1是一种半乳糖基转移酶,主要调控番茄碱的糖基化,导致番茄绿色组织甾族糖苷生物碱的积累。下调GAME1导致α-番茄碱的含量下降了将近50%。而且,沉默了GAME1的番茄植株出现了生长迟缓和明显的形态学上的改变。Itkin等[44]继续通过分析番茄和马铃薯的相对共表达分析再加上化学分析,显示10个基因参与了甾族糖苷生物碱的生物合成。其中6个基因作为集群存在于7号染色体上,而另外2个在12号染色体上重复的基因组区域。在随后的系统分析中,他们揭示了一种从胆固醇到α-番茄碱的代谢过程,如图 3所示,胆固醇经过羟基化、氧化、转氨作用和脱水生成水解番茄碱,再经过还原反应和3次糖基化最终生成α-番茄碱。而且GAME4可以预防马铃薯块茎和番茄果实中的甾族糖苷生物碱积累。这可能提供一种去除在这些广泛使用的食用作物中的不安全的抗营养成分。
Schwahn等[45]利用基因组学方法细化了甾族糖苷生物碱在番茄中的生物合成途径,他们分别取不同种类的番茄,得到叶子、根、未成熟的果实和成熟的果实,使用UPLC/FT-MS对甾族糖苷生物碱进行分离和结构分析,得出了番茄果实从未成熟到成熟再到过熟的过程中胆固醇的变化过程。根据C5-6是否饱和以及C25构象的不同将胆固醇生物代谢途径分为4个分支,其中胆固醇转化为甾族糖苷生物碱的途径是番茄皂苷C途径。在番茄果实未成熟时,以胆固醇为前体,生成大量的α-番茄碱。在果实成熟过程中,α-番茄碱含量降低,形成各种番茄皂苷,最后达到过熟时形成。
4 展望糖苷生物碱的种类繁多、结构多样、生理活性各异。国内外学者通过长期坚持不懈地研究糖苷生物碱,明确了它的种类及其来源,对多种糖苷生物碱的生理功效也进行了深入探索,取得了实质性的进展。但其具体的生物合成途径仍然不明确,找到影响甾族糖苷生物碱合成的基因并进行改造,将对进一步改善茄科植物的食用安全性奠定基础;同时也可以选取合成甾族糖苷生物碱含量高的植物,将生物碱提取出来,作为各种药用材料的来源。
| [1] | Mennella G, Rotino GL, Fibiani M, et al. Characterization of health-related compounds in eggplant(Solanum melongena L. )lines derived from introgression of allied species[J]. J Agric Food Chem, 2010, 58(13):7597-7603. |
| [2] | Friedman M. Potato glycoalkaloids and metabolites:roles in the plant and in the diet[J]. J Agric Food Chem, 2006, 54(23):8655-8681. |
| [3] | Kupchan SM, Barboutis SJ, Knox JR, et al. Beta-solamarine:tumor inhibitor isolated from Solanum dulcamara[J]. Science, 1965, 150(3705):1827-1828. |
| [4] | Cham BE, Gilliver M, Wilson L. Antitumour effects of glycoalkaloids isolated from Solanum sodomaeum[J]. Planta Med, 1987, 53(1):34-36. |
| [5] | Ji YB, Gao SY, Ji CF, et al. Induction of apoptosis in HepG2 cells by solanine and Bcl-2 protein[J]. J Ethnopharmacol, 2008, 115(2):194-202. |
| [6] | Lin HM, Tseng HC, Wang CJ, et al. Induction of autophagy and apoptosis by the extract of Solanum nigrum Linn in HepG2 cells[J]. J Agric Food Chem, 2007, 55(9):3620-3628. |
| [7] | Jiang L, Liu X, Kolokythas A, et al. Downregulation of the Rho GTPase signaling pathway is involved in the microRNA-138-mediated inhibition of cell migration and invasion in tongue squamous cell carcinoma[J]. Int J Cancer, 2010, 127(3):505-512. |
| [8] | Gan T, Wu Z, Tian L, et al. Chinese herbal medicines for induction of remission in advanced or late gastric cancer[J]. Cochrane Database Syst Rev, 2010(1):D5096. |
| [9] | Ding X, Zhu F, Yang Y, et al. Purification, antitumor activity in vitro of steroidal glycoalkaloids from black nightshade(Solanum nigrum L.)[J]. Food Chem, 2013, 141(2):1181-1186. |
| [10] | Lee KR, Kozukue N, Han JS, et al. Glycoalkaloids and metabolites inhibit the growth of human colon(HT29)and liver(HepG2)cancer cells[J]. J Agric Food Chem, 2004, 52(10):2832-2839. |
| [11] | Friedman M, Lee KR, Kim HJ, et al. Anticarcinogenic effects of glycoalkaloids from potatoes against human cervical, liver, lymphoma, and stomach cancer cells[J]. J Agric Food Chem, 2005, 53(15):6162-6169. |
| [12] | Yang SA, Paek SH, Kozukue N, et al. Alpha-chaconine, a potato glycoalkaloid, induces apoptosis of HT-29 human colon cancer cells through caspase-3 activation and inhibition of ERK 1/2 phosphorylation[J]. Food Chem Toxicol, 2006, 44(6):839-846. |
| [13] | Lu MK, Shih YW, Chang CT, et al. alpha-Solanine inhibits human melanoma cell migration and invasion by reducing matrix metalloproteinase-2/9 activities[J]. Biol Pharm Bull, 2010, 33(10):1685-1691. |
| [14] | Kuo KW, Hsu SH, Li YP, et al. Anticancer activity evaluation of the solanum glycoalkaloid solamargine. Triggering apoptosis in human hepatoma cells[J]. Biochem Pharmacol, 2000, 60(12):1865-1873. |
| [15] | Mohsenikia M, Alizadeh AM, Khodayari S, et al. The protective and therapeutic effects of alpha-solanine on mice breast cancer[J]. Eur J Pharmacol, 2013, 718(1-3):1-9. |
| [16] | Shen KH, Liao AC, Hung JH, et al. alpha-Solanine inhibits invasion of human prostate cancer cell by suppressing epithelial-mesenchymal transition and MMPs expression[J]. Molecules, 2014, 19(8):11896-11914. |
| [17] | Lv C, Kong H, Dong G, et al. Antitumor efficacy of alpha-solanine against pancreatic cancer in vitro and in vivo[J]. PLoS One, 2014, 9(2):e87868. |
| [18] | Shieh JM, Cheng TH, Shi MD, et al. alpha-Tomatine suppresses invasion and migration of human non-small cell lung cancer NCI-H460 cells through inactivating FAK/PI3K/Akt signaling pathway and reducing binding activity of NF-kappaB[J]. Cell Biochem Biophys, 2011, 60(3):297-310. |
| [19] | Chaube S, Swinyard CA. Teratological and toxicological studies of alkaloidal and phenolic compounds from Solanum tuberosum L.[J]. Toxicol Appl Pharmacol, 1976, 36(2):227-237. |
| [20] | Sandrock RW, Vanetten HD. Fungal sensitivity to and enzymatic degradation of the phytoanticipin alpha-tomatine[J]. Phytopath-ology, 1998, 88(2):137-143. |
| [21] | Kumar P, Sharma B, Bakshi N. Biological activity of alkaloids from Solanum dulcamara L.[J]. Nat Prod Res, 2009, 23(8):719-723. |
| [22] | Munafo JJ, Gianfagna TJ. Antifungal activity and fungal metabolism of steroidal glycosides of Easter lily(Lilium longiflorum Thunb. )by the plant pathogenic fungus, Botrytis cinerea[J]. J Agric Food Chem, 2011, 59(11):5945-5954. |
| [23] | Arneson P, Durbin RD. Studies on the mode of action of tomatine as a fungitoxic agent[J]. Plant Physiol, 1968, 43(5):683-686. |
| [24] | Sandrock RW, Vanetten HD. Fungal sensitivity to and enzymatic degradation of the phytoanticipin alpha-tomatine[J]. Phytopath-ology, 1998, 88(2):137-143. |
| [25] | Thorne HV, Clarke GF, Skuce R. The inactivation of herpes simplex virus by some Solanaceae glycoalkaloids[J]. Antiviral Res, 1985, 5(6):335-343. |
| [26] | Morillo M, Lequart V, Grand E, et al. Synthesis of peracetylated chacotriose[J]. Carbohydr Res, 2001, 334(4):281-287. |
| [27] | Huang SL, He HB, Zou K, et al. Protective effect of tomatine against hydrogen peroxide-induced neurotoxicity in neuroblastoma(SH-SY5Y)cells[J]. J Pharm Pharmacol, 2014, 66(6):844-854. |
| [28] | Filderman RB, Kovacs BA. Anti-inflammatory activity of the steroid alkaloid glycoside, toatine[J]. Br J Pharmacol, 1969, 37(3):748-755. |
| [29] | Calam DH, Callow RK. HIstamine protection produced by plant tumour extracts. the active principle of tomato plants infected with grown-gall[J]. Br J Pharmacol Chemother, 1964, 22:486-498. |
| [30] | Friedman M, Fitch TE, Yokoyama WE. Lowering of plasma LDL cholesterol in hamsters by the tomato glycoalkaloid tomatine[J]. Food Chem Toxicol, 2000, 38(7):549-553. |
| [31] | Chataing B, Concepcion JL, Lobaton R, et al. Inhibition of Trypanosoma cruzi growth in vitro by Solanum alkaloids:a comparison with ketoconazole[J]. Planta Med, 1998, 64(1):31-36. |
| [32] | Surak JG, Schifanella AV. The toxicity of alpha-tomatine to Tetrahymena pyriformis[J]. Food Cosmet Toxicol, 1979, 17(1):61-67. |
| [33] | Nishie K, Fitzpatrick TJ, Swain AP, et al. Positive inotropic action of Solanaceae glycoalkaloids[J]. Res Commun Chem Pathol Pharmacol, 1976, 15(3):601-607. |
| [34] | Bergers WW, Alink GM. Toxic effect of the glycoalkaloids solanine and tomatine on cultured neonatal rat heart cells[J]. Toxicol Lett, 1980, 6(1):29-32. |
| [35] | Molish H. Der einfluss einer plfanze aufdieandere, allelopathie[J]. Nature, 1938, 141:493. |
| [36] | Roddick JG. Effect of a-tomatine on permeability of plant storage tissues[J]. Exp Bot, 1975, 26;221-227. |
| [37] | Fukuhara K, Kubo I. Isolation of steroidal glycoalkaloids from Solanum incanium by two countercurrent chromatographic methods[J]. Phytochemistry, 1991, 30:685-687. |
| [38] | Fukuhara K, Shimizu K, Kubo I. Arudonine, an allelopathic steroidal glycoalkaloid from the root bark of Solanum arundo Mattei[J]. Phytochemistry, 2004, 65:1283-1286. |
| [39] | Ye WC, Wang H, Zhao SX. Steroidal glycoside and glycoalkaloid from Solanum lyratum[J]. Biochemical Systematics and Ecology, 2001, 29:421-423. |
| [40] | Benveniste P. Biosynthesis and accumulation of sterols[J]. Annu Rev Plant Biol, 2004, 55:429-457. |
| [41] | Arnqvist L, Dutta PC, Jonsson L, et al. Reduction of cholesterol and glycoalkaloid levels in transgenic potato plants by overexpression of a type 1 sterol methyltransferase cDNA[J]. Plant Physiol, 2003, 131(4):1792-1799. |
| [42] | Petersson EV, Nahar N, Dahlin P, et al. Conversion of exogenous cholesterol into glycoalkaloids in potato shoots, using two methods for sterol solubilisation[J]. PLoS One, 2013, 8(12):e82955. |
| [43] | Itkin M, Rogachev I, Alkan N, et al. GLYCOALKALOID METABOLISM1 is required for steroidal alkaloid glycosylation and prevention of phytotoxicity in tomato[J]. Plant Cell, 2011, 23(12):4507-4525. |
| [44] | Itkin M, Heinig U, Tzfadia O, et al. Biosynthesis of antinutritional alkaloids in solanaceous crops is mediated by clustered genes[J]. Science, 2013, 341(6142):175-179. |
| [45] | Schwahn K, de Souza LP, Fernie AR, et al. Metabolomics-assisted refinement of the pathways of steroidal glycoalkaloid biosynthesis in the tomato clade[J]. J Integr Plant Biol, 2014, 56(9):864-875. |





