2.浙江海正药业股份有限公司,台州 318000
2. Hisun Pharmaceutical Co.Ltd, Taizhou 318000
抗体药物由于具有靶点明确、临床疗效显著、副作用少等优点已成为当今生物医药产业发展的主流,其中动物细胞大规模培养技术是生产抗体药物最主要的技术手段。在细胞培养过程中由于乳酸和CO2的累积使得培养pH下降,需要通过补碱的方式来维持培养pH的稳定。然而由于大型生物反应器转速的限制,导致反应器混合效率的下降,使得补碱过程中反应器内形成pH不均一的现象,影响细胞的生理状态。然而当前对pH不均一性的研究主要集中在对微生物发酵领域[1],在动物细胞培养领域的研究却较少[2]。因此深入大型反应器中pH不均一性对细胞的影响,对于表达重组蛋白药物的哺乳动物细胞培养工艺的放大和抗体工业化的生产过程具有重要的借鉴意义。
本研究以表达人肿瘤坏死因子受体II-Fc 抗体融合蛋白(TNFR-Fc)的CHO细胞为研究对象,通过构建规模缩小系统模拟大型反应器中的pH不均一性,认识pH不均一性对CHO细胞的生长、代谢和表达的影响,为动物细胞培养工艺的放大过程优化提供数据支持。
1 材料与方法 1.1 细胞株和培养基实验所用细胞株为表达TNFR-Fc的重组CHO细胞[3]。基础培养基和流加培养基为实验室自主开发。培养基配制所用试剂均购自Sigma-Aldrich公司。
1.2 细胞培养从细胞库中复苏重组CHO细胞,以(2-3)×105 cells/mL活细胞密度接种于摇瓶中,置于37℃、5% CO2的培养箱中培养,转速为120 r/min,作为实验用的种子细胞。取对数生长期的CHO细胞,以约1.0×106 cells/mL的活细胞密度接种至反应器(BIOSTAT A-plus,Sartorius),培养体积为1 L。每24 h取样,计数。培养液经10 000 r/min离心10 min后取上清于-20℃保存,用于实验结束后营养物、代谢副产物、TNFR-Fc的检测。培养时反应器操作条件:DO为50%,温度为37℃,搅拌转速为150 r/min,pH为7.0(dead band设为± 0.02)。pH的控制采用深层通入CO2或者补入1 mol/L NaOH 溶液的方式。流加策略采用葡萄糖控制模型[4]。
1.3 分析方法细胞密度和活力采用Bio-Rad TC20TM 自动计数仪。葡萄糖、乳酸、氨的检测采用 NOVA Bioprofile 400。产物浓度的检测采用 Protein A-HPLC(Applied Biosystems)的方法,方法参见文献[5]。上清收获后采用rProtein A亲和层析柱(GE Healthcare)纯化并收集抗体。唾液酸含量根据《中国药典》(2010年版三部)中唾液酸检测方法测定。生物学活性的测定方法同文献[6]。多聚体的检测采用凝胶排阻色谱(SEC)的方法,色谱柱为TSK-Gel G3000 SWXL(4.6 mm×30 cm,Tosoh Bioscience),方法参见文献[7]。
2 结果 2.1 规模缩小系统的构建大型反应器在表层补碱过程中会产生两个区域,高pH区域和主体pH区域(图 1)。为了使大型反应器pH不均一的现象在实验室规模反应器上重现,采用构造两个独立的装置方式来分别模拟大型反应器的充分混合区域和混合不均匀的区域。图 1所示为搅拌式反应器(Stirred tank reactor,STR)和平推流反应器(Plug flow reactor,PFR)串联组成的STR+PFR系统。两个装置之间进行不断的循环从而创造出两个反应器浓度不均一的现象,不均一性的程度通常由两个装置的大小、培养基在PFR中的停留时间所决定的。停留时间(Residence time,RT)是指物料从进入PFR的时间算起至离开PFR时为止所经历的时间。停留时间越长,则高浓度物料从进入PFR至在STR中完全混合所需的时间也就越长,细胞受到高浓度物料的作用时间也就越长。因此通过控制停留时间的长短则可以控制细胞与高浓度物料的接触时间,从而可以反映大型反应器内的不均一程度。
 |
| 图 1 规模缩小模型模拟反应器的pH不均一性 |
STR采用一个2 L搅拌式反应器(工作体积1 L)用于模拟大型反应器的主体区域。PFR总体积为80 mL,主体为一根体积为长度90 cm,内径9.6 mm的硅胶管,两端各通过长度50 cm,内径4.8 mm的硅胶管(Masterflex)串联到反应器上,PFR内培养基流动速度采用蠕动泵控制,培养过程中PFR至于37℃水浴锅中。碱液的补入位置位于PFR入口端,碱液补加采用连续补加的方式,这使得PFR区域会形成一个较高的pH,用于模拟大型反应器的补碱区域。通过控制培养基在PFR中的流动速度,可以控制培养基在该区域内停留的时间。
2.2 pH不均一性对细胞生长、代谢和表达的影响基于上述构建的STR+PFR装置,考察pH不均一性对流加培养过程的影响。实验设计如表 1所示,其中Control作为实验对照,补碱区域在STR中,PFR仅进行培养液的循环,其他实验条件的补碱区域在PFR中。
通过在不同培养条件下的对比实验(图 2)可知,与Control相比停留时间为30 s的条件下对细胞的生长和维持无显著的影响,随着培养过程中停留时间的增加细胞生长受到明显抑制。特别是SP-120的流加培养过程,细胞生长速度明显慢于其他条件,比生长速率只有0.46 day-1,在培养第5天达到的最大细胞密度为8.2×106 cells/mL,分别是SP-30和SP-60 培养过程的75.9%和87.2%。值得注意的是该培养过程细胞并未有明显的维持,自培养第6天后即出现细胞死亡现象,比死亡速率为0.11 day-1,分别是SP-30和SP-60 培养过程的2.3倍和9倍,且细胞活性快速下降。培养结束时细胞活性仅为49.7%。
 |
| 图 2 不同培养条件下细胞的生长(A)和细胞活力(B) |
细胞代谢方面,与Control相比停留时间为30 s的条件下对乳酸和氨的代谢无显著的影响(图 3),随着培养过程中停留时间的增加,细胞生长阶段乳酸的比生成速率明显增加。在SP-120的流加培养过程中,乳酸的比生成速率达到了2.5 mmol/(109cells·day),在培养第5天达到的最大为49.8 mmol/L,分别是SP-30和SP-60 培养过程的1.87倍和1.12倍,之后乳酸缓慢消耗,到培养结束时仍有34 mmol/L的乳酸。与乳酸代谢相似,随着停留时间的增加氨的浓度也明显增加,培养结束时SP-120的培养过程的氨浓度达到了12.3 mmol/L,与SP-30和SP-60 培养过程相比分别提高了23%和55.7%。由此可见,因停留时间增大导致细胞较长时间暴露在高pH的环境中会显著地引起细胞代谢的改变。
 |
| 图 3 不同培养条件下乳酸(A)和氨(B)的生成曲线 |
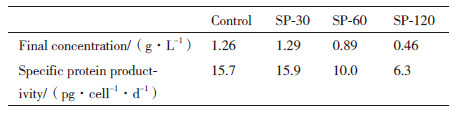
表 2所示为不同培养条件下TNFR-Fc的浓度。在SP-30条件下,TNFR-Fc的最高浓度为1.29 g/L,这与Control条件下TNFR-Fc的浓度基本一致。随着培养过程中停留时间的增加,产物的最高浓度和比生成速率均有不同程度的下降。在SP-120条件下,由于细胞生长和维持不利,TNFR-Fc的最高浓度仅为404.1 mg/L,仅是SP-30培养过程的32.1%。对比不同条件下蛋白的比生成速率可以发现,TNFR-Fc的平均比生成速率也显著下降,仅为6.3 pg/cell/d,分别为SP-30和SP-60培养过程39.6%和63%。由此可见,混合时间越长,反应器内pH不均一程度越大,细胞暴露在高浓度pH区域的时间也就越长,从而越不利于TNFR-Fc的表达。
图 4所示为不同培养条件下TNFR-Fc的分子排阻色谱色谱图。SP-30条件下除了含有少量多聚体外,产物主峰均一。而在SP-60和SP-120条件下,产物出现了两个峰的现象,特别是在SP-120的条件下,两个峰现象更加明显。根据分子排阻色谱的原理可以推断,两个峰现象的出现表明了产物的分子大小或者形态结构发生了较大程度的改变。
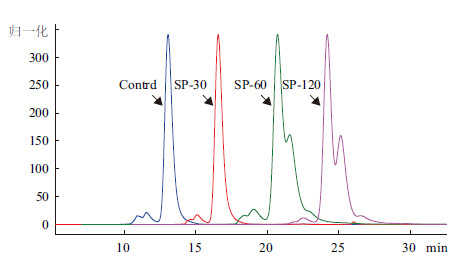 |
| 图 4 不同条件下TNFR-Fc的分子排阻色谱色谱图 |
对不同培养条件下TNFR-Fc唾液酸含量进一步分析可知(图 5-A),SP-30条件下TNFR-Fc的唾液酸与Control相比并无显著性差异。而在SP-60和SP-120条件下,TNFR-Fc的唾液酸含量都有不同程度的下降,特别是在SP-120条件下TNFR-Fc唾液酸含量仅为SP-30条件下的74%。此外,对生物学活性分析发现也有类似现象(图 5-B),SP-60和SP-120条件下TNFR-Fc的生物学活性分别是SP-30条件下的93.2%和78.8%。由此可见,停留时间在30 s时,反应器内的pH不均一程度并未对产物的唾液酸和生物学活性造成显著的影响,但是继续增大停留时间,TNFR-Fc的唾液酸含量和生物学活性的下降程度也越大。
 |
| 图 5 不同培养条件下TNFR-Fc唾液酸(A)和生物学活性(B) |
上述结果说明,停留时间为30 s时,整个培养过程和Control相比并无显著的差异,这表明此时补碱所导致的pH不均一性并未对流加培养工艺造成影响。而随着混合时间的延长,反应器内pH不均一的程度越大,细胞在高浓度pH区域的停留时间也就越长,从而对流加培养过程中细胞生长、代谢、产物表达以及产物质的不利影响也越大,主要表现在:(1)细胞生长受到抑制,乳酸和氨的累积显著增加;(2)TNFR-Fc的表达受到抑制,并且关键质量属性唾液酸和生物学活性也随之降低。
3 讨论当前搅拌式生物反应器已经成为生物制药领域的主要生产装置[8],反应器内的搅拌系统不仅为细胞悬浮在反应器内提供充分的混合能力,还保证了反应器内的营养物质均一性分布。与微生物和植物细胞不同,动物细胞的外层为细胞膜,细胞较脆弱,易受剪切力的影响,因此动物细胞培养过程中反应器通常设置较低的转速。然而转速的降低则会导致反应器混合能力的下降,会进一步导致大型生物反应器中的pH、DO、营养物浓度在反应器内分布不均一[9]。考虑到大型反应器在线实验的困难性,如无法控制微环境范围、控制细胞进入微环境的频率和时间、实验费用大等特点,此项工作多使用“规模缩小模型”(Scale down model)的方法,对诸多工艺参数进行研究,确定关键工艺参数及操作范围[10, 11]。小型的搅拌式反应器由于混合时间很短,刚进入反应器的新鲜物料能够达到瞬间的完全混合,使得整个反应器内各处物料的浓度完全相同。而对于平推流反应器而言,物料以一致的方向向前移动,所有物料在反应器内的停留时间相同,不存在返混的现象[12]。基于搅拌反应器和平推流反应器的特点,构建两级串联搅拌反应器-平推流反应器系统,用于模拟大型反应器中pH不均一性对流加培养工艺的影响。
通过上述培养过程的系统研究,我们明确了停留时间与产品关键质量控制参数(唾液酸和产物活性)间的联系,并确认pH不均一为流加培养工艺放大过程中的关键控制参数。结合上述研究结果,停留时间为30 s的培养过程中细胞生长,代谢,产物表达特别是产品质量属性并未受pH不均一的影响。超过30 s时,细胞生长受到抑制且维持不利,乳酸大量生成,关键质量控制参数(唾液酸和产物活性)均有不同程度的降低。因此,流加培养工艺放大到大型反应器时应当通过减少补碱量、加强反应器的混合效果、降低反应器的混合时间等手段,降低反应器内因补碱导致的pH不均一的程度。此外,有待在细胞水平和分子水平上深入研究pH不均一性对细胞作用的机理。
4 结论通过采用规模缩小技术对大型反应器内的pH不均一进行模拟,结果表明,停留时间为30 s时,对流加培养过程并无显著的影响。而当停留时间延长到60 s和120 s时,则会引起细胞生理状态和代谢的变化,乳酸大量累积,特别是停留时间为120 s时,最终TNFR-Fc的最高浓度仅为462 mg/L,在分子筛排阻色谱的图谱中出现两个后修饰不同的产物,唾液酸和生物学活性仅是SP-30的74%和78.8%。根据规模缩小模型的模拟,流加培养工艺放大过程中应当通过增强反应器的混合效果、降低反应器的混合时间等手段,从而降低反应器内因补碱导致的pH不均一的程度。
| [1] | Käβ F, Junne S, Neubauer P, et al, Process inhomogeneity leads to rapid side product turnover in cultivation of Corynebacterium glutamicum[J]. Microbial Cell Factories, 2014, 13:6. |
| [2] | Nienow AW, Scott WH, Hewitt CJ, et al, Scale-down studies for assessing the impact of different stress parameters on growth and product quality during animal cell culture[J]. Chemical Engineering Research and Design, 2013, 91(11):2265-2274. |
| [3] | Kou TC, Fan L, Zhou Y, et al. Increasing the productivity of TNFR-Fc in GS-CHO cells at reduced culture temperatures[J]. Biotechno-logy and Bioprocess Engineering, 2011, 16(1):136-143. |
| [4] | 范里, 赵亮, 孙亚婷, 等. 表达 TNFR-Fc 融合蛋白的 GS-CHO 细胞动态流加培养过程的设计[J]. 生物工程学报, 2010, 26(2):216-222. |
| [5] | Yang JD, Lu C, Stasny B, et al. Fed-batch bioreactor process scale-up from 3-L to 2, 500-L scale for monoclonal antibody production from cell culture[J]. Biotechnol Bioeng, 2007, 98(1):141-54. |
| [6] | Tan Q, Guo Q, Fang C, et al. Characterization and comparison of commercially available TNF receptor 2-Fc fusion protein products[J]. MAbs, 2012, 4(6):761-774. |
| [7] | Gomez N, Subramanian J, Ouyang J, et al. Culture temperature modulates aggregation of recombinant antibody in cho cells[J]. Biotechnol Bioeng, 2012, 109(1):125-136. |
| [8] | Rodrigues ME, Costa AR, Henriques M, et al. Technological progresses in monoclonal antibody production systems[J]. Biotechnol Prog, 2010, 26(2):332-351. |
| [9] | Xing Z, Kenty BM, Li ZJ, et al. Scale-up analysis for a CHO cell culture process in large-scale bioreactors[J]. Biotechnology and Bioengineering, 2009, 103(4):733-746. |
| [10] | Abu-Absi SF, Yang L, Thompson P, et al. Defining process design space for monoclonal antibody cell culture[J]. Biotechnol Bioeng, 2010, 106(6):894-905. |
| [11] | Looby M, Ibarra N, Pierce JJ, et al. Application of quality by design principles to the development and technology transfer of a major process improvement for the manufacture of a recombinant protein[J]. Biotechnol Prog, 2011, 27(6):1718-1729. |
| [12] | 陈甘棠, 化学反应工程[M]. 第3版. 北京:化学工业出版社, 2011. |