2. 沈阳医学院附属中心医院中心实验室,沈阳 110024
Central Hospital Affiliated To Shenyang Medical College, Shenyang 110024
Toll样受体家族(Toll-like receptors,TLRs)是先天免疫系统中最古老、最保守的一类模式识别受体家族,可以识别绝大部分的病原相关分子模式(pathogen-associated molecular patterns,PAMPs),对于先天免疫的激活和获得性免疫的启动扮演着极为重要的角色[1]。研究者已经确认从无脊椎后口动物[2]、海洋动物[3, 4]到鸟类[5],以及哺乳动物小鼠[6]和人类[7]都具有TLRs,并已开展了积极的免疫学研究。2007年,Ishii等[8]完成了无尾两栖类非洲爪蟾TLRs的测序工作,发现TLR mRNA在蝌蚪和成体时期的所有组织中普遍表达;2012年吴立舒证实东北林蛙皮肤组织中TLR1、2、4、5、6、8参与了抗虹彩病毒感染的免疫应答,其中TLR1和TLR8可能具有特异识别虹彩病毒的功能[9],目前为止,关于无尾两栖类个体发育过程中TLRs的表达特征及免疫应答机制的研究尚无突破性进展。
东北林蛙(Rana chensinensis),别名哈士蟆,无尾两栖类的模式动物之一,具有重要的经济和科学研究价值;纵观东北林蛙的生活史不难发现,其发育早期所依存的水环境微生物复杂,相对于成体的陆生生活,机体面临的生存挑战更为严峻;该阶段机体的先天免疫防御系统能够快速而有效的识别和清除病原微生物,对于蝌蚪顺利的完成个体发育过程极尤为重要。因此,我们拟以TLRs中表达范围最广,识别病原微生物种类最多的成员——Toll样受体2(Toll-like receptors 2,TLR2)为切入点,选用发育早期的东北林蛙作为研究对象,采用脂多糖(Lipopolysaccharides,LPS),脂磷壁酸(Lipteichoic acid,LTA),酵母多糖A(Zymosan A from Saccharomyces cerevisiae,ZymoA),聚肌胞苷酸(Polyinosinic-polycytidylic,Poly I∶C)分别模拟革兰氏阳性细菌、革兰氏阴性细菌、酵母菌和病毒的急性感染,首次对两栖类东北林蛙发育早期TLR2的表达特征及针对不同PAMPs的免疫应答特征进行描述,对于全面了解TLRS免疫应答机制的演化过程具有积极的科研意义。
1 材料与方法 1.1 材料 1.1.1 实验动物东北林蛙受精卵,购自于本溪天泽林蛙养殖服务中心;实验室曝气1 d、18-25℃的自来水培养,350只/箱,烘干熟蛋黄及新鲜菜叶 喂食。
1.1.2 主要试剂LPS(鼎国),PolyI∶C(Sigma),zymosan A(Sigma),LTA(Sigma),I型胶原兔抗人TLR2单克隆抗体及SABC即用型免疫组织化学试剂盒(过氧化物酶,武汉博士德生物工程有限公司),总RNA提取试剂盒及TIANScript RT Kit(天根),Phusion® High-Fidelity PCR Master Mixwith HF Buffer(NEB),引物由生工生物工程(上海)有限公司合成。
1.2 方法 1.2.1 取材参考王寿兵[10]的分期标准并结合东北林蛙的发育特征,选择11期(侧唇期)、17期(尾芽期)、19期(心跳期)、21期(脱膜期)、23期(鳃盖褶期)、25期(两侧鳃盖完成期)、27期(圆盾形肢芽期)、29期(侧指状肢芽期)、37期(第 1、2 趾分离期)和42期(前肢伸出期)10个发育时期进行取材;每个时期取材10次,15个样本/次;5批次中性多聚甲醛固定,4℃储存;5批次RNase-free冻存管保存,-80℃存储。
1.2.2 抗原刺激设对照组,LTA组,LPS组,ZymoA组和Poly I∶C组,无菌任氏液调整抗原浓度为0.5 μg/mL,发育至29期蝌蚪抗原急性腹腔注射,2 μL/只;注射后2、4、8、12和24 h取材3次,10只/ 次;对照组注射同等剂量无菌任氏液。
1.2.3 免疫组织化学检测常规石蜡包埋,5 μm切片,脱蜡至水,pH6.0枸橼酸缓冲溶液抗原修复;正常山羊血清封闭,一抗1∶200稀释后,4℃孵育过夜,对照组采用PBS代替对照,1∶200稀释的羊抗兔IgG抗血清室温孵育45 min;滴加ABC试剂,DAB显色5 min;苏木精复染,常规脱水透明,封固。显微镜观察并采集图像。
1.2.4 半定量PCR检测试剂盒法提取蝌蚪总RNA,参照 TIANScript RT Kit步骤反转录得到cDNA,GAPDH作为内参,RT-PCR扩增TLR2,引物序列分别为:TLR2-F:CGCCAATGAAACTGTG-CTT;TLR2-R:CGTACTTACACCATTCGCTTCT;GAPDH-F:AGCAAAGGCTGTTGGGAAAGT;GAPDH-R:TCAAAGATGGAGGAATGAGTG。反转录:70℃ 5 min,42℃ 50 min,95℃ 5 min。PCR扩增体系:95℃ 5 min;95℃ 10 s;49℃ 20 s;72℃ 30 s;4℃ 5 min,50个循环;退火温度:TLR2 49℃,GAPDH 55℃。琼脂糖凝胶电泳检测回收产物,凝胶图像分析系统(HerolabE.A.S.YWin32,德国)观察结果。
1.2.5 数据统计采用SPSS16.0及R软件对数据进行方差齐性检验(F>0.05),单因素方差分析,数据以x± s表示,其中0.01 < P < 0.05代表存在显著性差异,P < 0.01存在极显著性差异。
2 结果 2.1 东北林蛙发育早期TLR2的定位分析每张切片随机取10个非重叠视野(l00×)进行结果判定,PBS对照组确定TLR2阴性结果;DAB棕色显色为阳性结果,苏木精复染为蓝紫色。TLR2最早在19期的心脏细胞检测到阳性结果(图 1),21期检测到肾脏和肝脏细胞的阳性表达(图 2),TLR2在消化道主要分布在粘膜层和小肠绒毛,细胞质和细胞膜表达水平较高,细胞核存在低表达状况。外鳃为细胞质表达,至24期内鳃出现细胞核和细胞质双重表达的特征;软骨、胰腺、肌肉等均检测到较弱的细胞质表达。
 |
| A,B :对照组;C :19 期心脏;D :27 期心脏 图 1 东北林蛙发育早期心脏TLR2 的免疫组织染色结果(400×) |
 |
| A-D,I-L :对照组;E :24 期外鳃;F :29 期内鳃;G :21 期肾脏;H :29 期肾脏;M :26 期肠;N :28 期肠;O :21 期肝脏;P :28 期肝脏图 2 东北林蛙发育早期TLR2 的免疫组织染色结果(400×) |
11期东北林蛙TLR2 mRNA相对表达量0.187±0.021,随着胚胎的发育逐渐上升,25期至峰值0.373±0.031后逐渐下降,42期降低到0.170±0.020。相对11期,17期至25期表达量增加极显著(P < 0.01);TLR2 mRNA相对表达量下调过程中,29-42期下降明显与25期具极显著性差异(P < 0.01)(图 3,图 4)。
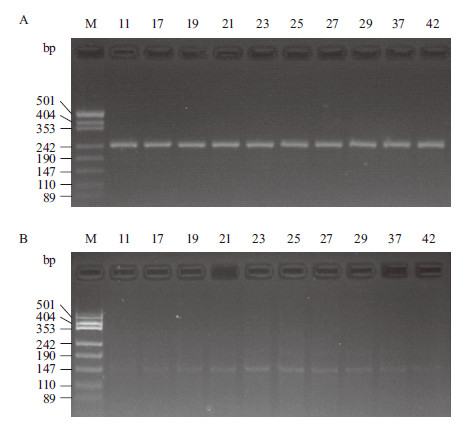 |
| 图 3 东北林蛙发育早期GAPDH(A)和TLR(B)电泳图 |
 |
| *表示与11 期呈显著性差异(0.01 < P < 0.05),**表示与11 期呈极显著性差 异(P < 0.01) 图 4 东北林蛙发育早期TLR2 mRNA 相对表达量变化 |
抗原注射后,LPS组与Zymo A组TLR2 mRNA相对表达量出现小幅的上升,但与对照组无显著性差异(P>0.05);LTA组TLR2 mRNA相对表达量均高于对照组,于4 h与12 h出现两次显著性升高(P < 0.01),分别为0.215±0.170和0.191±0.242。PolyI∶C组TLR2的相对表达量逐渐增加,8 h至峰值0.197±0.0058,具极显著性差异(P < 0.01)(图 5,图 6)。对照组TLR2相对表达量未出现显著性变化(P>0.05)。
 |
| A :LPS 组;B :Zymo A 组;C :PolyI∶C 组;D :LTA 组图 5 各实验组TLR2 和GAPDH 电泳图 |
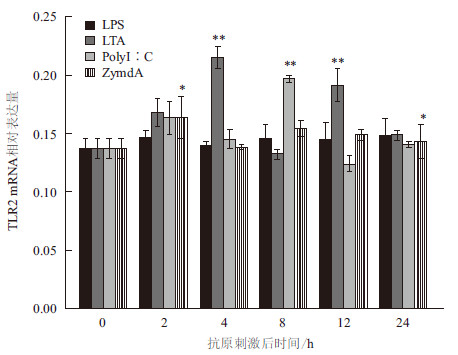 |
| *表示与对照组呈显著性差异(0.01 < P < 0.05),**表示与对照组呈极显著性 差异(P < 0.01)图 6 各实验组TLR2 mRNA 相对表达量变化 |
哺乳动物的TLR2分布广泛,主要表达于树突状细胞、单核细胞、巨噬细胞及中性粒细胞等一线防御相关细胞,上皮细胞及肿瘤细胞也有表达[11]。本实验结果显示TLR2在东北林蛙发育早期各脏器具有广泛的分布,同时RT-PCR检测到11期至42期的东北林蛙蝌蚪TLR2 mRNA的表达量随发育时期呈现波动变化特征。Ishii等[8]也证实TLRs mRNA在非洲爪蟾的蝌蚪和成体时期的所有组织中存在着差异性表达。从东北林蛙个体发育角度来看,脱模前后的蝌蚪获得性免疫不健全,机体需直接暴露于微生物复杂的水环境中,TLR2作为先天免疫中一种重要的防御蛋白,其表达量的持续性升高应该是机体一种积极的保护性调节;至25期鳃盖闭合,TLR2 mRNA表达量至峰值,此时机体体液免疫已经初具规模,肝脏内具有成熟的B细胞,体液中可检测出分泌型抗体;直至42期变态发育将近完成,此时的获得性免疫功能已趋于完善[12],TLR2 mRNA的表达水平也基本稳定。东北林蛙发育早期TLR2表达的时空特征与东北林蛙的生境变化和发育阶段相适应,对于东北林蛙胚胎时期应对水环境中各种抗原的挑战有着积极的作用。
有关南亚野鲮TLR2的研究发现,Zymosan,PGN和LTA 均可以诱导TLR2表达量的升高[13];LPS,Polyl∶C会引起斜带石斑鱼TLR2表达水平显著上调[14]。但革兰氏阴性细菌感染蓝鲶鱼初期可检测到TLR2表达量出现明显的降低[15],说明鱼类TLR2具有广泛的PAMPs识别谱系。革兰氏阳性菌也是哺乳动物TLR2的主要配体,介导LTA诱发的多种炎症反应[16]。本实验中LTA组在24 h内皆检测到TLR2 mRNA表达量的上升,并出现两次极显著性升高,启动最迅速,上调幅度最大,应答时程最长,说明东北林蛙发育早期TLR2可以识别并应答革兰氏阳性细菌的刺激,与鱼类和哺乳动物具有极大的相似性,从一定角度上反应了TLR2信号转导的保守性。人工合成的双链RNA类似物PolyI∶C可以作为诱导剂模拟病毒感染,研究已经证实哺乳动物TLR2无法识别病毒的dsRNA,TLR3是哺乳动物识别病毒双链RNA及其类似物PolyI∶C的主要受体;但是彩虹病毒可以诱导东北林蛙皮肤TLR2在感染后12 h后出现上调[9]。本实验中PolyI∶C组TLR2表达量缓慢增加至8 h达到峰值,应答幅度及速度仅次于LTA组。因此,无尾两栖类的TLR2可能具有比哺乳动物更为广泛的配体识别和防御功能,29期东北林蛙蝌蚪TLR2对于哺乳类动物TLR2不识别的病毒dsRNA产生了积极的应答,更倾向于鱼类TLR2的应答特征。研究已经证明非洲爪蟾TLRs由哺乳动物和鱼类两种类型的TLRs共同组成[8],TLR2这种功能上的差异很可能是与其结构演变相匹配,以适应水陆两栖的过渡性生活环境。
哺乳动物的TLR2可识别LPS并产生炎性因子,但TLR2并不是决定革兰氏阴性菌感染的必须受体,而是作为“二级受体”加强炎症反应的进程[17],TLR2敲除小鼠对伤寒菌感染相对耐受,炎症较弱,而TLR9敲除小鼠则表现出极度敏感[18],说明TLR2在控制感染和活化免疫系统中的冗余。本实验中LPS的刺激并未引起蝌蚪TLR2 mRNA的显著性变化,我们推测无尾两栖类的TLR2可能作为辅助受体对革兰氏阴性菌进行识别,其激活需要较长的应答时间。而ZymoA作为一种最古老的真菌细胞壁成分,哺乳动物的TLR2与TLR6以异源二聚体的形式对其进行识别与应答,可引起腹膜炎模型小鼠白细胞NF-κB的磷酸化,控制炎症反应的过程[19];大鼠小神经胶质细胞上表达的TLR2可以在其配体ZymoA的刺激下,引起细胞中IL-1β的释放[20];本实验中TLR2在ZymoA刺激后24 h内表达量未检测到显著性变化(P>0.05),无尾两栖动物TLR2是否识别并应答ZymoA的刺激还有待深入研究。
4 结论29期东北林蛙TLR2对LPS和ZymoA未产生积极应答,对LTA和PolyI∶C进行了有效的识别和应答,说明无尾两栖类的TLR2已经逐渐失去了鱼类TLR2广泛的PAMPs配体识别谱系;其针对微生物的防御兼具了鱼类和哺乳动物两者的应答特征,在一定程度上体现了免疫系统在进化上的过渡特征。
| [1] | Lester SN, Li K. Toll-like receptors in antiviral innate immunity[J].J Mol Biol, 2014, 426(6):1246-1264. |
| [2] | Satake H, Sekiguchi T. Toll-like receptors of deuterostome inverteb-rates[J]. Front Immunol, 2012, 3:34-40. |
| [3] | Quiniou SM, Boudinot P, Bengtén E. Comprehensive survey and genomic characterization of Toll-like receptors(TLRs)in channel catfish,Ictalurus punctatus:identification of novel fish TLRs[J]. Immunogenetics, 2013, 65(7):511-530. |
| [4] | 孙红娟, 周遵春, 崔军, 等. 海洋动物Toll样受体的研究进展[J]. 生物技术通报, 2013(1):41-48. |
| [5] | Ramasamy KT, Verma P, Reddy MR. Toll-like receptors gene expression in the gastrointestinal tract of Salmonella serovar Pullorum-infected broiler chicken[J]. Appl Biochem Biotechnol, 2014, 173(2):356-364. |
| [6] | Roy R, Kumar D, Sharma A, et al. ZnO nanoparticles induced adjuvant effect via toll-like receptors and Src signaling in Balb/c mice[J]. Toxicol Lett, 2014, 230(3):421-433. |
| [7] | Klawitter M, Hakozaki M, Kobayashi H, et al. Expression and regulation of toll-like receptors(TLRs)in human intervertebral disc cells[J]. Eur Spine J, 2014, 23(9):1878-1891. |
| [8] | Ishii A, Kawasaki M, Matsumoto M, et al. Phylogenetic and expression analysis of amphibian Xenopus Toll-like receptors[J]. Immunogenetics, 2007, 59(4):281-293. |
| [9] | 吴立舒. 彩虹病毒胁迫下东北林蛙皮肤TLR mRNA的差异表达[D]. 哈尔滨:东北林业大学, 2012. |
| [10] | 王寿兵, 张思路, 屈云芳, 等. 辽宁产中国林蛙早期胚胎发育研究[J]. 复旦学报:自然科学版, 1996, 35(2):163-169. |
| [11] | Abdi J, Garssen J, Redegeld F. Toll-like receptors in human multiple myeloma:new insight into inflammation-related pathogenesis[J]. Curr Mol Med, 2014, 14(4):423-431. |
| [12] | Du Pasquier L, Robert J, et al. B-cell development in the amphibian Xenopus[J]. Immunological Reviews, 2000, 175:201-213. |
| [13] | Samanta M, Swain B, et al. Molecular characterization of toll-like receptor 2(TLR2), analysis of its inductive expression and asso-ciated down-stream signaling molecules following ligands exposure and bacterial infection in the Indian major carp, rohu(Labeo rohita)[J]. Fish Shellfish Immunol, 2012, 32(3):411-425. |
| [14] | 韦友传. 斜带石斑鱼TLR1/TLR2和MyD88基因的克隆与免疫应答研究[D]. 南宁:广西大学, 2011. |
| [15] | Baoprasertkul P, Peatman E, et al. Structural characterisation and expression analysis of toll-like receptor 2 gene from catfish[J]. Fish Shellfish Immunol, 2007, 22(4):418-426. |
| [16] | Park OJ, Han JY, et al. Lipoteichoic acid of Enterococcus faecalis induces the expression of chemokines via TLR2 and PAFR signal-ing pathways[J]. J Leukoc Biol, 2013, 94(6):1275-1284. |
| [17] | Oliveira-Nascimento L, Massari P, Wetzler LM. The role of TLR2 in infection and immunity[J]. Front Immunol, 2012, 3:79-95. |
| [18] | 战仁慧. TLR2, TLR4和TLR9在小鼠抵抗鼠伤寒沙门氏菌感染中的作用[D]. 济南:山东大学, 2013. |
| [19] | Wypasek E, Natorska J, et al. Toll-like receptors expression and NF-κB activation in peritoneal leukocytes in morphine-mediated impairment of zymosan-induced peritonitis in swiss mice[J]. Arch Immunol Ther Exp(Warsz), 2012, 60(5):373-382. |
| [20] | Facci L, Barbierato M, Marinelli C, et al. Toll-like receptors2, -3and -4prime microglia but not astrocytes across central nervous system regions for ATP-dependent interleukin-1β release[J]. Sci Rep, 2014, 4:6824-6832. |




