血栓病是心脑血管疾病中死亡率和严重致残率较高的人类重大疾病之一,在国内外有较高的病率。虽然人组织纤溶酶原激活剂(ht-PA)是目前临床血栓疾病的治疗主要生物药品之一,但是有着出血副作用较大、半衰期短的缺点[1, 2];重组人纤溶酶原激活剂(rhPA,F、E、K1区缺失体)具有出血副作用小、半衰期长、溶栓活性高等特点,能够更安全有效地治疗血栓病[3, 4, 5, 6, 7]。目前用于血栓疾病治疗的重组药用蛋白主要靠原核生物生产,具有生物溶栓活性较低、生产成本高等缺点;使用转基因动物乳腺生物反应器可获得活性高、生产成本低的重组药用蛋白[4]。
家兔是最早用于胚胎移植等研究的实验动物之一,具有多胎、妊娠期短、繁殖快、全年多发情,产仔率高等优点,并且泌乳能力较高,因而可用家兔乳腺生产重组药用蛋白。受精卵原核显微注射制备转基因动物早有报道,但依然是一种相当合适的制备转基因兔的方法。本研究以人t-PA的F、E、K1区位点缺失体为编码序列,以山羊β-酪蛋白/CMV杂合启动/增强子,构建了乳腺特异性表达载体PCL25/rhPA,通过受精卵原核显微注射法制备转基因兔。
1 材料与方法 1.1 材料 1.1.1 试剂Not I、Sal I、Taq等酶为大连TaKaRa公司产品;苯酚、氯仿、无水乙醇等均为国产分析纯;DNA胶回收纯化试剂盒(287704,QIAGEN);FSH(110044629,宁波市三生药业有限公司);HCG(091217B,丽珠集团丽珠制药厂);胎牛血清(SH30070.03,HyClone);M2(11G801,Sigma);M16(11A832,Sigma);引物为生工生物工程(上海)有限公司合成;ELISA试剂盒为上海西唐生物科技有限公司产品;阿替普酶(Boehringer Ingelheim Pharma Gmbh & Co. Kg);纤维蛋白原(F8630,Sigma);凝血酶(T4648,Sigma);组织裂解液、冲卵液自配(参照小鼠胚胎操作实验手册),所用药品均购自Sigma 公司。
1.1.2 实验动物性成熟的中国家兔,饲养于本实验室。
1.1.3 主要仪器和器具倒置显微镜和显微操作仪(Leica,德国),体视显微镜(厦门麦克奥迪公司),CO2 培养箱(No.3111,Forma Science Inc.美国),拉针仪(PB-7 Micropipette Puller,Narisgige,日本),DNA扩增仪(S1000 Thermal Cycler,Bio-RAD,美国),酶标仪(RT-6000,Rayto,深圳),常规小动物手术器械。
1.1.4 乳腺特异性表达载体质粒PCL25/rhPA由本实验室制备并保存。在乳腺特异性表达载体pBC1的Xho I限制性酶切位点处插入化学合成的rhPA cDNA片段。构建成的含有目的基因rhPA cDNA片段的乳腺特异性表达载体命名为PCL25/rhPA,大小为23 361 bp。用Not I和Sal I双酶切,去除原核基因片段并使之线性化(图 1)。
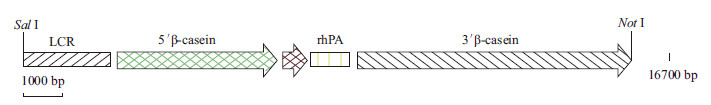 |
| 图 1 乳腺特异性表达载体PCL25/rhPA 结构 |
用Not I和Sal I双酶切质粒PCL25/rhPA,用DNA胶回收纯化试剂盒回收真核部分供显微注射用。用TE缓冲液(5 mmol/L Tris,pH 7.4 0.1 mmol/L EDTA)溶解定量为5 ng/μL,分装为10 μL/管,-20℃短暂低温保存。
1.2.2 兔超数排卵挑选未发情成年母兔作为供体兔,第1天19:00肌肉注射FSH 15 U/只;第2天7:00肌肉注射FSH 15 U/只,19:00肌肉注射FSH 10 U/只;第3天7:00肌肉注射FSH 10 U/只,19:00肌肉注射FSH 5 U/只;第4天7:00肌肉注射FSH 5 U/只,19:00静脉注射hCG 100 U/只后与正常公兔配种;第5天12:00手术取卵[8, 9]。
在供体兔配种的同时,挑取自然发情的成年母兔作受体兔,耳缘静脉注射HCG 100 U/只,以备次日手术移植。母兔发情的主要标志为阴道黏膜呈潮红色。
1.2.3 回收胚胎供体兔注射hCG后17 h,仰卧保定,静脉空气针处死兔,无菌剖腹取出卵巢和输卵管连同子宫,移到实验室胚胎间,剪除粘附的脂肪,反复冲洗直至不再出血为止,用2.5 mL注射器吸取冲卵液从子宫方向朝输卵管喇叭口方向冲胚,回收受精卵细胞,在体视显微镜下计数观察。
1.2.4 显微注射与移植将已回收定量的显微注射片导入受精卵的雄原核内,培养30 min后手术移植到同步发情的受体母体输卵管内,待孕。
1.2.5 PCR检测利用Primer5.0设计检测引物,上游引物F1位于CMV,下游引物R1位于rhPA编码区。扩增产物大小为556 bp,跨越CMV与rhPA接头区。
引物序列如下:F1:5'-CGTGGATAGCGGTTTGA -3',R1:5'-GAGCCCTCCTTTGATGC -3'。
PCR参数为:95℃预变性5 min;94℃变性45 s,57℃退火45 s,72℃延伸1 min,共30个循环;最后72℃延伸10 min。
1.2.6 转基因兔乳腺特异性rhPA表达检测转基因母兔配种怀孕挤奶,收集乳汁。乳汁离心,10 000×g,30 min,去除上层脂肪及下层浑浊,吸取乳清。用上海西唐生物科技有限公司ELISA试剂盒检测,具体操作见说明书。
1.2.7 转基因兔表达产物活性检测使用纤维蛋白平板法(FAPA)检测rhPA的生物活性[10, 11]。以PBS为溶剂,配制1.0%琼脂糖凝胶、10 mg/mL纤维蛋白原(制品中含少量的纤溶酶原,Fibrinogen, F)、1 U/mL凝血酶(Thrombin,T);煮沸熔化琼脂糖凝胶,取10 mL置小烧杯内,待其温度降至55-60℃,取预热至37℃的纤维蛋白原1 mL注入,摇匀,再取预热至42℃的凝血酶注入,摇匀后迅速倒入直径为9 cm的玻璃培养皿内,室温凝固后打孔、封底,每孔加入20 μL样品,放置37℃恒温箱孵育过夜后观察。
2 结果 2.1 显微注射片段纯化回收用Not I和Sal I双酶切质粒PCL25/rhPA,使用胶回收纯化试剂盒纯化16 700 bp片段作显微注射片段,电泳结果见图 2。
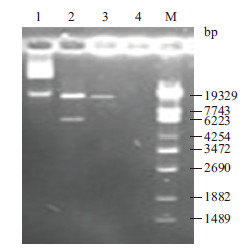 |
| 1 :质粒PCL25/rhPA ;2 :质粒PCL25/rhPA 经Not I 和Sal I 双酶切后产物;3 : 显微注射用DNA 片段;4 :双蒸水;5 :λ-EcoT14 DNA Marker 图 2 Not I 和Sal I 双酶切PCL25/rhPA 电泳结果 |
通过对8只供体兔超数排卵获得251枚受精卵,挑选较好的113枚受精卵进行显微注射,培养后再挑选其中形态较好的109枚移植到5只同步发情的母兔输卵管中,其中3只怀孕,妊娠到期共出生19只仔兔。经PCR及产物测序筛选,共获得5只兔(2♂,3♀)整合有目的基因(图 3),出生仔兔整合率为29.7%。两只公兔(K29,K30)分别与正常母兔配种,获得K29 F1代整合兔4只(3♂,1♀),K30 F1代整合兔7只(4♂,3♀)(图 4)。
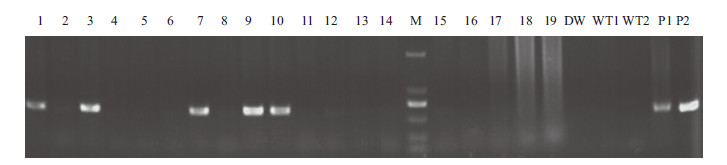 |
| 1-19 :F0 代待测兔基因组;DW :双蒸水作空白对照;WT1,WT2 :正常兔基因组;M :DL2000 DNA Marker ;P1, P2 :显微注射片段PCR 扩增产物作阳性对照 图 3 F0 代仔兔PCR 检测结果 |
 |
| 1-6 :K29 F1 代仔兔基因组;7-18 :K30 F1 代仔兔基因组;DW :双蒸水作空白对照;M :DL2000 DNA Marker ; WT :正常兔基因组作阴性对照;P :显微注射片段PCR 扩增产物作阳性对照 图 4 原代转基因公兔F1 代仔兔PCR 检测结果 |
3只原代母兔乳清经ELISA检测,其中A10乳清中检测到重组人纤溶酶原激活剂(rhPA),A11、A12乳清中未检测出。两只原代公兔的F1代母兔(K29-1、K30-6)乳清经ELISA检测(图 5),其中K29-1乳清中检测到重组人纤溶酶原激活剂(rhPA),但K30-6乳清中未检测出。A10乳清中rhPA含量为60 μg/mL,K29-1乳清中rhPA含量为400 μg/mL, 图 5和图 6中结果均为样品稀释500倍后实验所得。
 |
| A1-A7 :阿替普酶用PBS 倍比稀释作阳性对照,浓度依次为1200、600、 300、150、75、37.5 和18.8 ng/mL;B1-B4:PBS;B5-B7,C1-C3:正常兔奶样; C4-C7,D2 :依次为转基因兔A10,A11,A12,K30-6,K29-1 奶样 图 5 ELISA 检测5 只雌性转基因兔乳清中rhPA |
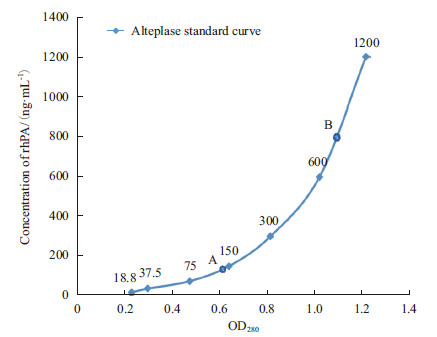 |
| 阿替普酶浓度标准曲线:18.8 ng/mL,37.5 ng/mL,75 ng/mL,150 ng/mL, 300 ng/mL,600 ng/mL,1200 ng/mL。A :转基因兔A10 奶样稀释500 倍检 测结果(120 ng/mL);B :转基因兔K29-1 奶样稀释500 倍检测结果(800 ng/mL) 图 6 A10 乳清及K29-1 乳汁中rhPA 浓度 |
经纤维蛋白平板溶圈法的体外活性检测,结果(图 7)表明两只表达兔的表达产物均具有体外溶纤活性。其中K29-1表达的rhPA活性约为阿替普酶150-200倍。重组人纤溶酶原激活剂转基因表达兔K29-1及A10如图 8所示。
 |
| A-E :转基因兔A10,A11,A12,K29-1,K30-6 奶样;F-J :阿替普酶用 PBS 倍比稀释作阳性对照,浓度依次为100 μg/mL,10 μg/mL,1 μg/mL,0.1 μg/mL,0.01 μg/mL ;K :PBS ;L-M :正常兔奶样作阴性对照 图 7 纤维蛋白平板溶圈法检测5 只雌性转基因兔乳清中 rhPA 生物活性 |
 |
| A :K29-1,乳汁中rhPA 浓度为400 μg/mL ;B :A10,乳汁中rhPA 浓度为 60 μg/mL 图 8 重组人纤溶酶原激活剂转基因表达兔 |
人组织纤溶酶原激活剂(ht-PA)由5个功能相对独立的结构域组成[3]:F区、E区、三角区K1、三角区K2、P区;其中F、E、K1区与t-PA在体内的清除相关,K2、P区是与t-PA蛋白功能相关的重要区域。Smalling 等[3]在1995年报道了缺失F、E、K1片段可延长纤溶酶原激活剂在体内的溶栓作用时间及更好的溶栓特性。本研究以ht-PA的F、E、K1区位点缺失体为编码序列,构建了乳腺特异性表达载体,并且重组编码序列rhPA基因可以在转基因家兔乳腺细胞中表达,表达重组蛋白分泌到乳汁中,这在国内外尚未见报道。
本研究中的乳腺特异性表达载体上携带山羊β-酪蛋白/CMV杂合启动/增强子。成勇[12]在2007年报道了山羊β-酪蛋白/CMV杂合启动/增强子驱动人乳铁蛋白(hLF)在小鼠乳腺中特异性表达,表达水平可达2-8.1 g/L,并且在血清及唾液中均未检测到rhLF表达,表明山羊β-酪蛋白/CMV杂合启动/增强子用于乳腺生物反应器既可提高目的蛋白表达量又能保证表达特异性。
哺乳动物乳腺细胞相对于原核生物及酵母具有翻译后更完善的修饰和加工能力,从而能保证表达产物能有更高的生物活性。田文静[13]于2010年报道了瑞替普酶(rhPA,F、E、K1区缺失体)在大肠杆菌中表达,表达产物复性后具有溶栓活性。本研究用山羊β-酪蛋白/CMV杂合启动/增强子驱动ht-PA的F、E、K1区位点缺失体编码序列在家兔乳腺中表达。体外溶纤试验的结果表明,表达产物具有溶纤活性,其溶栓活性是药品阿替普酶的150-200倍,这一结果也提示我们,不仅重组纤溶酶原激活剂可以实现乳腺特异性表达,而且重组体有更好的药理学特性,该结果显示转基因动物生产rhPA的优势,也为溶血栓新药的创制提供了有应用价值的材料。
据世界卫生组织(WHO)统计分析,全球平均每年有1 700万人以上死于心脑血管病(脑血栓和心肌梗死),临床上对溶血栓药的需求量很大。目前国内纤溶酶原激活剂溶栓药物中有阿替普酶、瑞替普酶、孟替普酶、替尼普酶等,但这些溶血栓药大部分是由大肠杆菌生产,比活性较低,使用副作用大。此外,这些产品都是国外专利产品,无自主知识产权,因此价格昂贵,大众使用受到限制。乳腺生物反应器制备的rhPA具有比活性高、半衰期长、产量高、价格便宜等特点,临床应用时可减少药物用量从而减小毒副作用。
4 结论本研究设计了重组人纤溶酶原激活剂编码序列(rhPA,F、E、K1区缺失体),并获得了乳腺特异性表达rhPA基因转基因兔,乳汁中rhPA表达水平达400 μg/mL,rhPA比活性是药品阿替普酶(ht-PA)的150-200倍。
| [1] | Sun XH, Berthiller J, Trouillas P, et al. Early fibrinogen degradation coagulopathy:A predictive factor of parenchymal hematomas in cerebral rt-PA thrombolysis[J]. Journal of the Neurological Sciences, 2015, 351(1-2):109-114. |
| [2] | Collen D, Lijnen HR. The Tissue-Type Plasminogen Activator Story. Arteriosclerosis[J]. Thrombosis and Vascular Biology, 2009, 29(8):1151-1155. |
| [3] | Smalling RW, Bode C, Kalbfleish J, et al. More rapid, complete, and stable coronary thrombolysis with bolus administration of reteplase compared with alteplase infusion in acute myocardial in farction[J]. Circulation, 1995, 91(11):2725-2732. |
| [4] | 冮洁, 路福平, 杜连祥. 组织型纤溶酶原激活剂-及其突变体的表达研究进展[J]. 药物生物技术, 2003, 10(4):251-255. |
| [5] | 江成英, 郭宏文, 冮洁. 人组织型纤溶酶原激活剂-突变体的研究现状及进展[J]. 农产品加工·学刊, 2008, 142(7):141-143. |
| [6] | 周雪艳. 瑞替普酶(rPA)及其突变体的构建和在大肠杆菌与CHO细胞中的表达研究[D]. 长春:吉林大学, 2006. |
| [7] | 黄坚, 龙青, 任启生等. 重组基因在毕赤酵母细胞中的胞内表达研究[J]. 中国生化药物杂志, 2003, 24(2):58-61. |
| [8] | 宋绍征, 葛欣, 张利清, 等. 家兔超数排卵和胚胎移植妊娠率的影响因素分析[J]. 畜牧与兽医, 2013, 45(8):14-18. |
| [9] | 王田娟, 章志国, 邢琼, 等. 不同超排方法对家兔超数排卵效果的影响[J] 安徽医科大学学报, 2011, 46(4):355-357 |
| [10] | 李华, 陈陵霞, 许瑞安. 纤溶活性的药学测定方法研究[J]. 中国临床药理学与治疗学, 2008, 13(9):1066-1070. |
| [11] | 张守峰, 扈荣良, 赵君, 等. 体外纤溶活性及半定量检测方法的确立[J]. 中国兽医学报, 2002, 22(5):436-437. |
| [12] | 成勇. 乳蛋白与CMV复合启动子驱动hLF cDNA乳腺特异性表达[D]. 南京:南京农业大学, 2007. |
| [13] | 田文静. 溶栓药物瑞替普酶(rPA)的大肠杆菌表达研究[D]. 天津:天津科技大学, 2010. |




