全氟辛烷磺酸盐(PFOS)是全氟化合物(PFCs)降解的产物之一,其结构中具有C-F键,具有稳定、疏水、疏油等特征,在日常生活中应用广 泛[1, 2, 3]。调查显示,在欧洲、北美、日本、中国等国家的多种生物中均检测到PFOS的存在,这些生物既包括低等的藻类又有高等的哺乳动物和鸟类,甚至在人体的血清、乳汁和脐带血中也检测到PFOS的存 在[4, 5]。大量研究证实,PFOS在生物体内具有蓄积和致毒的效应,并且可以通过食物链富集,长期存在于人和动物体内,并具有肝脏毒性、发育毒性、免疫毒性等全身多脏器毒性[6, 7, 8, 11],但对PFOS的毒性机理仍不明确,过量的PFOS进入生物体刺激细胞产生大量的活性氧而引起机体的氧化损伤,此外,它还可以破坏细胞膜,影响基因的结构和 表达[9, 10, 11, 12]。
目前,对PFOS的研究大多集中于小白鼠、鱼类等高等动物中[4, 6, 7, 12],对于PFOS对低等动物毒性的研究甚少。东亚三角涡虫作为低等扁形动物,对环境变化十分敏感,并且具有强大的再生能力,是研究再生与凋亡平衡的良好材料,也是一种良好的水体污染指示物[13, 14, 15, 16, 17, 18]。再生中的涡虫暴露于高浓度PFOS中,会产生一种外界环境压力。本研究通过检测PFOS胁迫下再生涡虫中GSH-Px酶、GST 酶、POD酶活性的变化以及MDA的含量的变化,初步探究PFOS对再生涡虫的氧化损伤作用。
1 材料与方法 1.1 材料东亚三角涡虫采自博山泉河头的泉水中,22℃凉开水培养,PFOS产自ALORICH公司,DMSO(Dimethyl Sulfoxide)产自Klontech公司。谷胱甘肽过氧化物酶(GSH-PX)试剂盒,谷胱甘肽-S转移酶(GST)试剂盒,过氧化物酶(POD)试剂盒,丙二醛(MDA)试剂盒购于南京建成生物公司。
1.2 方法 1.2.1 再生涡虫的胁迫PFOS以0.005%的DMSO溶液溶解,配置为0、0.5、1、5、10 mg/L五个浓度,涡虫自耳突下缘切去头部(在肉眼下操作),每个处理10条涡虫,每天更换一次培养溶液。分别于处理1、3、5、7和10 d后提取涡虫蛋白,测再生涡虫中GSH-PX酶、GST酶、POD酶的活性以及MDA的含量。
1.2.2 涡虫总蛋白的提取将10条涡虫置于1.5 mL离心管中,洗净,吸干水,液氮中迅速冷冻,使用塑料杵子研磨成粉末,加入适量PBS缓冲液(M/V=1∶100,PBS:0.01 mol/L,pH7.4),继续研磨成糊状,4℃ 10 000 r/min离心30 min,取上清,4℃ 10 000 r/min离心15 min,取上清分装保存。立刻测蛋白和酶的活性,也可以-80℃冻存。
1.2.3 酶活的测定使用南京建成生物公司的酶测定试剂盒,每毫克蛋白质,扣除非酶反应的作用,使体系中GSH浓度降低1 μmol/L为GSH-Px酶的一个酶活力单位;每毫克组织蛋白在37℃反应1 min扣除非酶促反应,使体系中GSH浓度降低1 μmol/L为GST酶的一个酶活力单位;在37℃条件下,每毫克组织蛋白每分钟催化1 μg底物的酶量为POD酶的一个活力单位。具体实验方法按照南京建成生产的试剂盒说明书进行。
1.3 数据处理测定结果用Excel2007进行数据处理以及分析,用SPSS16.0进行数据的显著性分析。
2 结果 2.1 PFOS对再生涡虫体内GSH-PX酶活性的影响如图 1所示,PFOS处理再生涡虫,再生1 d时,对照组涡虫中GSH-Px酶活性达到最高值,其余浓度处理组涡虫中GSH-Px酶活性均低于对照组,差异具有显著性,且随着浓度的升高,GSH-Px酶活性也呈上升趋势;再生3 d时,对照组涡虫中GSH-Px酶活性显著降低,对照组涡虫中GSH-Px酶活性高于处理组涡虫中GSH-Px酶活性,各浓度处理组涡虫中GSH-Px酶活性差异不显著;再生5 d时,处理组涡虫中GSH-Px酶活性低于对照组,1 mg/L和5 mg/L处理组涡虫中GSH-Px酶活性最低;再生7 d时,各组涡虫中GSH-Px酶的活性较再生5 d均有下降,10 mg/L处理组涡虫中GSH-Px酶活性高于对照组,其余处理组涡虫中GSH-Px酶活性均低于对照组,再生10 d时;各组涡虫中GSH-Px酶活性均达到最低,各处理组涡虫中GSH-Px酶活性差异不显著。
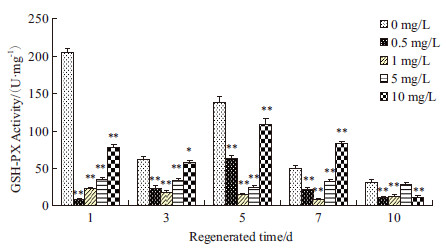 |
| *P<0.05 ;**P<0.01 图 1 PFOS 对GSH-Px 酶活性的影响 |
如图 2所示,PFOS处理再生涡虫,再生1 d时,5 mg/L,10 mg/L处理组涡虫中GST酶活性高于对照组,约为对照组的2-3倍,差异具有极显著性;再生3 d时,10 mg/L处理组涡虫中GST酶活性高于对照组,差异具有极显著性,其余浓度处理组涡虫中GST酶活性低于对照组,只有5 mg/L处理组差异有极显著性;再生5 d时,0.5 mg/L处理组涡虫中GST酶活性低于对照组,差异有极显著性,其余浓度组涡虫中GST酶活性高于对照组,5 mg/L处理组涡虫中GST酶活性达到最高;再生7 d时,5 mg/L处理组涡虫GST酶活性继续处于高水平,其余处理组涡虫中GST酶活性与对照组差异不显著;再生10 d时,5 mg/L处理组涡虫中GST酶活性开始下降到对照组水平,其余处理组涡虫中GST酶活性略低于对照组。
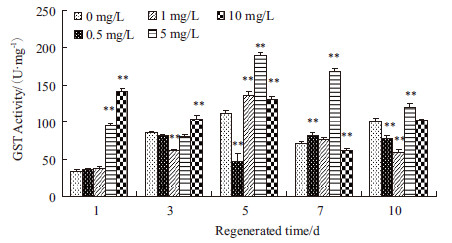 |
| *P<0.05 ;**P<0.01 图 2 PFOS 对GST 酶活性的影响 |
如图 3所示,PFOS处理再生涡虫,再生1 d时,处理组涡虫中POD酶活性低于对照组,0.5 mg/L处理组涡虫中POD酶活性最低,约为对照组的1/5;再生3 d时,各组涡虫中POD酶活性最低,各处理组涡虫中POD酶活性低于对照组,各处理组之间差异不显著;再生5 d时,各组涡虫中POD酶活性开始升高,5 mg/L处理组涡虫中POD酶的活性低于对照组,其余处理组涡虫中POD酶活性均高于对照组;再生7 d时,各组涡虫中POD酶活性继续升高,只有0.5 mg/L处理组涡虫中POD酶活性略有下降,5 mg/L处理组涡虫中POD酶活性达到最大值;再生10 d时,各组涡虫中POD酶活性开始下降,0.5 mg/L处理组涡虫中POD酶活性低于对照组,5 mg/L,10 mg/L处理组涡虫中POD酶活性高于对照组,各处理组之间随着浓度的升高,POD酶活性也呈上升趋势。
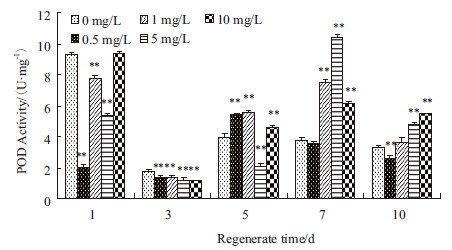 |
| *P<0.05 ;**P<0.01 图 3 PFOS 对POD 酶活性的影响 |
如图 4所示,PFOS处理再生涡虫时,再生1 d时,0.5 mg/L处理组涡虫中MDA含量略低于对照组,其余处理组中涡虫MDA含量约为对照组3-5倍,差异具有极显著性;再生3 d时,各处理组涡虫中MDA含量均高于对照组,10 mg/L处理组涡虫中MDA含量达到最大值;再生5 d时,0.5 mg/L,5 mg/L处理组涡虫中MDA含量接近约为对照组的2倍,其余处理组涡虫中MDA含量与对照相差不大;再生7 d时,各种涡虫中MDA含量均开始降低,各处理组之间随着浓度的升高,涡虫中MDA含量呈下降趋势,只有10 mg/L处理组涡虫中MDA含量低于对照组;再生10 d时,各组涡虫中MDA含量趋于稳定,1 mg/L处理组涡虫中MDA含量最高,其余处理组涡虫中MDA含量与对照组涡虫中MDA含量相近。
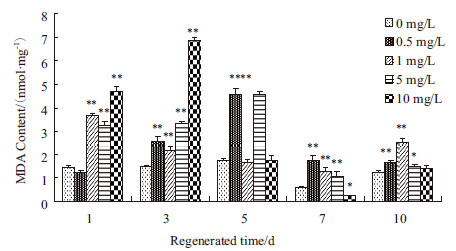 |
| *P<0.05 ;**P<0.01 图 4 PFOS 对MDA 含量的影响 |
体外培养的细胞和动植物个体实验均显示,PFOS诱导能造成体内活性氧(ROS)含量升高[21],过氧化氢酶,超氧化物歧化酶等抗氧化酶类表达量均显著增加[14, 15, 16, 17, 18]。抗氧化酶系主要包括过氧化物酶(POD)、谷胱甘肽过氧化物酶(GPX)等,其主要作用是清除体内的活性氧,保护机体免受外界有毒物质的刺激和损伤[16, 17]。此外,该类酶的其活力或含量可随着环境胁迫发生明显变化,因而检测该类酶的活性可以反映出机体所受的氧化损伤情况,丙二醛(MDA)是体内脂质过氧化的最终产物,MDA 含量的高低间接反映了机体的组织细胞受损伤度。当生物体在有毒物质的胁迫下,毒性物质可诱发生物体产生活性氧,当诱发物毒性较低时,机体所产生的少量活性氧可以由抗氧化酶消除,抗氧化酶的活性也会随之升高,保持体内各自由基代谢平衡,最终保持细胞正常的代谢不受破坏[19, 20]。当诱发物毒性较高时,生物机体内产生的活性氧不能及时被体内抗氧化防御系统消除,从而使生物机体造成氧化损伤[21, 22],这时体内各种抗氧化酶的活力将受到抑制,而MDA为脂质过氧化的最终产物,此时MDA的含量会明显上升。GST酶与肝脏的损失密切相关,检测GST酶的活性也有助于反映机体组织细胞的受损程度。
本实验显示,涡虫再生1 d时,对照组涡虫中GSH-Px酶、POD酶的活性显著升高,MDA的含量较低,表明再生对涡虫会产生氧化损伤,对照组涡虫能通过体内的抗氧化酶来清除体内在再生过程中产生的活性氧,但是PFOS处理组涡虫中GSH-Px酶,POD酶的活性远低于对照组,高浓度PFOS处理组涡虫中MDA的含量远高于对照组,表明在再生和PFOS的双重胁迫下,再生1 d涡虫的活性氧没有及时被清除,机体产生了氧化损伤,且随着PFOS浓度的升高,氧化损伤也随之加剧,高浓度PFOS处理组涡虫中GST酶的活性显著升高。涡虫再生3 d时,对照组涡虫中GSH-Px酶,POD酶的活性开始下降,说明对照组涡虫体内的抗氧化反应不显著,PFOS处理组涡虫中酶仍处于较低水平,MDA的含量继续升高,说明机体的氧化损伤加剧。所有组涡虫GST酶的活性均有升高说明GST酶对再生的胁迫损伤不敏感。涡虫再生5 d时,随着涡虫再生已经基本完成,PFOS处理组涡虫中GSH-Px酶,POD酶的活性开始升高,MDA的含量也开始下降,在低浓度组和高浓度组中尤为明显,说明PFOS处理组涡虫中抗氧化酶开始发挥作用,GST酶活性持续升高;在涡虫再生7 d和10 d时,对照组和PFOS处理组涡虫中GSH-Px、GST、POD酶的活性维持在稳定水平,MDA的含量也处于较低水平,说明涡虫体内的抗氧化反应不显著,再生完全的涡虫已对PFOS的胁迫产生了耐受。
本实验结果说明,在涡虫再生初期,由于再生对涡虫的胁迫,对照组涡虫已经启动抗氧化反应,实验处理组则因PFOS浓度过高引起了氧化损伤,但是随着再生天数的增加,对照组涡虫3 d后氧化应激反应不显著,而PFOS浓度处理组涡虫的抗氧化反应延迟到再生5 d时进行,此结果与孙丽群[23]、张合彩等[21]研究离子液对日本三角涡虫中抗氧化酶活性的变化趋势不同,原因可能是由于再生涡虫比成体涡虫更为敏感,也可能是因为涡虫对不同药物的敏感程度不同。此外,PFOS对再生涡虫中GST酶的影响不显著,可能是涡虫并没有真正的肝脏,所以GST酶的指标变化并不显著。
4 结论PFOS刺激涡虫能够引起涡虫的应激反应,在再生早期,PFOS胁迫会造成涡虫的氧化损伤和脂质的过氧化,并表现出随着PFOS浓度的升高,涡虫氧化损伤程度加剧的趋势,再生5 d时,机体产生抗氧化的反应,来消除体内的氧自由基,在再生的后期,由于涡虫对药物的耐受作用,涡虫的抗氧化反应不再明显。
| [1] | Calafast AM, Needham LL, Kukleny Z, et al. Perfluorinated chemicals in selected residents of the American continent[J]. Chemospherem, 2006, 63(4):490-496. |
| [2] | Kannan K, Tao L, Sinclair E, et al. Perfuorinated compounds in aquatic organisms at various trophic levels in Great Lakes food chain[J]. Arch Environ Contam Toxicol, 2005, 48(4):559-556. |
| [3] | Kannan K, Choi JW, Iseki N, et al. Concentrations of perfluorinated acids in lives of birds from Japan and Korea[J] Chemoshpere, 2002, 49(3):225-231. |
| [4] | 金一和, 刘晓, 张迅, 等. 人血清中全氟辛烷磺酰基化合物污染现状[J] 中国公共卫生, 2003, 19(10):1200-1201. |
| [5] | Case MT, York RG, Christian MS. Rat and rabbit oral developmental toxicology studies with two perfluorinated compounds[J] Int J Toxicol, 2001, 20(2):101-109. |
| [6] | Abbott BD, Wolf CJ, Das KP, et al. Developmental toxicity of perfluorooctane sulfonate(PFOS)is not dependent on expression of peroxisome proliferator activated receptor-alpha(PPAR alpha)in the mouse[J]. Reprod Toxicol, 2009, 27(3-4):258-265. |
| [7] | Lau C, Thibodeaux JR, Hanson RG, et al. Exposure to perfluorooctane sulfonate during pregnancy in rat and mouse. Ⅱ:postnatal evaluation[J]. Toxicol Sci, 2003, 74(2):382-392. |
| [8] | Dauwe T, Van de Vijver K, De Coen W, et a1. PFOS levels in the blood and liver of a small insectivorous songbirdnear a fluorochemicalplant[J]. EnvironInt, 2007, 33(3):357-361. |
| [9] | Loccisano AE, Campbell Jr. JL, Butenhoff JL, et al. Evaluation of placental and lactational pharmacokinetics of PFOA and PFOS in the pregnant, lactating, fetal and neonatal rat using a physiologically based pharmacokinetic model[J]. Reproductive Toxicology, 2012, 33:468-490. |
| [10] | Newsted JL, Coady KK, Beach SA, et al. Effects of perfluorooctane sulfonate on mallard and northern bobwhite quail exposed chronically via the diet[J]. Environmental Toxicology and Pharmacology, 2007, 23:1-9. |
| [11] | Florentin A, Deblonde T, Diguio N, et al. Impacts of two peruorinated compounds(PFOS and PFOA)on human hepatoma cells:Cytotoxicity but no genotoxicity?[J]. International Journal of Hygiene and Environmental Health, 2011, 214:493-499. |
| [12] | Luebker DJ, Hansen KJ, Bass NM, et al. Interactions of fluorochemicals with rat liver fatty acid-binding protein[J]. Toxicology, 2002, 176;175-185. |
| [13] | 马克学, 陈广文, 马世克. 涡虫再生研究进展[J]. 生物学教学, 2008, 33(1):6-8. |
| [14] | 孙祯, 潘红春, 王芳芳, 等. 温度对日本三角涡虫种群增长及抗氧化酶活力的影响[J]. 安徽师范大学学报:自然科学版, 2008, 31(1):62-65. |
| [15] | 潘红春, 范杰, 王芳芳, 等. pH值对日本三角涡虫种群增长、无性生殖及6种酶活力的影响[J]. 水生生物学报, 2008, 32(3):339-344. |
| [16] | 刘长海, 刘世鹏, 张欢, 等. Fe3+肋迫对日本三角涡虫体内过氧化氢酶活性的影响[J]. 江苏农业科学, 2007(1):232-234. |
| [17] | 赵江沙, 曾兆, 熊渊, 等. Cu2+胁迫条件对涡虫体内过氧化氢酶活性的影响[J]. 氨基酸和生物资源, 20113, 25(3):44-45. |
| [18] | 潘红春, 王芳芳, 昊氢, 等. 短波紫外线对日本三角涡虫的损伤及六种酶活力的影响[J]. 激光生物学报, 2007, 16(5):563-568. |
| [19] | Li MH. Effect of nonionic and ionic surfaceants on surcival, oxodative stess, and cholinesterase acticity of planarian[J]. Chemosphere, 2008, 70(10);1796-1803. |
| [20] | Yuan ZQ, Zhao BS, Meng FL. Toxicity and beheavioral effectcs of anionic surfactant sodium decyl sulphate to planarian Dufesia japonica[J]. Fresenius Environmental Bulletin, 2011, 20(2a);506-510. |
| [21] | 张合彩, 孙丽群, 陈广文, 等. 淡水涡虫毒理学研究进展[J]. 生物学教学, 2012, 37(4):2-4. |
| [22] | Lau AH, Knakievica T, Prá D. Freshwater planarians as novel organisms for genotoxicity testing:analysis of chromosome aberrations[J]. Environmental and Molecular Mutagenesis, 2007, (06):475-482. |
| [23] | 孙立群. 离子液体对日本三角涡虫的毒性作用研究[C]. 河南:河南师范大学, 2012. |




