2.广东省微生物研究所 省部共建华南应用微生物国家重点实验室 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室,广州 510070;
3.中国科学院大学,北京 100049
2. Guangdong Institute of Microbiology,State Key Laboratory of Applied Microbiology Southern China,Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application,Guangzhou 510070;
3. University of Chinese Academy of Science,Beijing 100049
白假丝酵母,俗称白色念珠菌,在人类酵母菌感染中占重要地位[1]。多种形态的白假丝酵母是人体正常菌群的成员之一,通常存在于正常人口腔,上呼吸道,肠道及阴道,属于条件致病菌。在正常情况下不会致病,但在特殊的环境条件下,白假丝酵母能够引起皮肤表面感染甚至危及生命的系统性感染[2]。而随着医学的发展,尤其是进入抗生素时代,人类对抗念珠菌的能力大大提高。但是,长期依赖抗生素一方面可能会引起严重的系统性念珠病[3],另一方面,念珠菌渐增的耐药性也造成了医院病人真菌感染的高发生率[4]。传统治疗真菌的化学合成药物如洗必泰,咪唑衍生物易引起如肝中毒,腹泻,恶心等副作用而不能用于治疗孕妇及儿童[5]。现今,天然产物具有诸多化学合成药物的优点,例如,减少了对环境的污染,解决了难降解药物带给环境的污染,在合理用量内无副作用,适用人群较化学合成药物广,相对安全,且简单的熏蒸即可达到室内防霉抗菌功效,具有宜人的香味等,提取工艺比化学合成药物简单安全,成本低等。因此,关于寻找一些可能有效的天然产物来解决化学合成药物带来的负面效果是目前刻不容缓的工作[6]。
山苍子属于樟科,拉丁学名是Litsea cubebe(Lour.)Pers,多分布在中国南部,日本及东南亚等地区。其果实常作为香料用于食品,香精及香烟的加工,也是工业上生产柠檬醛,维他命A,E和K、紫罗酮、甲基紫罗酮及香水的原材料[7]。我国山苍子资源丰富,在世界香料市场占有重要地位。目前多数是从山苍子果实中提炼山苍子油,由于地理差异,不同地区的山苍子油成分有所差异,而不同的提取方法得到的的成分也有所差异[8]。山苍子可作为中药,用于治疗由着凉或者食物不洁等原因引起的腹泻及腹痛[9]。在农业上山苍子果实还可作为防腐剂、抗菌剂和杀虫剂[10]。一些研究证实了山苍子的生物活性,如抗氧化性[11],抗炎症反应[12]。国内学者提取山苍子不同部位的精油并对其成分分析及抗菌活性研究,证实了山苍子精油具有良好的抗菌活性[12]。其他的研究还表明山苍子油可以抑制一些对人类身体健康有严重危害的菌群,如副溶血性弧菌,李斯特菌和异常汉逊酵母菌等[13]。目前,尚未有关于山苍子油对白假丝酵母抗菌活性对详细报道,限制了精油的深入应用[14]。本实验利用水蒸馏法对山苍子果实进行精油提取,并选用白假丝酵母菌(Candida albicans)ATCC10231为实验菌株。主要对山苍子精油抗白假丝酵母进行抗菌活性及动力学研究,为开发山苍子精油作为潜在的预防及治疗真菌感染药物提供参考。
1 材料与方法 1.1 材料 1.1.1 实验材料白假丝酵母ATCC 10231为本研究室保藏。山苍子购自安徽省亳州市新源堂中药房。
1.1.2 培养基沙氏液体培养基(SDB,g/L):蛋白胨10,葡萄糖40,氯霉素0.1,pH为5.6±0.2;沙氏琼脂培养基(SDA,g/L):蛋白胨10,葡萄糖40,氯霉素0.1,pH为5.6±0.2琼脂2%。
1.1.3 主要仪器光学电子显微镜(Olympus BX53)、扫描电子显微镜(Hitachi H-3000N)、透射电子显微镜(Hitachi H-7650)、台式微量离心机(5415D,Eppendorf)、紫外分光光度计(Ultrospec 6300)、恒温培养箱(SHP-250)、水浴摇床(OLS 200)、TC-15套式恒温器(新华医疗器械厂)。
1.2 方法 1.2.1 山苍子精油提取实验选用简易水蒸馏法提取山苍子油,用搅碎机把山苍子果实充分搅碎,加双蒸水一起混合加入圆底蒸馏瓶中,加入几颗防爆沸玻璃珠,电加热套保持恒温120℃。收集山苍子油,用棕色瓶保管。
1.2.2 精油成分分析(GC/MS)采用美国Thermo Finnigan公司的Trace GC/DSQ气质联用分析仪。色谱柱为DB-5ms(长30 mm,直径0.25 mm,色谱填充粒子直径为0.25 mm)。条件设置:初始温度为60℃,保持2 min,然后以10℃/min的速度迅速升温至220℃,保持15 min载气为He,流速1.0 mL/min。程序升温进样模式(PTV)分流进样,分流比为1∶50。进样口温度从70℃升温至250℃。电离方式为EI,离子源温度为200℃,四级杆扫描范围30-450 m/z,传输温度250℃。所得样品图在NIST质谱库中进行比对。
1.2.3 琼脂稀释法将白假丝酵母菌接种到沙氏琼脂斜面上,置28℃恒温培养箱中培养2 d。再从斜面取一环接种到沙氏液体培养基中,培养8-10 h,用紫外分光光度计测得OD600数值达到1.0-1.8,即处于生长对数期。用已灭菌的PBS稀释至浓度为106 CFU/mL备用。分别向6瓶已备好的SDA培养基中加入不同体积的山苍子精油,使其终浓度分别为0 μL/mL(对照组),0.625 μL/mL,1.25 μL/mL,2.5 μL/mL,5 μL/mL和10 μL/mL。充分混匀后倒平板,每个浓度分别做3个平行。待平板凝固后,每个平板分别加100 mL配好的酵母菌液并涂布均匀。最后用封口膜将平板边缘包裹住,于恒温培养箱28℃培养14 d,观察并记录生长结果。
1.2.4 白假丝酵母生长动力学研究准备5瓶已灭菌的SDB培养基,分别加入不同体积的山苍子油,使其终浓度分别为0 μL/mL(对照组),0.625 μL/mL,1.25 μL/mL,2.5 μL/mL和5 μL/mL。然后分别加入一定体积的酵母菌液,使其起始浓度均为106 CFU/mL。置于28℃水浴摇床中培养7 d,转速为100 r/min。每天定时取样测OD600。
1.2.5 扫描电镜观察白假丝酵母准备3瓶已灭菌的SDB培养基,加入对数期的酵母菌液使初始菌液浓度均为106 CFU/mL。然后分别加入不同体积的山苍子精油,使其浓度分别为0 μL/mL,1.25 μL/mL和5 μL/mL。继续培养5 h后,12 000 r/min离心3 min,用PBS洗去培养基。然后按如下步骤处理:(1)3%戊二醛固定5 h以上;(2)PBS浸泡洗涤6次,每次20 min;(3)30%乙醇脱水2次,每次10 min;(4)50%乙醇脱水2次,每次10 min;(5)70%乙醇脱水1次,每次15 min,4℃过夜放置(乙醇不需倒掉);(6)90%乙醇脱水1次,每次15 min;(7)95%乙醇脱水1次,每次15 min;(8)无水丙酮或者无水乙醇(加无水CaCl2)3次,每次15 min;(9)叔丁醇置换2次,每次20 min;(10)冷冻干燥;(11)样品贴台,溅射喷金,样品制作完成。上述溶液都需4℃放置。
1.2.6 透射电镜观察白假丝酵母准备3瓶已灭菌的SDB培养基,加入相同体积的酵母菌液,初始菌液浓度均了106 CFU/mL。28℃水浴摇床100 r/min培养8-10 h,分别加入不同体积的山苍子,山苍子精油浓度分别为0 μL/mL,1.25 μL/mL和5 μL/mL。处理5 h后,12 000 r/min离心3 min,用PBS洗去培养基。戊二醛固定后,经石蜡包埋制成切片,透射电镜观察精油对酵母细胞超微结构的影响。
2 结果 2.1 精油成分分析本实验采用水蒸气蒸馏提取得到的山苍子油经气质联用仪器分析,共得到24种化合物(表 1)。精油主要成分有柠檬烯,柠檬醛,马鞭烯醇,占总成分的50.29%。根据沸点不同可分离到不同馏分,一般来说,低沸点(≤70℃)馏分可分离出α-蒎烯、b-蒎烯等萜烯化合物,中沸点(105℃)馏分主要分离柠檬醛。本实验山苍子油中柠檬醛和α-蒎烯的含量分别为11.94%和1.71%。分离到的烯类及醇类化合物含量分别占了45.08%和21.36%。这些物质可能对柠檬醛的抗菌活性具有协同作用。
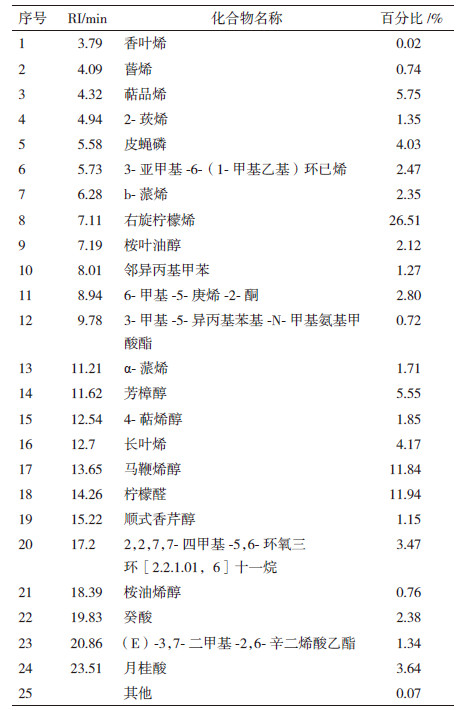
采用琼脂平板稀释法测定山苍子油对白假丝酵母的最低抑菌浓度(MIC)及最低杀菌浓度(MFC),如图 1所示。为28℃培养14 d后,对照组在第1天已经有明显的白假丝酵母生长(图 1-图 1A),低浓度精油(0.313 μL/mL)处理后,可以明显看出酵母菌的生长数量的减少(图 1-B,C)。而浓度增加到 1.25 μL/mL(图 1-D)时,培养14 d后没有任何菌落出现,故山苍子油对白假丝酵母菌的最低抑菌浓度和最低杀菌浓度均为1.25 μL/mL。而高浓度处理(2.5 μL/mL和5.0 μL/mL)连续培养30 d没有任何菌落的出现。
 |
| A-F :山苍子精油浓度从分别为:0、0.3125、0.625、1.25、2.5 及5.0 μL/mL 图 1 琼脂平板稀释法测定山苍子对白假丝酵母抗真菌活性 |
山苍子油抗白假丝酵母动力学研究,结果如图 2所示,对照组由于没有精油的影响,接种后迅速进入对数期,并于24 h后进入稳定期。而精油处理后的实验组都有不同程度的生长延滞现象,精油浓度为0.3125 μL/mL的实验组在培养60 h后OD600开始有上升。在0.625 μL/mL的处理中,白假丝酵母的抑制时间延长到148 h,随后开始逐渐生长。当精油浓度到达1.25 μL/mL 和2.5 μL/mL时,由于精油浓度过高,白假丝酵母被严重抑制并死亡,且加速了细胞的裂解,试管浑浊度降低,OD600值有下降趋势。且从试管中取样涂在SDA平板上28℃培养2 d没有任何菌落出现。白假丝酵母生长具有精油剂量依赖性现象,低浓度精油抑制其生长,但并不能完全杀死白假丝酵母,在生长曲线上表现为适应期较对照组明显延长。
 |
| 图 2 山苍子油抗白假丝生长动力学曲线 |
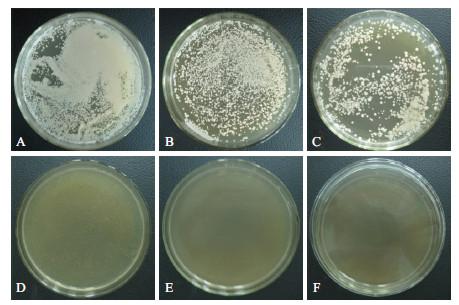
扫描和透射电镜结果如图 3所示,对照组(图 3-A,图 3-D)酵母细胞大小均一,表面光滑,细胞内部比较均质,细胞壁及细胞膜比较完整。加入1.25 μL/mL山苍子油处理6 h后,细胞表面开始出现不同程度的变形,正在进行出芽生殖的细胞受到严重破坏(图 3-B),TEM进一步观察显示细胞内部某些细胞器受到破坏,细胞膜有内陷的趋势(图 3-E,图 3-F)。高浓度山苍子油(5.0 μL/mL)处理后,细胞严重破坏,整个细胞几乎完全变形直接导致细胞死亡。透射电镜图可以明显看到细胞质壁分离,细胞壁边缘模糊,部分细胞膜已经溶解,内部细胞器出现不同程度的破坏变形(图 3-F)。
 |
| A,D :山苍子精油浓度为0 μL/mL ;B,E :山苍子精油浓度为1.25 μL/mL : C,F :山苍子精油浓度为5.0 μL/mL 图 3 不同浓度精油处理白假丝酵母SEM 和TEM 图 |
精油的提取方法多种多样,而提取部位也有不同选择,这就导致了同一方法或者同一植物提取的成分不尽相同[15]。研究报道山苍子精油的抗菌组分主要是柠檬醛[16],α-蒎烯[17]等。实验提取的山苍子油中柠檬醛含量只占11.94%,而分离到的烯类及醇类化合物含量分别为45.08%和21.36%,总体比柠檬醛高出很多。初步抗菌活性实验发现其对白假丝酵母有较好的抗性,相关报道指出精油的抗菌活性与其化学组成密切,而多数精油的主成分决定了其生物活性[18, 19]。本实验室利用用商业化成品山苍子油对大肠杆菌进行实验发现,其对细菌有中等抗菌功效[20, 21],但商品化山苍子油与实验室自提山苍子油在成分及含量上有一定的区别。目前,很少有相关文献报道自提精油和商品化精油在抑菌活性之间的差异,因为提取方法和提取工艺的差别都会导致其提取到成分的不同,而且果实的采摘时间、产地、季节等也会影响最终精油的成分及含量,且其提取后存储条件及时间等也会影响其抑菌效果的好坏,国内目前尚无统一的标准。但总体上说,山苍子油精油具有抗菌活性是不容置疑的。而其表现出的生物活性可能是基于其多种化学成分的协同
作用[22, 23]。
利用琼脂平板法得到的山苍子油对白假丝酵母的最低抑菌浓度和最低杀菌浓度与抗菌动力学实验具有一致性,在精油浓度达到1.25 μL/mL时,对白假丝酵母菌的抑制达到临界点,低于此浓度时,白假丝酵母的生长有明显的精油剂量依赖性,精油浓度越大,抑制其生长的时间越长,但延长了其生长适应期,并不能完全杀死酵母菌;高于此浓度时,山苍子油对白假丝酵母的破坏具有明显的致命性。SEM和TEM能充分的表明此变化。且SEM白假丝酵母在芽痕处破坏比较严重(图 3-B),这种现象可能是因为酵母细胞在芽痕处比较敏感,从而使精油容易渗入造成破坏[24, 25]。高浓度的精油处理后6 h后,SEM表现出细胞的完全变形(图 3-C),TEM显示白假丝酵母的细胞壁,细胞膜均遭受不同程度的破坏,整个细胞内部稳态已经被严重破坏,细胞无法存活(图 3-F)。一般来说,影响细胞壁合成的药物往往能引起细胞形态明显的变化[26],而细胞壁膜的破坏使细胞内大分子泄漏导致细胞死亡[27, 28]。
综上所述,本文着重讨论了山苍子油对白假丝酵母的抗菌活性,其可能的抗菌机制不仅能破坏细胞壁和细胞膜,同时导致其细胞内部大分子泄漏,使白假丝酵母无法进行出芽生殖而被彻底杀死细胞。
4 结论本研究提取到的山苍子油经GC/MS分析得到主成分柠檬醛、柠檬烯和马鞭烯醇,占总成分的50.29%。经琼脂平板稀释法测定的MIC和MFC均为1.25 μL/mL,生长动力学研究表明白假丝酵母对山苍子有具有明显的剂量依赖性。利用SEM发现山苍子易破坏正在出芽的细胞,而利用TEM发现山苍子油通过破坏细胞壁和细胞质膜,然后渗入细胞内,最终导致细胞裂解死亡。
| [1] | Pozzatti P, Loreto ES, Mario DAN, et al. Activities of essential oils in the inhibition of Candida albicans and Candida dubliniensis germ tube formation[J]. J Mycol Med, 2010, 20(3):185-189. |
| [2] | Mayer FL, Wilson D, Hube B. Candida albicans pathogenicity mechanisms[J]. Virulence, 2013, 4(2):119. |
| [3] | Winner HE, Hurrey R. Candida albicans[M]. 104, Gloucester Place, London W. 1. J. & A. Churchill Ltd, 1964. |
| [4] | Grewe M, Tsiotos GG, Luque de-LE, et al. Fungal infection in acute necrotizing pancreatitis[J]. Journal of the American College of Surgeons, 1999, 188(4):408-414. |
| [5] | Curtis C. Use and abuse of topical dermatological therapy in dogs and cats Part 1. Shampoo therapy[J]. In Practice, 1998, 20(5):244-251. |
| [6] | Baker JH, Goodpasture HC, Kuhns Jr HR, et al. Fungemia caused by an amphotericin B-resistant isolate of Sporothrix schenckii. successful treatment with itraconazole[J]. Archives of Pathology & Laboratory Medicine, 1989, 113(11):1279-1281. |
| [7] | Luo M, Jiang LK, Zou GL. Acute and genetic toxicity of essential oil extracted from Litsea cubeba(Lour. )Pers[J]. Journal of Food Protection, 2005, 68(3):581-588. |
| [8] | 罗曼, 蒋立科. 安徽黄山山苍子香精油成分GC-MS分析[J]. 作物研究, 2006(3):256-258. |
| [9] | 杜木英, 杨钦滟, 吴均, 等. 山鸡椒油在低糖橙皮胡萝卜果酱中的抑菌和抗氧化作用[J]. 食品科学, 2013(10):39-43. |
| [10] | 顾仁勇, 刘莹莹. 山苍子精油抑菌及抗氧化作用的研究[J]. 食品科学, 2006, 27(11):86-89. |
| [11] | Hwang JK, Choi EM, Lee JH. Antioxidant activity of Litsea cubeba[J]. Fitoterapia, 2005, 76(7):684-686. |
| [12] | Wang HW, Liu YQ. Chemical composition and antibacterial activity of essential oils from different parts of Litsea cubeba[J]. Chemistry & Biodiversity, 2010, 7(1):229-235. |
| [13] | Liu TT, Yang TS. Antimicrobial impact of the components of essential oil of Litsea cubeba from Taiwan and antimicrobial activity of the oil in food systems[J]. International Journal of Food Microbiology, 2012, 156(1):68-75. |
| [14] | 王广要, 周虎, 曾晓峰. 植物精油应用研究进展[J]. 食品科技, 2006, 5(3):11-13. |
| [15] | Yang Y, Jiang JZ, Qimei LB, et al. The fungicidal terpenoids and essential oil from Litsea cubeba in Tibet[J]. Molecules, 2010, 15(10):7075-7082. |
| [16] | 罗曼, 蒋立科, 王志强, 等. 山苍籽油及主要成份抗菌机制研究进展[J]. 微生物学通报, 2003(3):74-77. |
| [17] | Pinto E, Hrimpeng K, Lopes G, et al. Antifungal activity of Ferulago capillaris essential oil against Candida, Cryptococcus, Aspergillus and dermatophyte species[J]. Eur J Clin Microbiol, 2013, 32 (10):1311-1320. |
| [18] | Bakkali F, Averbeck S, Averbeck D, et al. Biological effects of essential oils-a review[J]. Food and Chemical Toxicology, 2008, 46(2):446-475. |
| [19] | Susanti D, Awang NA, Qaralleh H, et al. Antimicrobial activity and chemical composition of essential oil of Malaysian Etlingera elatior(Jack)RM smith flowers[J]. J Essent Oil Bear Pl, 2013, 16(2):294-299. |
| [20] | Li WR, Shi QS, Liang Q, et al. Antibacterial Activity and Kinetics of Litsea cubeba Oil on Escherichia coli[J]. PloS One, 2014, 9 (11):e110983. |
| [21] | 李文茹, 施庆珊, 莫翠云, 等. 几种典型植物精油的化学成分与抗菌活性[J]. 微生物学通报, 2013, 40(11):2128-2137. |
| [22] | Burt S. Essential oils:their antibacterial properties and potential applications in foods—a review[J]. International Journal of Food Microbiology, 2004, 94(3):223-253. |
| [23] | Khan IA, Abourashed EA. Leung’s encyclopedia of common natural ingredients:used in food, drugs and cosmetics[M]. John Wiley & Sons, 2011. |
| [24] | Bruni R, Medici A, Andreotti E, et al. Chemical composition and biological activities of Ishpingo essential oil, a traditional Ecuado-rian spice from Ocotea quixos(Lam. )Kosterm. (Lauraceae)flower calices[J]. Food Chemistry, 2004, 85(3):415-421. |
| [25] | Sacchetti G, Maietti S, Muzzoli M, et al. Comparative evaluation of 11 essential oils of different origin as functional antioxidants, antiradicals and antimicrobials in foods[J]. Food Chemistry, 2005, 91(4):621-632. |
| [26] | Frost DJ, Brandt KD, Cugier D, et al. A whole-cell Candida albicans assay for the detection of inhibitors towards fungal cell wall synthesis and assembly[J]. The Journal of Antibiotics, 1995, 48(4):306-310. |
| [27] | Lambert RJW, Skandamis PN, Coote PJ, et al. A study of the minimum inhibitory concentration and mode of action of oregano essential oil, thymol and carvacrol[J]. Journal of Applied Microbiology, 2001, 91(3):453-462. |
| [28] | Oussalah M, Caillet S, Lacroix M. Mechanism of action of Spanish oregano, Chinese cinnamon, and savory essential oils against cell membranes and walls of Escherichia coli O157:H7 and Listeria monocytogenes[J]. Journal of Food Protection, 2006, 69(5):1046-1055. |