二十二碳六烯酸(DHA,C22∶6)是一种n-3多不饱和脂肪酸。不仅对视力和神经的发育具有促进作用,而且在降低心血管疾病、高血压、关节炎和动脉硬化的发生等方面具有重要作用[1, 2, 3, 4]。我国卫生部于 2010 年 3 月批准 ARA-SCO 和 DHA-SCO 为新资源食品,并允许其在符合相关要求的条件下添加到婴幼儿配方食品中[5]。由此可见,DHA供应蕴藏着巨大的商机。裂殖壶菌Schizochytrium 是一类低等的海洋真菌,具有培养简单、生长速度快,脂肪酸组成简单易纯化等特点,是发酵生产DHA 的理想菌种[6]。
在生产过程中,只有DHA含量和菌体浓度都高时,才能得到较高的DHA生产效率。然而,在同一环境中高菌体浓度与高DHA含量不能同时实现[7]。因此,筛选一株在在同一环境中高菌体浓度与高DHA含量能够同时满足的菌株,可以提高DHA生产效率的同时又可以简化生产工艺。目前,紫外诱变方法仍然是菌体诱变的主要处理方式,然而ARTP等高新诱变技术凭借简单易用、安全高效的优点得到了广泛应用[8]。对于DHA等多不饱和脂肪酸高产菌株诱变筛选,研究主要集中在促进油脂代谢前提物质(乙酰-CoA和NADPH)的合成和抑制油脂的竞争性途径[9]。而在裂殖壶菌中,DHA与DPA的合成途径并不一致[10],这导致筛选得到的突变株油脂含量得到增加,而DHA在油脂中的含量提高并不理想。本研究采用ARTP技术对裂殖壶菌诱变处理,使筛选得到的菌株在菌体与油脂保持高产同时DHA在油脂中的含量也得到提高,从而得到性能优异的DHA高产菌株。
不饱和脂肪酸在逆境胁迫中具有重要作用。Watanabe等[11]通过将热带橡胶树(Hevea brasiliensis)的Δ12脱饱和酶基因在Saccharomyces cerevisiae 菌株中表达时发现这些多不饱和脂肪酸能够增加转基因菌株对氧化胁迫的抗性。Allakhvediev等[12]将 Synechocystis的 Δ12脱饱和酶基因desA转入只能合成单不饱和脂肪酸的野生菌株 Synechococcus sp. PCC7942,转化菌株将总脂肪酸的一半转化成为双不饱和脂肪酸,这种转化能提高氧参与的装置对盐胁迫的抗性。Hidetosh等[13]研究认为DHA和EPA作为一种生物机体内抗氧化剂,能够避免ROS引起的过氧化作用。因此通过诱变筛选出抗ROS较强的菌株可能具有较高的DHA生产能力。
有鉴于此,本研究通过含有100%致死率浓度的ROS诱导剂2,2’-联吡啶的平板培养ARTP处理的菌体,旨在通过外加氧化胁迫淘汰抗氧化能力较低的菌株以期筛选得到抗氧化性较高的菌株,并利用磷酸香草醛油脂检测方法和气相色谱分析,以期得到高DHA生产能力的菌株。
1 材料与方法 1.1 材料 1.1.1 菌株本实验采用裂殖壶菌菌株Schizochytrium sp.ATCC 20888。
1.1.2 培养基发酵培养基:葡萄糖120 g/L,胰蛋白胨6 g/L,谷氨酸钠 15 g/L,海水晶17.5 g/L,硫酸镁 7.5 g/L,硫酸钠12.8 g/L,磷酸二氢钾 2.5 g/L,氯化钾 2.6 g/L,氯化钙 0.4 g/L。
ATCC By+790固体培养基:葡萄糖 5 g/L,酵母膏 1 g/L,胰蛋白胨 1 g/L,海水晶 17.5 g/L,琼脂 20 g/L,pH 7.0。
1.2 方法 1.2.1 裂殖壶菌高产DHA突变菌株的制备 1.2.1.1 制备菌悬液将裂殖壶菌接种于装有50 mL基本培养基的三角瓶中中,28℃,200 r/min条件下培养2 d。取1 mL培养液离心,用生理盐水将菌体悬浮OD540值为 0.6-0.7。
1.2.1.2 ARTP处理预实验取10 μL的单细胞菌悬液,均匀涂布在金属载片的上表面,干燥后用镊子将菌物载片转移至载物台。采用高纯氦气作为等离子体的工作气体,设置电源功率80 W,照射距离 2 mm,等离子体的温度<35℃,气流量 10 L/min,处理菌物载片,照射时间为 0(对照)、5、10、15、20、25、30、35 s。处理后将载片转移到EP 管中,震荡洗脱形成新的菌悬液,涂布平板后置于 30℃培养箱内培养。培养3 d后对平板菌落进行计数,计算致死率:
致死率%=(未经诱变处理菌落数-经诱变处理菌落数)/未经诱变菌落数×100%,每个处理组3个平行样。
1.2.1.3 2,2’-联吡啶平板筛选预实验将100 μL菌悬液涂布在含有2,2’-联吡啶的固体培养基平皿上,固体培养基中2,2’-联吡啶浓度分别为0(对照)、10、20、30、40、50、60、70、80、90、100和110 μmol/L,于30℃条件下培养4 d,统计菌落数,并计算致死率:
致死率%=(无联吡啶平板上的菌落数-添加联吡啶平板上的菌落数)/无联吡啶平板上的菌落数×100%,每个处理组3个平行样。
1.2.1.4 ARTP诱变及突变菌株的筛选筛选分离采用致死率在80%的照射时间和100% 2,2’-联吡啶致死浓度,进行诱变处理和筛选。具体处理方式为:将10 μL菌悬液涂布在金属载体上,置于ARTP诱变系统托盘上,电源功率100 W,气流量 10 L/min,处理时间15 s。样品处理完毕后,用无菌镊子将载片放至装有1 mL 生理盐水的 EP 管中。在振荡器上震荡1 min,把附着在菌物载片上的微生物洗脱到液体中,形成新的菌悬液。对新的菌悬液进行适当稀释,取 100 μL稀释液涂布到含有100 μmol/L 2,2’-联吡啶浓度的平板培养,取样过程中请注意震荡菌液以保持均匀。将在平板上生长快速的突变菌株划到到斜面上保存。
将上述诱变所得突变菌株接种到装有100 mL培养基的摇瓶中培养。培养条件28℃,200 r/min,培养5 d。检测其生物量、油脂和DHA产量。
1.2.1.5 突变菌株的遗传稳定性突变菌株的遗传稳定性通过连续5次斜面传代和三角烧瓶培养来评价。将突变菌株接种到含有ATCC 790 By+培养基的斜面上,每4 d传代一次。与此同时,将菌株接种到装有发酵培养基的三角摇瓶中,28℃,200 r/min培养 5 d。检测每一传代培养的DHA生产能力。
1.2.2 分析方法 1.2.2.1 生物量的测定将培养5 d的50 mL培养物8 000 r/min离心15 min,用双蒸馏水冲洗后再次离心,冷冻干燥后称其干重。生物量=干重(g)/ 0.05(L)。
1.2.2.2 油脂的测定油脂的检测采用磷酸香草醛快速检测油脂的方法[14]。
1.2.2.3 脂肪酸甲酯的气相色谱分析总脂的提取采用正己烷方法[15],将总脂转移到玻璃瓶中,加入0.5 mol/L的NaOH甲醇溶液 2 mL,充 N2后密封于 65℃ 反应1 h。冷却后加入 25% 三氟化硼甲醇溶液 2 mL,65℃酯化 20 min,脂肪酸甲酯用正己烷抽提后用气相色谱仪(岛津Shimadzu 2010)进行气相色谱分析。氮气为载气,起始柱温为130℃,2 min后以10℃/min的速度升至180℃,以4℃/min的速度升至240℃保持10 min。进样口温度为250℃,检测器温度为250℃。采用不分流进样,进样量为1 μL。通过与标准品的保留时间对照,对各脂肪酸定性;用C19∶0作内标,通过比对出峰面积对各脂肪酸进行定量。脂肪酸标准品购自Sigma公司。
2 结果 2.1 ARTP处理时间的确定ARTP照射时间不同,菌体的突变率也不同。采用不同的ARTP照射时间,并对菌体致死率进行分析。结果见图 1。当ARTP照射时间与致死率之间存在明显的剂量效应关系。在0-15 s内,随着照射处理时间的延长,菌体的死亡率快速上升。15 s以后随照射时间延长,致死率缓慢上升。当照射处理时间为30 s时,死亡率达到100%。当照射处理时间为15 s时,致死率为80%。因此,选择ARTP照射时间为15 s进行诱变。为了能够同时得到较高的正突变率和较大的突变幅度。最终选择15 s为诱变的辐照时间,即致死率为80%左右的诱变剂量。
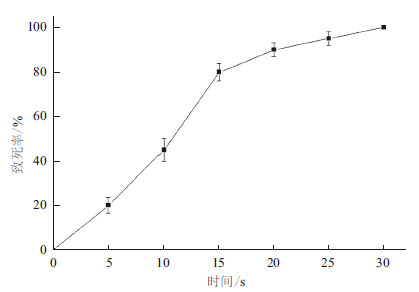 |
| 图 1 ARTP 照射时间裂殖壶菌的致死效应 |
实验以2,2’-联吡啶浓度(μmol/L)为变量,测定致死率,结果见图 2,致死率和2,2’-联吡啶浓度之间有明显的剂量效应关系。菌体的死亡率随着2,2’-联吡啶浓度的提高而不断升高,两者有明显的线性关系;在2,2’-联吡啶浓度达到100 μmol时,菌体的致死率达到100%。为了筛选出的菌株具有比原始菌株更强的抗ROS能力,本研究选用2,2’-联吡啶的浓度为100 μmol/L,即致死率刚刚达到100%的2,2’-联吡啶浓度作为诱变选育的2,2’-联吡啶筛选浓度。
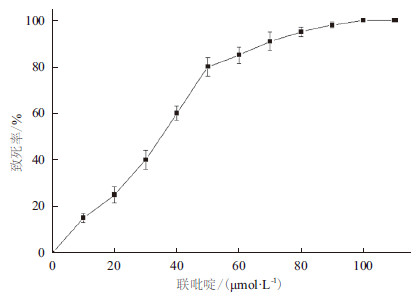 |
| 图 2 2,2’- 联吡啶浓度对裂殖壶菌的致死效应 |
对ARTP诱变筛选出的裂殖壶菌菌株继续进行多轮ARTP诱变,在自主建立的高通量初筛的基础上,进一步筛选出高产DHA裂殖壶菌优良菌株,并对获得产量较高的菌株进行发酵,检测其对应的生物量、油脂量、DHA含量,部分结果如表 1所示,DHA产量D32最高为7.31 g/L,较对照提高29.8%。
ARTP诱变所得菌株D32与原始菌株Schizochy-trium ATCC 20888在油脂脂肪酸组成方面具有明显的差异性。如表 2所示,裂殖壶菌油脂中饱和脂肪酸含量明显降低(P < 0.005),而不饱和脂肪酸含量明显增加(P < 0.005),如C14∶0和C16∶0含量分别由ATCC 20888中的13.72%和24.12%降到了D32的1.77%和13.50%,EPA和DHA含量则由ATCC 20888中的1.18%和36.38%提高到了D32的5.84%和50.03%。
对菌株D32连续传代培养,以4℃冰箱保存5 d 生长良好的第一代菌株为对照,结果其第 1、2、3、4 和 5 代的DHA含量47%-51.3%与产量7.25-7.58 g/L,并没有发生明显变化,表明菌株D32传4代对发酵水平无明显影响,说明菌株D32 遗传稳定性较好。
3 讨论常压室温等离子体(ARTP)诱变系统具有温度低、活性粒子浓度高、设备简单、操作简易、运行成本低廉、且对环境无污染和危害等特点,使其在微生物突变育种及生物医学领域中已经引起人们广泛关注[16]。ARTP富含的活性能量粒子对菌株/植株/细胞等的遗传物质造成损伤,并诱发生物细胞启动SOS修复机制。SOS修复过程为一种高容错率修复,在修复过程中会产生种类丰富的错配位点,并最终稳定遗传进而形成突变株[17]。因此ARTP可以作为一种快速简便的方法应用到裂殖壶菌育种。
研究表明微生物体中DHA含量高的菌株具有较高的抗氧化胁迫能力[13]。高产DHA菌株具有较高的抗氧化能力,能够清除菌体生长过程中产生的ROS,为DHA合成提供了有利条件;而DHA在细胞中形成稳定的结构,进一步提高了细胞对ROS等不良生长因素的抗性。一种ROS的预处理使机体不仅耐受了这种特定的ROS,还能全面的耐受其他多种ROS,于是全面提高各种抗氧化酶活性[18]。2,2’-联吡啶可在氧化还原反应中作为电子受体,在细胞内经呼吸链电子传递可产生氧自由基。而氧自由基的存在正好诱导了Mn-SOD的大量生成,从而使ROS毒性具有抵御功能[19]。但SOD对活性氧的清除能力是有限的,超过这个限度就会对机体产生伤害。通过筛选耐高浓度的2,2’-联吡啶的裂殖壶菌菌株,可能合成较高的DHA生产性能。本实验采用ARTP诱变和2,2’-联吡啶的定向选育方式,确定最佳条件:电功率100 W,气量10 L/min,照射时间15 s,2,2’-联吡啶浓度为100 μmol/L。建立起一套完整选育裂殖壶菌优良品种的方法,并根据菌株生物量和DHA产量为指标进行复筛,筛选得到DHA产量都比初始菌株提高的菌株,其中D32 DHA产量为7.31 g/L,较对照提高29.8%。
4 结论以Schizochytrium sp. ATCC 20888为出发菌株,经ARTP处理后,涂布到2,2’-联吡啶平上板培养,将所得的突变菌株摇瓶发酵培养,通过磷酸香草醛油脂快速检测法和气相色谱分析从突变菌株中筛选得到DHA高产菌株。实验证明本方法得到的高产DHA突变菌株与出发菌株相比,主要的饱和脂肪酸C14∶0和C16∶0含量明显下降,而不饱和脂肪酸含量增加。
| [1] | Horrocks LA, Yeo YK. Health benefits of docosahexaenoic acid(DHA)[J]. Pharmacological Research, 1999, 40(3):211-225. |
| [2] | 温雪馨, 李建平, 侯文伟, 等. 微藻 DHA 的营养保健功能及在食品工业中的应用[J]. 食品科学, 2010, 31(21):446-450. |
| [3] | Shaikh IAA, Brown I, Schofield AC, et al. Docosahexaenoic acid enhances the efficacy of docetaxel in prostate cancer cells by modulation of apoptosis:The role of genes associated with the NF‐κB pathway[J]. The Prostate, 2008, 68(15):1635-1646. |
| [4] | 朱丽娜, 张志国, 张敏, 等. DHA 的生理功能及其在食品中的稳定性[J]. 中国乳品工业, 2009, 37(2):45-48. |
| [5] | 中华人民共和国卫生部. 关于批准 DHA 藻油、棉子低聚糖等7种物品为新资源食品及其他相关规定的公告(2010 年第 3 号)[S]2010. |
| [6] | 魏萍, 马小琛, 任路静, 等. 裂殖壶菌发酵生产 DHA 研究进展[J]. 食品工业科技, 2010(10):398-401. |
| [7] | Jakobsen AN, Aasen IM, Josefsen K D, et al. Accumulation of docosahexaenoic acid-rich lipid in thraustochytrid Aurantiochytrium sp. strain T66:effects of N and P starvation and O2 limitation[J]. Applied Microbiology and Biotechnology, 2008, 80(2):297-306. |
| [8] | Zong H, Zhan Y, Li X, et al. A new mutation breeding method for Streptomyces albulus by an atmospheric and room temperature plasma[J]. Afr J Microbiol Res, 2012, 6(13):3154-3158. |
| [9] | 许石雄. 二十二碳六烯酸高产菌株的选育与发酵工艺研究[D]. 无锡:江南大学, 2013. |
| [10] | Metz JG, Roessler P, Facciotti D, et al. Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J]. Science, 2001, 293(5528):290-293. |
| [11] | Watanabe K, Oura T, Sakai H, et al. Yeast Δ12 fatty acid desatur-ase:gene cloning, expression, and function[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(3):721-727. |
| [12] | Allakhverdiev S I, Kinoshita M, Inaba M, et al. Unsaturated fatty acids in membrane lipids protect the photosynthetic machinery against salt-induced damage in Synechococcus[J]. Plant Physiology, 2001, 125(4):1842-1853. |
| [13] | Okuyama H, Orikasa Y, Nishida T. Significance of antioxidative functions of eicosapentaenoic and docosahexaenoic acids in marine microorganisms[J]. Applied and Environmental Microbiology, 2008, 74(3):570-574. |
| [14] | 李仁民, 王菊芳, 马爽, 等. 利用脂肪酸合成酶抑制剂和磷酸香草醛反应筛选高产油脂酵母菌[J]. 微生物学通报, 2008, 35(4):545-549. |
| [15] | 王申强. 裂殖壶菌产 DHA 的发酵工艺研究及高产菌株选育[D]. 无锡:江南大学, 2013. |
| [16] | 王立言. 常压室温等离子体对微生物的作用机理及其应用基础研究[D]. 北京:清华大学, 2010. |
| [17] | Oda Y, Nakamura S, Oki I, et al. Evaluation of the new system(umu-test)for the detection of environmental mutagens and carcinogens[J]. Mutation Research/Environmental Mutagenesis and Related Subjects, 1985, 147(5):219-229. |
| [18] | 郑荣梁, 黄中洋. 自由基生物学[M]. 第3版. 北京:高等教育出版社, 2007. |
| [19] | Hassan HM, Schrum LW. Roles of manganese and iron in the regulation of the biosynthesis of manganese-superoxide dismutase in Escherichia coli[J]. FEMS Microbiology Reviews, 1994, 14(4):315-323. |







