中国是世界第一渔业大国,2013年全国水产养殖面积达808.84万hm2,其中,淡水鱼养殖面积为590.75万hm2,而且还呈逐年递增趋势[1,2]。然而,随着集约化水产养殖的迅速发展,池塘老化、放养密度过高以及投饲残饵过多等诸多因素引起了养殖水体中亚硝酸盐逐年升高,这会引起水生动物血红蛋白氧化为高铁血红蛋白,氯离子从骨骼肌和红细胞中流失,同时扰乱细胞内外钾离子水平,影响生物体内氧气运输,导致水生生物组织中氧含量不足、心跳加快、呼吸急促等多种生理紊乱现象[3,4]。基于上述亚硝酸盐危害,有研究认为养殖水体中亚硝酸盐氮浓度不宜超过0.2 mg/L,为确保鱼、虾、蟹等水生动物的安全,一般将亚硝酸盐氮含量控制在0.1 mg/L以内,但实际养殖水体中,虾蟹池亚硝酸盐氮含量通常都超过0.3 mg/L[5],有的高达50 mg/L甚至更高[6],严重阻碍水产养殖的增长和发展[7]。因此,减少或去除水产养殖水体中的亚硝酸盐已成为一个急迫问题。目前去除水体亚硝酸盐方法包括物理、化学和生物方法,其中物理和化学法均存在二次污染风险;生物处理法因其高效低耗、无二次污染以及经济安全等优点[8,9,10]而成为养殖水体亚硝酸盐去除的首选。生物除氮包括硝化作用除氮和反硝化作用除氮,其中反硝化除氮被认为是最有效的除氮方式,但反硝化除氮会受很多因素限制,已有研究表明温度、溶解氧、pH、接种量、碳源等均会影响反硝化细菌的脱氮能力[13,14,15,16]。而低温是抑制反硝化除氮的关键因素之一,当温度低于20℃,细菌的硝化和反硝化性能将会急剧下降,当温度低于15℃时,硝化和反硝化性能会变得很微弱,当温度低于10℃时,将会强烈抑制硝化作用和反硝化作用[17,18,19]。本研究从长期淹水的冬水田中分离获得一株耐冷亚硝酸盐型反硝化细菌,采用形态观察,特异性磷脂脂肪酸检测和系统进化分析对其鉴定,在此基础上,考察不同培养条件对该菌脱氮能力的影响,旨在为耐冷亚硝酸盐好氧反硝化细菌的实际应用提供参考。
1 材料与方法 1.1 材料 1.1.1 菌株来源新分离菌株Y-9(本实验室分离筛选获得)。
1.1.2 培养基以下培养基均按照参考文献配制。
BTB酸碱指示剂培养基(bromothymol blue,BTB):NaNO2 1 g/L,KH2PO4 1 g/L,FeCl2·6H2O 0.5 g/L,CaCl.7H2O 0.2 g/L,MgSO4 .7H2O 1 g/L,琥珀酸钠8.5 g/L,琼脂20 g/L,BTB(1.5%溴百里酚蓝溶于无水乙醇)1 mL,调pH至7.2[20]。
反硝化培养基[21]:乙酸钠4.72 g/L,NaNO2 0.075 g/L,KH2PO4 1.5 g/L,Na2HPO4 0.42 g/L,MgSO4·7H2O 0.1 g/L,调pH至7.2。
LB 培养基:胰蛋白胨 10 g/L,酵母粉 5 g/L,NaCl 10 g/L,(固体加2.0%的琼脂),调 pH至7.2。以上所有培养基均在0.11 MPa、121℃下灭菌30 min,冷却后备用。
1.2 方法 1.2.1 细菌鉴定 1.2.1.1 形态学观察将纯化的菌株划线于BTB培养基上,15℃培养48 h后观察菌落形态,采用革兰氏染色和电镜扫描观察细菌形态。
1.2.1.2 特异性磷脂脂肪酸鉴定取约40 mg纯菌,进行皂化、甲基化、萃取以及碱洗涤后获得上机样品,用Agilent 6850气相色谱仪(FID检测器)分析特异性磷脂脂肪酸(Phospholipid fatty acid,PLFA)的成分。色谱条件为:(25.0 m×200 μm×0.33 μm),进样量1 μL,分流比10∶1,载气(H2),尾吹气高纯N2,助燃气空气,流速0.8 mL/min。二阶程序升高柱温:170℃起始,5℃/min升至260℃,而后40℃/min升温至310℃,维持1.5 min。各成分脂肪酸通过MIDI Sherlock微生物鉴定系统(Version 6.1,MIDI,Inc.,Newark,DE)进行检测,标准品购买于美国MIDI公司,PLFA用C19∶0作内标换算PLFA的绝对含量。
1.2.1.3 菌株16S rRNA基因序列检测以纯化细菌的基因组为模板,采用通用引物27F(5'-AGAGTT-TGATCCTGGCTCAG-3')和 1492R(5'- GGTTACCT-TGTTACGACTT-3')进行16S rRNA聚合酶链式反应(PCR)扩增。扩增体系(50 μL):模板2 μL,27 F和1492 R各2 μL,2×Taq PCR Master Mix 25 μL,无菌水19 μL。扩增程序:94℃预变性5 min,94℃变性1 min,50.5℃退火30 s,72℃延伸1 min,循环30次,72℃延伸10 min。扩增获得的目的条带经切胶回收克隆后,送Invitrogen公司测序。
1.2.2 细菌系统发育分析测序结果在NCBI网站进行Blast同源性分析,采用软件MEGA6.0中Clustal X程序进行多重序列比对分析,通过Neighbor-Joining方法与1 000次Bootstrap的统计检验构建系统树,以确定新分离菌的系统发育地位。
1.2.3 各因素对亚硝酸氮和总氮去除效果的影响将1 mL处于对数生长期的菌悬液(OD600为0.5)分别接入装有100 mL反硝化培养基的250 mL锥形瓶中,研究Y-9菌株在不同初始温度(5℃、10℃、15℃、20℃、25℃、30℃、35℃和40℃)、pH值(5.0、6.0、7.0、8.0和9.0)、转速(0、50、100、150和200 r/min)、碳源(柠檬酸钠、丁二酸钠、乙酸钠、蔗糖和葡萄糖)以及不同亚硝酸盐氮浓度(10、50、100、150和200 mg/L)条件下对亚硝酸盐氮和总氮的去除能力影响,同时分析了不同接种量(1、2、3、4和5 mL OD600为0.5的处于对数生长期菌悬液接种于100 mL反硝化培养基)对该菌脱氮能力的影响,以上实验除了温度影响条件外均在15℃进行,48 h后分别测定各亚硝酸盐氮浓度和总氮浓度,并计算亚硝酸盐氮和总氮的去除率,确定不同因素对该菌株脱氮的影响。亚硝酸盐氮和总氮的去除率均以:Rv=(T1-T2)/T1×100%进行计算,其中Rv为亚硝酸盐氮或总氮的去除率,T1为反硝化培养基中亚硝酸盐氮或总氮的初始浓度,T2为培养48 h后亚硝酸盐氮或总氮的终浓度。
1.2.4 检测方法总氮浓度采用碱性过硫酸钾消解紫外分光光度法测定[22];亚硝酸盐氮浓度采用N-(1-萘基)-乙二胺光度法测定[23]。
1.2.5 数据处理与分析每组实验设3组平行,实验结果用x±s(n=3)表示,采用Excel、SPSS Stati-stics17.0、MEGA6.0和origin8.6软件对实验结果进行统计分析与做图。
2 结果 2.1 形态学特征Y-9菌株在BTB培养基上15℃好氧培养48 h后,菌落凸起成圆形,表面光滑湿润,边缘整齐、不透明,淡蓝色(图 1);革兰氏染色为阴性(图 2);将该菌固定于锡箔纸上,镀金后,其电镜扫描照片如图 3所示,菌体细胞呈杆状,无鞭毛,无芽孢,两端钝圆,菌体表面凹凸不平。
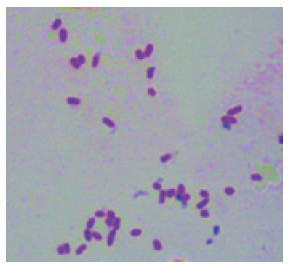 |
| 图 2 菌株Y-9 细胞革兰氏染色图片(10×100) |
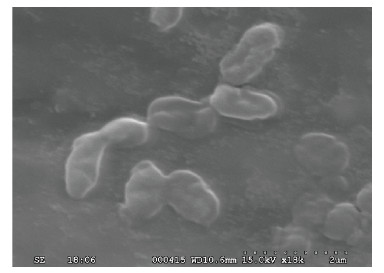 |
| 图 3 电镜扫描下的Y-9 菌株 |
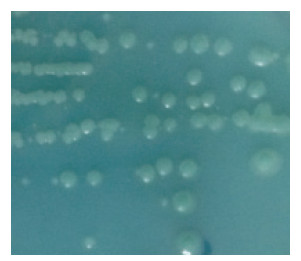 |
| 图 1 菌株Y-9 在BTB 培养基生长的菌落形态 |
本研究对Y-9进行特异性磷脂脂肪酸鉴定的结果如图 4所示,该菌与Pseudomonas-putida-biotype A的相似指数为0.407,表明该菌为非典型的恶臭假单胞菌A类型。
 |
| 图 4 特异性磷脂脂肪酸的鉴定结果 |
通过对菌株Y-9的16S rRNA基因序列进行PCR扩增测序,获得1 476 bp片段,NCBI网站上Blast同源性比对结果显示,菌株Y-9与Pseudomonas putida相似性高达99%,采用MEGA6.0构建进化树(图 5)可看出,Y-9与Pseudomonas putida 类群聚集在一起。通过形态学、磷脂脂肪酸和16S rRNA基因序列分析,其鉴定结果一致,表明将菌株Y-9鉴定为恶臭假单胞菌(Pseudomonas putida)具有高度的可靠性。
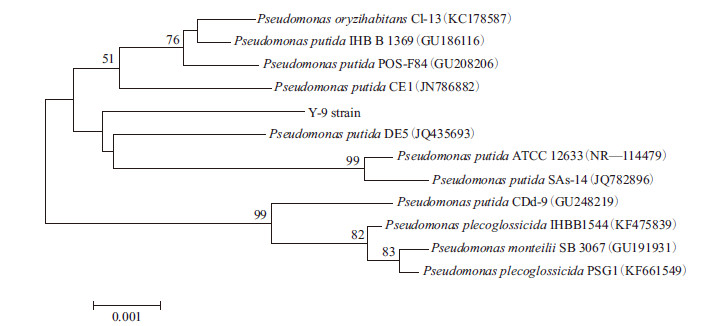 |
| 图 5 菌株Y-9 的系统发育进化树 |
温度对菌株Y-9去除反硝化培养基中亚硝酸盐氮和总氮效果的影响如图 6所示,当温度由5℃上升至15℃时,其反硝化作用去除亚硝酸盐氮和总氮的效率随着温度的上升而增加到最大值,达到100%和55.51%;当温度在20℃至35℃之间时,亚硝酸盐氮和总氮去除率没有明显的变化;当温度上升至40℃,亚硝酸盐氮和总氮的去除率被强烈抑制,这可能是高温破坏或抑制酶催化反应过程,导致强烈抑制了该菌株的反硝化脱氮能力。
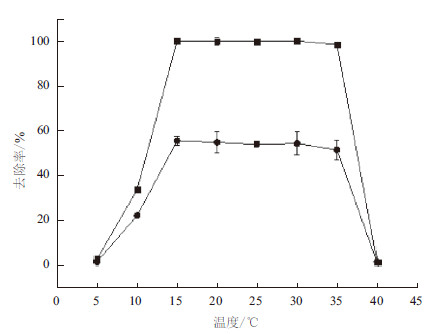 |
| 图 6 温度对菌株Y-9 去除氮的影响 |
本实验比较了5个不同初始pH值对菌株Y-9脱氮影响,结果如图 7所示,pH值在6以下时,会完全抑制该菌的反硝化活性;当pH值增加到7时,其亚硝酸盐氮和总氮去除率最大,48 h内其去除率分别达到了100%和59.97%;当pH值继续增加至9时,亚硝酸盐氮去除率没有显著变化,但总氮去除率下降至38.30%,表明该菌脱氮的最佳pH条件为中性,过酸或过碱都会影响反硝化作用的进行,但酸性环境对反硝化作用的抑制强度显著大于碱性环境,表明该菌对碱性环境条件具有一定的耐受性。反硝化作用是一个产碱的过程,因此在中性环境条件下,无需人工提高环境中pH条件即可满足反硝化作用的顺利进行。
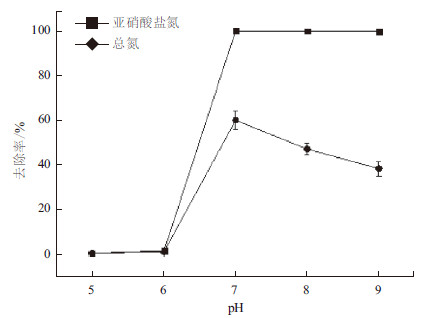 |
| 图 7 pH 对菌株Y-9 去除氮的影响 |
接种量对Y-9去除亚硝酸盐氮和总氮的影响如图 8所示,OD600为0.5的1 mL对数生长期菌液接入100 mL反硝化培养基中时,在15℃、48 h内对亚硝酸盐氮和总氮去除率分别达到了100%和54.80%。随着接种量的逐步增加,Y-9菌株对亚硝酸盐氮的去除率没有显著影响,而对总氮的去除率连续降低,当接种量为5 mL时,菌株Y-9对总氮的去除率显著低于1mL接种量,仅为25%左右。
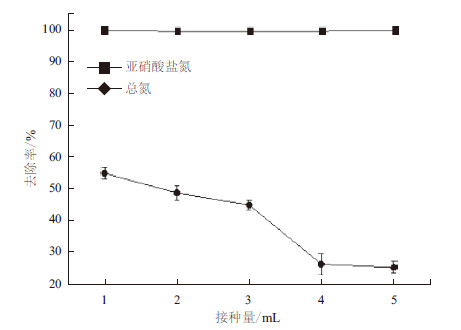 |
| 图 8 接种量对菌株Y-9 除氮的影响 |
本实验研究了5种碳源对菌株Y-9去除亚硝酸盐氮和总氮的影响,结果如图 9所示,表明Y-9菌株能利用柠檬酸钠、丁二酸钠和乙酸钠有效去除亚硝酸盐氮和总氮。但不同种类的碳源对亚硝酸盐氮和总氮去除率均有影响,以蔗糖为碳源时,培养液比较清澈,亚硝酸盐氮和总氮去除率低;以葡萄糖为碳源时,培养液的浑浊度显著提高,能100%地去除亚硝酸盐氮,但对总氮的去除率只有18.27%,表明蔗糖和葡萄糖显著降低Y-9菌株的脱氮能力。比较5种不同碳源对亚硝酸盐氮和总氮的去除效率,柠檬酸钠为Y-9的最佳碳源,在以柠檬酸钠为唯一碳源的反硝化培养基中,该菌对亚硝酸盐氮和总氮的去除率分别高达到100%和66.57%。
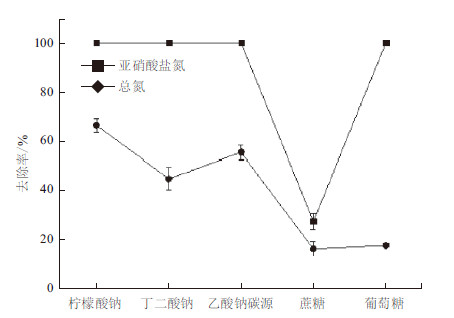 |
| 图 9 碳源对菌株Y-9 除氮的影响 |
本实验比较了5个亚硝酸盐氮浓度对菌株Y-9脱氮能力影响,如图 10所示,亚硝酸盐氮为10 mg/L时,Y-9对亚硝酸盐氮和总氮的去除率分别为100%和55.52%,随着亚硝酸盐氮浓度不断升高至200 mg/L时,对亚硝酸盐氮和总氮的去除率持续下降至22.69%和21.44%。由此可见,高浓度亚硝酸盐会抑制Y-9的脱氮能力,但即使在200 mg/L的亚硝酸盐氮浓度下,Y-9仍具有一定的反硝化活性。因此,该菌对亚硝酸盐的耐受程度完全能够满足养殖水体除氮要求,对治理养殖水中亚硝酸盐污染具有很大的应用潜力。
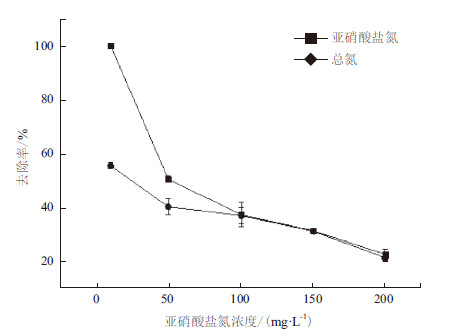 |
| 图 10 亚硝酸盐氮对菌株Y-9 除氮的影响 |
为了研究溶解氧对菌株Y-9脱氮能力的影响,设置了5个不同转速,于15℃条件下考察该菌对亚硝酸盐氮和总氮的去除效果,结果如图 11所示。当静止培养时,亚硝酸盐氮和总氮去除率均较低,表明低溶解氧会限制细菌的生长以及脱氮能力的发挥;随着转速的增大,亚硝酸盐氮和总氮的去除速率迅速增加,当转速增加至100 r/min时,亚硝酸盐氮和总氮的去除率分别达到100%和77.13%,继续增大转速时,亚硝酸盐氮的去除率不再发生变化,但总氮去除率显著下降,但高溶解氧如何抑制Y-9的脱氮作用有待进一步研究。
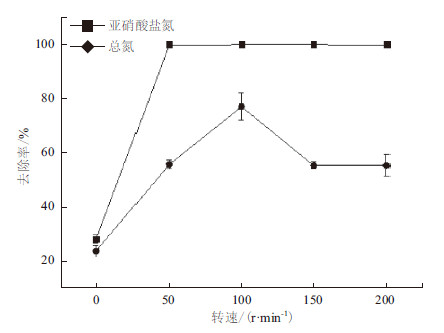 |
| 图 11 转速对菌株Y-9 除氮的影响 |
在进行细菌鉴定分类时,单一鉴定方法准确性相对较差,多种鉴定方法相结合可以使鉴定结果更加科学、准确和可靠。磷脂脂肪酸是细胞膜的主要成分之一,在不同种生物细胞膜上具有特异性,同种生物细胞膜上比较恒定,可利用气相色谱简单、快速、灵敏且精确地检测细胞上所特有的磷脂脂肪酸种类[24,25,26,27],因而磷脂脂肪酸已成为鉴定细菌和真菌的一个重要指标。本实验结合形态学观察、特异性磷脂脂肪酸检测和16S rRNA基因测序分析,一致确定菌株Y-9为恶臭假单胞菌。然而,菌株Y-9在BTB培养基上生长菌落颜色呈现出淡蓝色,与郑佳佳等[28]报道恶臭假单胞菌在该培养基上生长菌落颜色为米黄色具有明显差异;菌株Y-9不具有鞭毛,这显著不同于李怡等[29]报道的恶臭假单胞菌M6具有端生鞭毛的特点,这可能与生长的环境条件不同有关。
微生物去除水体中的亚硝酸盐会受很多因素的限制,其中温度是影响细菌活性与功能的重要环境条件之一,只有在适宜温度条件下,反硝化细菌才会表现出良好的反硝化能力[30]。本实验研究温度对菌株Y-9脱氮能力的影响发现,该菌脱氮的最适温度比已报道的假单胞菌属反硝化细菌脱氮温度低,脱氮效率高[24,31,32,33],适合初冬至春末阶段养殖水体亚硝酸盐污染处理。此外,pH值不仅影响细胞内的电解质平衡,而且还影响溶液中营养物质或抑制物质的浓度,从而直接或间接影响微生物的活性[34],养殖水体的pH一般为中性或偏碱性,菌株Y-9适宜的脱氮pH条件非常适合治理养殖水体。
接种量也是影响反硝化脱氮的一个重要因素,接种量不足,在短时间内很难达到理想的反硝化脱氮效果;接种量过大时,会引起细菌死亡而导致总氮去除不显著。本实验结果表明,接种量对菌株Y-9脱氮能力的影响与周莉等[35]报道不一致,他们的研究结果表明假单胞菌属的反硝化能力会随着接种量增加而增加。但张文艺等[36]对假单胞菌属N1和H1研究结果表明,过大的投菌量会使细菌对硝酸盐氮和总氮的去除率均下降,其原因可能是碳源不足使细菌提前进入衰亡期或者缺氧导致不适宜细菌生长。本研究与之不同的是接种量并不显著影响亚硝酸盐氮的去除率,只降低菌株Y-9对总氮的去除率;碳源在反硝化过程中作为细胞生长的能源和反硝化作用脱氮的电子供体,会直接或间接影响细胞生长繁殖和功能基因的表达,前人研究认为不同种类的碳源至少会影响一氧化二氮还原酶的活性[37]。因此,研究碳源对微生物脱氮的影响具有重要的意义。王慧聪等[7]、李慧颖等[38]和李兵等[39]的研究认均为乙酸盐为反硝化脱氮的最佳碳源,而本研究结果表明,菌株Y-9能利用多种碳源进行反硝化脱氮作用,其最佳碳源柠檬酸钠。众所周知,亚硝酸盐是一种强烈的有毒物质,已有研究表明亚硝酸盐对水生动物、两栖动物、哺乳动物等均具有毒害作
用[40,41,42],但对微生物的毒害作用还鲜见报道。本研究结果表明高浓度的亚硝酸盐对菌株Y-9的脱氮能力具有强烈的抑制作用,但并不会引起细菌大量死亡,该菌对亚硝酸盐浓度耐受程度完全能够满足治理水产养殖水体的要求。此外,在好氧反硝化过程中,溶解氧可作为电子受体,竞争性地抑制亚硝酸盐氮的还原,而且溶解氧还会抑制一氧化二氮还原酶的活性,导致N2O大量溢出,产生温室效应[33,43,44,45],因此,在实际污水处理过程中适当的控制溶解氧具有现实意义。菌株Y-9对溶解氧的需求并不十分严格,如需在短时间内降低水环境中的亚硝酸盐氮,将溶解氧控制在100 r/min所对应的溶解氧水平条件下最理想;如有特殊情况,无需在短时间内去除亚硝酸盐,在低溶解氧或高溶解条件下延长反硝化脱氮时间也许会达到同样的效果,但其脱氮产物仍需进一步研究。
4 结论通过形态学、特异性磷脂脂肪酸检测和16S rRNA基因序列分析,将实验室分离获得的Y-9菌株鉴定为恶臭假单胞菌(Pseudomonas putida)。
菌株Y-9的反硝化作用最适温度为15℃,是一株耐冷反硝化细菌,对溶解氧具有一定耐受性,其最佳溶解氧水平对应转速为100 r/min,在该溶解氧水平下,15℃、48 h内对亚硝酸盐氮和总氮的去除率高达100%和77.13%,最佳pH为7,对碱性环境条件的耐受性高于酸性环境,最佳接种量为1 mL(OD600为0.5),最佳碳源为柠檬酸钠,但能利用多种碳源进行细胞生长和反硝化脱氮作用,适合治理低浓度的亚硝酸盐氮污染水体。
| [1] | 赵永锋, 胡海彦, 蒋高中, 等. 我国大宗淡水鱼的发展现状及趋势研究[J]. 中国渔业经济, 2012, 30(5):91-99. |
| [2] | 董金和. 《 2013 中国渔业统计年鉴》 解读[J]. 中国水产, 2013(7):19-20. |
| [3] | Jensen FB. Nitrite disrupts multiple physiological functions in aquatic animals[J]. Comp Biochem Phys A, 2003, 135(1):9-24. |
| [4] | Lewis WM, Morris DP. Toxicity of nitrite to fish:a review[J]. T Am Fish Soc, 1986, 115(2):183-195. |
| [5] | 凌歌. 一种亚硝酸盐降解新方案及其在水产养殖上的应用[J]. 渔业致富指南, 2010(12):27-28. |
| [6] | 洪美玲, 陈立侨, 孙新谨, 等. 亚硝酸盐急性胁迫对中华绒螯蟹幼体相关免疫指标和应激蛋白(HSP70)表达的影响[J]. 应用与环境生物学报, 2011, 17(5):688-693. |
| [7] | 王会聪, 曹海鹏, 何珊, 等. 一株亚硝酸盐降解菌的分离鉴定与系统发育分析[J]. 环境污染与防治, 2012, 34(4):32-36. |
| [8] | 周超, 高乃云, 楚文海, 等. 水体中亚硝酸盐生物毒性和去除的研究进展[J]. 给水排水, 2011, 37(5):104-108. |
| [9] | 赵翠娟, 宋文军, 朱高雄, 等. 除氨氮菌在污水处理中的研究进展[J]. 生物技术通报, 2013(2):31-34. |
| [10] | Layva-Diaz JC, Gonzalez-Martinez A, Gonzalez-Lopez J, et al. Kinetic modeling and microbiological study of two-step nitrification in a membrane bioreactor and hybrid moving bed biofilm reactor-membrane bioreactor for wastewater treatment[J]. Chem Eng J, 2015, 259:692-702. |
| [11] | Zhu G, Peng Y, Li B, et al. Biological removal of nitrogen from wastewater[M]. Rev Environ Contam T, 2008, 192:159-195. |
| [12] | Yu L, Liu YJ, Wang GJ. Identification of novel denitrifying bacteria Stenotrophomonas sp. ZZ15 and Oceanimonas sp. YC13 and application for removal of nitrate from industrial wastewater[J]. Biodegradation, 2009, 20(3):391-400. |
| [13] | Guo L, Chen Q, Fang F, et al. Application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water[J]. Bioresour Technol, 2013, 142:45-51. |
| [14] | Čuhel J, Šimek M, Laughlin RJ, et al. Insights into the effect of soil pH on N2O and N2 emissions and denitrifier community size and activity[J]. Appl Environ Microb, 2010, 76(6):1870-1878. |
| [15] | Ellis S, Howe MT, Goulding KWT, et al. Carbon and nitrogen dynamics in a grassland soil with varying pH:Effect of pH on the denitrification potential and dynamics of the reduction enzymes[J]. Soil Biol Biochem, 1998, 30(3):359-367. |
| [16] | Ji B, Wang H, Yang K. Tolerance of an aerobic denitrifier(Pseudomonas stutzeri)to high O2 concentrations[J]. Biotechnol Lett, 2014, 36(4):719-722. |
| [17] | Kroupova H, Machova J, Svobodova Z. Nitrite influence on fish:a review[J]. Vet Med-Czech, 2005, 50(11):461. |
| [18] | Rodriguez-Caballero A, Hallin S, Pahlson C, et al. Ammonia oxidizing bacterial community composition and process performance in wastewater treatment plants under low temperature conditions[J]. Water Sci Technol, 2012, 65(2):197-204. |
| [19] | 陈忠祥, 曹广斌, 杨谦, 等. 低温硝化细菌的筛选及降解特性[J]. 江苏农业科学, 2011, 39(4):284-286. |
| [20] | 邵晴, 余晓斌. 好氧反硝化细菌的筛选及反硝化特性研究[J]. 生物技术, 2008, 18(3):63-65. |
| [21] | Song ZF, An J, Fu GH, et al. Isolation and characterization of an aerobic denitrifying Bacillus sp. YX-6 from shrimp culture ponds[J]. Aquaculture, 2011, 319(1):188-193. |
| [22] | 中华人民共和国环境保护部. 水质总氮的测定碱性过硫酸钾消解紫外分光光度法(HJ636-2012)[S]. 2012. |
| [23] | 魏复盛, 毕彤, 齐文启. 水和废水检测分析方法[M]. 第4版. 北京:中国环境科学出版社. |
| [24] | 张国赏, 吴文鹃, 潘仁瑞. 气相色谱—质谱法检测细胞脂肪酸及其在细菌鉴定上的应用[J]. 合肥联合大学学报, 2005, 10(4):92-96. |
| [25] | 蓝江林, 刘波, 陈璐, 等. 芭蕉属植物内生细菌磷脂脂肪酸(PLFA)生物标记特性研究[J]. 中国农业科学, 2010, 43(10):2045-2055. |
| [26] | Pratt B, Riesen R, Johnston CG. PLFA analyses of microbial communities associated with PAH-contaminated riverbank sediment[J]. Microbial Ecol, 2012, 64(3):680-691. |
| [27] | Trögl J, Jirková I, Zemánková P, et al. Estimation of the quantity of bacteria encapsulated in Lentikats Biocatalyst via phospholipid fatty acids content:a preliminary study[J]. Folia Microbiol, 2013, 58(2):135-140. |
| [28] | 李怡, 何珊, 曹海鹏, 等. 孔雀石绿脱色恶臭假单胞菌菌株M6的分离、鉴定及其生长特性研究[J]. 微生物学通报, 2009, 36(1):57-63. |
| [29] | 郑佳佳, 沈涛, 傅罗琴, 等. 一株硝化反硝化细菌Pseudomonas putida F6 的筛选鉴定及反硝化特性研究[J]. 水生生物学报, 2012, 36(1):1-12. |
| [30] | 杨小龙, 李文明, 陈燕, 等. 一株好氧反硝化菌的分离鉴定及其除氮特性[J]. 微生物学报, 2011, 51(8):1062-1070. |
| [31] | 李焱生, 魏民, 张艾晓, 等. 一株异养型亚硝酸盐氧化细菌的分离及其降解特性的研究[J]. 生物技术通报, 2010(5):196-202. |
| [32] | Ridgway HF, Safarik J, Phipps D, et al. Identification and catabolic activity of well-derived gasoline-degrading bacteria from a contami-nated aquifer[J]. Appl Environ Microb, 1990, 56:3565-3575. |
| [33] | Bonin P, Gilewicz M. A direct demonstration of “co-respiration” of oxygen and nitrogen oxides by Pseudomonas nautica:some spectral and kinetic properties of the respiratory components[J]. Fems Microbial Lett, 1991, 80(2):183-188. |
| [34] | 杨洋, 左剑恶, 沈平, 等. 温度、pH值和有机物对厌氧氨氧化污泥活性的影响[J]. 环境科学, 2006, 27(4):692-695. |
| [35] | 周莉, 汤江武, 等. 好养反硝化细菌的筛选鉴定及其反硝化反应条件优化[J]. 浙江农业学报, 2011, 23(5):942-947. |
| [36] | 张文艺, 陆丽巧, 姚立荣, 等. AF反应器中好氧反硝化细菌的筛选分离及硝化特性的研究[J]. 中国农村水利水电, 2011, 1:59-64. |
| [37] | 傅利剑, 郭丹钊, 史春龙, 等. 碳源及碳氮比对异养反硝化微生物异养反硝化作用的影响[J]. 农村生态环境, 2005, 21(2):42-45. |
| [38] | 李慧颖, 黄少斌, 范利荣, 等. 一株好氧反硝化菌的反硝化性能研究[J]. 环境科学与技术, 2009, 32(8):9-12. |
| [39] | 李兵, 林炜铁. 1株好氧反硝化芽孢杆菌的脱氮特性研究[J]. 水生态学杂志, 2009, 2(3):48-52. |
| [40] | Lemis WM, Morris DP. Toxicity of nitrite to fish - a review[J]. T Am Fish Soc, 1986, 115(2):183-195. |
| [41] | Jensen FB, Hansen MN. Differential uptake and metabolism of nitrite in normoxic and hypoxic goldfish[J]. Aquat Toxicol, 2011, 101(2):318-325. |
| [42] | Ozen H, Kamber U, Karaman M, et al. Histopathologic, biochemical and genotoxic investigations on chronic sodium nitrite toxicity mice[J]. Exp Toxicol Pathol, 2014, 66(8):367-375. |
| [43] | Shinn C, Marco A, Serrano L. Influence of low levels of water salinity of nitrite to anuran larvae[J]. Chemosphere, 2013, 92(9):1154-1160. |
| [44] | 于爱茸, 李尤, 俞吉安. 一株耐氧反硝化细菌的筛选及脱氮特性研究[J]. 微生物学杂志, 2005, 25(3):77-81. |
| [45] | Bernat K, Wojnowska I. Carbon source in aerobic denitrification [J]. Biochem Eng J, 2007, 36(2):116-122. |




