2.江苏省环境科学与工程重点实验室,苏州 215009
2. Jiangsu Provincial Key Lab of Environmental Science and Engineering,Suzhou 215009
近年来,随着制药、化工、发酵等工业的迅速发展,产生了大量含氮含硫废水。氮是导致水体富营养化的主要原因,而硫化物会损害人体健康,同时可对金属产生氢脆破坏、也能加速建筑材料和艺术品等非金属材料的老化[1, 2, 3],须将其去除。一般来说,生物脱氮除硫需要反硝化细菌和硫细菌两种微生物来去除,但近年来研究证明,一些微生物能够以硝酸盐为电子受体将硫化物氧化成单质硫,相较于传统生物法分别进行脱氮、除硫,同步脱氮除硫具有节省耗氧量、缩短反应时间、减少占地面积以及可以产生单质硫利于回收等优点,对于此类能够同时利用硝酸盐和硫化物的微生物,将其称为反硝化脱硫细菌(NR-SOB)[4]。
目前,对同步脱氮除硫菌的研究主要集中在脱氮硫杆菌(Thiobacillus denitrificans)。Subletee等[5]使用脱氮硫杆菌对CSTR反应器进行接种发现,其对H2S具有较高的去除率,Koenig等[6]利用富集得到的脱氮硫杆菌对以硫磺颗粒为填料的UASB进行接种,结果表明硝酸盐的去除率几乎可达100%,刘玲花等[7]以脱氮硫杆菌为工程菌,硫与石灰石为填料的滤柱去除地下水中的NO3-,结果发现去除率可以达到98%。车轩[8]、刘宏芳[9]和范立民[10]等对脱氮硫杆菌的特性研究得到菌株脱氮效果最佳的初始pH为6.85,温度为32.8℃,生长最快的初始pH为6.90,温度为29.5℃。但对于其他同步脱氮除硫菌的研究还较少,因此本研究拟从实验室稳定运行的反硝化脱硫UASB反应器中富集高效同步脱氮除硫菌,旨在提高反硝化脱硫过程的效率,优化反硝化脱硫工艺性能,还可为此工艺提供生产菌种,促进该工艺的工程化应用。
1 材料与方法 1.1 材料 1.1.1 污泥来源用于分离菌株的污泥来自于实验室稳定运行的UASB同步反硝化脱硫反应器中,污泥的湿密度为1.038 g/mL,MLSS=12.03 g/L,MLVSS=7.67 g/L。稳定运行时进水硫化物(以S计)、硝酸盐(以N计)和乙酸盐(以C计)的质量浓度分别为300、132和113 mg/L,当水利停留时间为12 h,进水pH在7.5左右时,去除率分别为91.4%、89.4%和87.3%,单质硫产率为83.1%。
1.1.2 培养基的制备由于硫化物易氧化且不容易控制培养基的pH,故培养基中以硫代硫酸盐代替硫化物,富集培养基成分[10]如下:0.5% Na2S2O3·5H2O,0.4% KNO3,0.05% NH4Cl,0.05% MgCl2·6H2O,0.2% KH2PO4,0.1% NaHCO3,0.001%FeSO4·7H2O,用0.01 mol/L的NaOH调节pH至7左右,121℃灭菌20 min,Na2S2O3·5H2O滤膜过滤除菌后待培养基灭菌冷却后另外加入。分离培养基和穿刺培养基在富集培养基中分别加入2%和0.5%的琼脂。
脱氮除硫试验培养基为:Na2S·9H2O 0.9 g,KNO3 0.1 g,NaHCO3 1 g,MgCl2·6H2O 0.5 g,KH2PO4 2.0 g,蒸馏水1 000 mL,pH调节为7左右,硫化钠在滤膜过滤除菌后待培养基灭菌冷却后加入。
1.2 方法 1.2.1 菌株的富集培养和纯化分离取1 g反应器内污泥加入到含有99 mL无菌水的培养瓶中,并加入几粒玻璃珠,制成稀释浓度为10-2的污泥悬浮液,然后从浓度为10-2的悬浮液中取1 mL到含有9 mL无菌水的培养瓶中即成10-3污泥稀释液,依次重复稀释到10-8,将10-2到10-8污泥稀释悬浮液分别取1 mL接入含有50 mL富集培养基的培养瓶中,封口置于30℃生化培养箱中静置培养3-7 d。将产气多、浑浊度大的富集培养物进行平板划线分离,挑出单菌落进行纯化。
1.2.2 菌株的脱氮除硫实验将纯化分离出的菌株进行脱氮除硫试验,即将初筛菌株接种至含有100 mL脱氮除硫培养基的灭菌锥形瓶中,做2个重复,同时以未接种的培养基作为空白对照,30℃下培养2 d。测定培养前后培养液中的NO3--N及S2--S含量,对两个平行实验的结果取平均值,以空白对照的结果进行校正,然后计算各菌株的NO3--N及S2-的去除率。
1.2.3 菌株的生理生化实验和16S rDNA鉴定菌株的生理生化实验参照文献[11]进行鉴定,采用Ezup柱式细菌基因组 DNA 抽提试剂盒提取准备鉴定菌株的基因组DNA,以细菌的通用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增,PCR扩增反应体系为DNA模板(基因组DNA 20-50 ng/μL)0.5 μL;10×Buffer(with Mg2+)2.5 μL;dNTP混合物(各2.5 mmol/L)1 μL;DNA聚合酶0.2 μL;正反引物(10 μmol/L)各0.5 μL;加双蒸水至25 μL。PCR扩增条件为:94℃ 4 min;94℃ 45 s,55℃ 45 s,72℃ 1 min,30个循环;72℃ 10 min,修复延伸;最后4℃终止反应。纯化得到的PCR产物测序委托上海生物工程技术有限公司进行,将测得的16S rDNA序列后将结果输入核糖体数据库(http://rdp.cme.msu.edu/index.jsp)进行BLAST比对,利用DNASTAR软件中MegAlign建立系统发育树。
1.2.4 温度和pH值对分离菌株生长和反硝化代谢的影响将保存备用的菌株H3和H7分别进行两次活化、划线分离至平板表面为均一的菌落,分别用无菌生理盐水洗下菌苔,在250 mL三角瓶中装入100 mL培养液和5%菌悬液(V/V)NO3--N和S2--S设定为40 mg/L和100 mg/L,初始pH值依次调控至为3、4、5、6、7、8和9,在30℃摇床内以120 r/min振荡培养,通过培养液的OD值(λ=600 nm)的测定和NO3--N去除率的变化来判断菌体的生长和代谢情况。
同样,在250 mL三角瓶中装入100 mL培养液和5%菌悬液(V/V),NO3--N和S2--S设定为40 mg/L和100 mg/L,初始pH值依次调控7左右,温度依次设定为10、15、20、25、30、35和40℃摇床内以120 r/min振荡培养,通过测定培养液的OD值(λ=600 nm)和NO3--N去除率的变化来判断菌体的生长和代谢情况。
1.2.5 菌株的耐盐度实验用无菌去离子水配置盐度分别为0%、0.5%、1%、2%、4%和8%的培养基,30℃培养24 h后测定OD600值。
1.2.6 分析项目与测定方法所有水样经离心后取上清液进行测定,pH采用雷磁PHSJ-4A型pH计测量,NO3--N采用紫外分光光度法,NO2--N采用N-(1-萘基)-乙二胺光度法,S2--S采用亚甲蓝法分光光度法。
2 结果 2.1 脱氮除硫实验结果从反应器内共定向分离出7株产气较多的脱氮除硫菌(编号H1、H2、H3、H4、H5、H6、H7),分别进行脱氮除硫试验,30℃培养2 d后对NO3--N和S2--S去除率进行测定和计算。结果(表 1)表明,相较于空白灭菌对照的脱氮除硫率,7株菌株都具有一定的脱氮除硫率,其中以H3和H7最为显著,脱氮除硫率分别达到71%、47.8%和65.2%、44.8%。因此将H3和H7作为实验菌株进行进一步的鉴定。
H3和H7都为革兰氏染色阴性,在固体琼脂培养基上生长时菌落呈淡黄色,粘液状。H3和H7的生理生化实验结果相似,接触酶和氧化酶测定阳性,不能使明胶液化,可水解淀粉,葡萄糖产酸实验阳性。
图 1为H3和H7的16S rDNA全长PCR扩增结果,用等量的水代替模板作阴性对照无条带出现,证明PCR扩增结果可信,菌株H3和菌株H7的16S rDNA序列长度分别为1 444 bp和1 430 bp,16S rDNA序列测定结果表明菌株H3与Pseudomonas stutzeri CONC12菌株的序列同源性为99.6%,与Pseudomonas sp. Da2菌株的序列同源性为98.8%,菌株H7与Pseudomonas stutzeri CONC12,Pseudomonas stutzeri ST27MN3和Pseudomonas stutzeri 19smn4的序列同源性都为98.9%。
 |
| 图 1 H3 和H7 的16S rDNA 全长扩增结果 |
菌株H3和H7在系统分类中的位置如图 2和图 3所示,结合菌株的菌落特征、生理生化特点以及16S rDNA基因序列,确定H3和H7都为施氏假单胞菌(Pseudomonas stutzeri)。
 |
| 图 2 菌株H3 和H7 与参考菌株基于16S rDNA 序列构建的最大似然法系统发育树 |
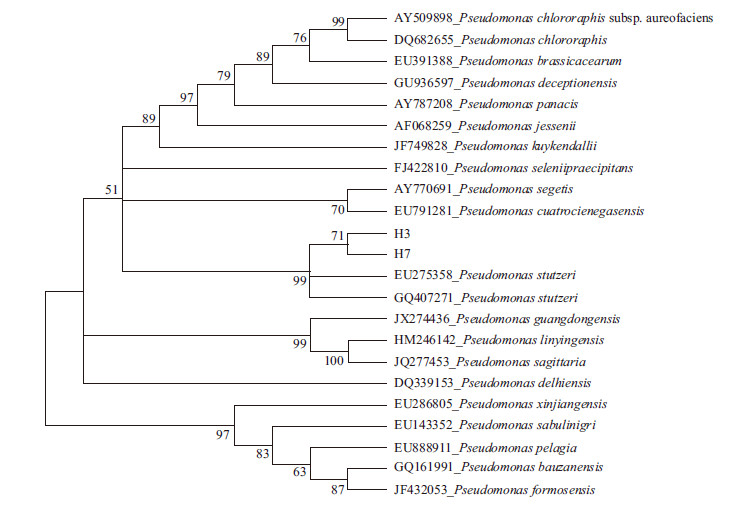 |
| 图 3 菌株H3 和H7 与参考菌株基于16S rDNA 序列构建的最大简约法系统发育树 |
如图 4和图 5所示,起始pH由3.0增加至9.0,H3和H7的生长量都呈现先升后降的趋势,对图进行非线性拟合,可知H3的生长最适起始pH为6.94,最适反硝化pH为6.77。而H7的生长最适起始pH为6.88,最适反硝化pH为6.56。
 |
| 图 4 pH 对菌株H3 生长速率和反硝化速率的影响 |
 |
| 图 5 pH 对菌株H7 生长速率和反硝化速率的影响 |
如图 6和图 7所示,温度对菌株H3和H7的生长和反硝化活性都有明显的影响,但温度对生长的影响规律并不同于其对反硝化代谢活性的影响。当温度从10℃上升到30℃时,菌体的生长速率和反硝化代谢活性是逐渐增大的;但当温度继续升高后,菌体生长速率逐渐降低,而反硝化代谢活性会继续增加然后降低。可见,菌体H3和H7的最适反硝化温度都高于最适生长温度。对图 5结果进行非线性拟合,可得菌株H3的最适生长温度为30.4℃,最适反硝化温度为31.4℃,而菌株H7的最适生长温度为30.6℃,最适反硝化温度为31.2℃。
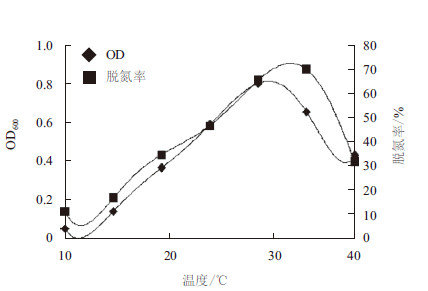 |
| 图 6 温度对菌株H3 生长速率和反硝化速率的影响 |
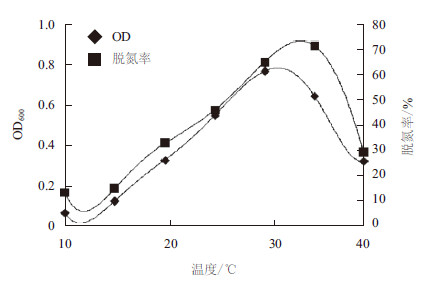 |
| 图 7 温度对菌株H7 生长速率和反硝化速率的影响 |
由图 8显示,NaCl浓度低于1%时,对菌株H3和H7生长的影响不大,但当NaCl浓度在1%以上时,菌株H3和H7的生长受到较严重的影响。结果表明,菌株H3和H7都为非耐盐菌株。
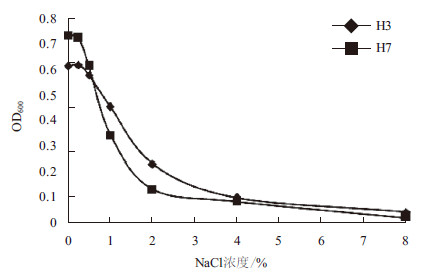 |
| 图 8 NaCl 浓度对菌株H3 和H7 生长的影响 |
同步脱氮除硫是存在于某些菌体内的一种特殊的代谢途径,其原理是以低价硫化合物为电子供体,以硝酸盐氮为电子受体进行电子传递从而获得生长所需的能量。本实验从稳定运行的UASB工艺反硝化脱硫反应器中筛选出2株同步脱氮除硫菌,脱氮除硫率分别可以达到71%、47.8%和65.2%、44.8%。16S rDNA序列测定结果显示H3与H7都与施氏假单胞菌(Pseudomonas stutzeri)的同源性较高。目前有一些对施氏假单胞的相关报道,如周国勤等[12]为了有效控制养殖水体中的氮素污染,研究了假单胞菌(Pseudomonas stutzeri)的生长特性和反硝化活性,最适生长pH为7.0-8.0,最适生长温度为30-35℃。孔瑛等[13]以二苯并噬吩(DBT)为模型化合物,筛选到一株石油生物脱硫菌Pseudomonas stutzeri,该菌能够在较短时间内将DBT降解为可溶于水的化合物。周晓黎等[14]从缺氧生物滤池筛选纯化得到一株具有高效反硝化能力的异养菌,经鉴定为施氏假单胞菌(Pseudomonas stutzeri),且该菌的亚硝酸盐还原酶能力较强。同样,弓湃等[15]也曾研究了施氏假单胞菌亚硝酸盐还原酶基因 nirS 的转录特性,李献等[16]也曾发现Pseudomonas stutzeri菌株能够在厌氧条件下具有脱氮除硫作用,但并未对其生长及反硝化特性进行更深入的研究。本研究筛选出了同步脱氮除硫功能菌并鉴定其种属,确定了其生长和反硝化的最佳条件,但其对氮、硫的去除效果与实际工程应用的要求还有一定的差距,尤其是除硫方面,应该继续通过反应底物的定量分析确定其同步脱氮除硫的机理,来推进该菌株在高浓度含氮含硫废水处理中的应用。
4 结论通过对稳定运行的UASB工艺反硝化脱硫反应器中的污泥进行反硝化脱硫菌的筛选分析,得到如下结论:(1)初筛了7株同步脱氮除硫菌,根据脱氮除硫实验结果筛选出2株脱氮除硫率最高的菌株H3和H7,经过菌落形态、生理生化实验和16S rDNA基因序列鉴定,确定两株都为施氏假单胞菌(Pseudomonas stutzeri),为非耐盐菌株;(2)菌株H3和H7的生长最适起始pH为6.94和6.88,最适反硝化pH分别为6.77和6.56。H3和H7的最适生长温度为30.4℃和30.6℃,最适反硝化温度分别为31.4℃和31.2℃,两株菌种都为非耐盐菌株。
| [1] | Chen Y, Cheng JJ, Creamer KS. Inhibition of anaerobic digestion process:a review[J]. Bioresource Technology, 2008, 99(10):4044-4064. |
| [2] | Moore PK, Bhatia M, Moochhala S. Hydrogen sulfide:from the smell of the past to the mediator of the future?[J]. Trends in Pharmacological Sciences, 2003, 24(12):609-611. |
| [3] | Mahmood Q, Zheng P, Cai J, et al. Sources of sulfide in waste streams and current biotechnologies for its removal[J]. Journal of Zhejiang University Science A, 2007, 8(7):1126-1140. |
| [4] | Nica D, Davis JL, Kirby L, et al. Isolation and characterization of microorganisms involved in the biodeterioration of concrete in sewers[J]. International Biodeterioration & Biodegradation, 2000, 46(1):61-68. |
| [5] | Sublette KL, Sylvester ND. Oxidation of hydrogen sulfide by continuous cultures of Thiobacillus denitrificans[J]. Biotechnology and Bioengineering, 1987, 29(6):753-758. |
| [6] | Koenig A, Liu LH. Autotrophic denitrification of landfill leachate using elemental sulphur[J]. Water Science and Technology, 1996, 34(5):469-476. |
| [7] | 刘玲花, 王占生. 硫/石灰石滤柱去除地下水中硝酸盐的研究[J]. 环境工程, 1995, 13(3):11-16. |
| [8] | 车轩, 罗国芝, 谭洪新, 等. 脱氮硫杆菌的分离鉴定和反硝化特性研究[J]. 环境科学, 2008, 29(10):2931-2937. |
| [9] | 刘宏芳, 汪梅芳, 许立铭. 脱氮硫杆菌生长特性及其对 SRB 生长的影响[J]. 微生物学通报, 2003, 30(3):46-49. |
| [10] | 范立民, 裘丽萍, 陈家长, 等. 养殖池塘系统脱氮硫杆菌(Thiobacillus denitrificans)的分离, 生长特性及脱氮特征研究[J]. 农业环境科学学报, 2013(1):153-159. |
| [11] | 布坎南RE, 吉本斯NE. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译. 伯杰细菌鉴定手册[M]. 第8版. 北京:科学出版社, 1984:643-650. |
| [12] | 周国勤, 陈兵, 吴伟. 假单胞菌Pseudomonas stutzeri的生长特性及其反硝化活性[J]. 湛江海洋大学学报, 2004, 24(1):46-50. |
| [13] | 周晓黎, 孔瑛, 赵金生, 等. 石油生物脱硫菌Pseudomonas stutzeri UP-1的筛选[J]. 微生物学通报, 2004, 31(3):36-41. |
| [14] | 孙迎雪, 沈丹丹, 杨哲, 等. 一株施氏假单胞菌Pseudomonas stutzeri DN-LWX19的脱氮性能[J]. 环境工程学报, 2015, 9(1):247-252. |
| [15] | 弓湃, 王丽英, 尚立国, 等. 固氮施氏假单胞菌亚硝酸盐还原酶基因nirS转录特性及功能鉴定[J]. 微生物学通报, 2015, 42(1):93-100. |
| [16] | 李献, 马光庭. 生物脱氮除硫(S2-)菌株的分离和特征[J]. 广西农业生物科学, 2006, 25(1):52-55. |