脂肪酶(Lipase,EC.3.1.1.3,甘油三酯水解酶)[1],又称三酰甘油酰基水解酶,是一类特殊的酯键水解酶,可在油水界面催化甘油三酯形成甘油二酯、甘油单酯或甘油及游离脂肪酸[2]。在食品[3]、饲料[4, 5]、生物能源(生物柴油)[6]、医药、化妆品[7]等诸多领域有着很高的研究价值和广阔的应用前景。
微生物脂肪酶比动物脂肪酶酶解作用的pH和温度范围更宽,且在微生物界分布广泛,据不完全统计,目前已有65个属的微生物能够产生脂肪酶[8],但是在这些产脂肪酶的微生物中被研究的大多为产碱性[9]或中性[10]脂肪酶的微生物。随着近年来工业化的应用与发展,市场上迫切需求能够大量产生出酸性脂肪酶的微生物。酸性脂肪酶在某些工业化领域生产中具有特殊的应用价值,如在医药工业中酸性脂肪酶适宜在胃肠等酸性条件下发挥作用,可用于治疗胃肠紊乱,消化不良等疾病。在食品加工业中,酸性脂肪酶在适当条件下生成低级脂肪酸,可改善食品风味,增加食品香味等。在饲料加工业生产中,酸性脂肪酶可提高动物对饲料中脂肪成分的利用率。对于脂肪酶在工业应用中的价值及应用中需要的特殊酶学性质,寻找出一株能够产生出酸性脂肪酶的高产菌株,在脂肪酶的研究应用中有重要价值。本研究从富含油脂的土壤中,筛选出一株在酸性条件下能够产生出脂肪酶的真菌菌株,同时对该菌株的产酶条件进行优化,获得其最适产酶条件,旨在为后续的产酸性脂肪酶菌株的菌种改良及酸性脂肪酶的开发、生产及应用提供参考。
1 材料与方法 1.1 材料 1.1.1 菌种来源兰州周边县区饭店抽油烟机下的油污土壤,猪蹄店、烧烤摊等门前的油污土壤及甘肃农业大学校外餐馆与校内的餐厅油污污染的土壤中分离得到。
1.1.2 培养基 1.2 方法 1.2.1 菌株的筛选将采集的土壤进行富集培养,平板分离初筛(选用维多利亚蓝、中性红、罗丹明B 3种指示剂)和摇瓶发酵复筛。初筛时用3种显色培养基进行培养,待菌落长出后,挑选水解圈较大的菌落为目的菌种,进行多次分离培养,直至显微镜下观察无其它杂菌时,方可判断为较纯菌种,然后接种于菌种保藏培养基置于-70℃冷藏。复筛时用初筛得到水解圈较大的纯菌种,接种于种子培养基中200 r/min适温培养24 h之后转接到复筛培养基中,200 r/min适温振荡培养72 h。通过复筛选出产酶能力强的菌株,便于进行下一步的实验。
1.2.2 脂肪酶活力的测定采用改进铜皂-分光光度法[13]测定脂肪酶活力。
脂肪酶酶活力单位定义为:在一定条件下,每分钟释放出1 μmol脂肪酸所需要的酶量定义为1个脂肪酶国际单位(U)[14]。
1.2.3 菌种鉴定 1.2.3.1 形态学鉴定将分离纯化的菌株接种在固体平板培养基上,培养一定时间后观察菌落的形态、颜色、是否产生色素等特征,根据《真菌鉴定手册》[15]进行初步鉴定。
1.2.3.2 分子生物学鉴定以菌株LZ-6基因组DNA为模板,采用真菌ITS序列通用引物[16],如ITS1(序列为5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(序列为5'-TCCTCCGCTTATTGATATGC-3')进行PCR扩增,PCR扩增产物送苏州金唯智生物科技有限公司进行测序,将所得序列与GenBank数据库中序列进行Blast分析比对,并构建系统进化树。
1.2.4 产脂肪酶菌株的发酵条件的优化 1.2.4.1 单因素实验通过单因素实验确定产脂肪酶菌株的最佳氮源、温度、pH值、接种量。 1.2.4.2 正交实验
根据单因素实验结果对产酶的影响,为筛选出最优的产酶组合采用正交实验表 L9(34)设计正交实验[17]。为减小实验误差,在单因素实验与正交实验中针对不同因素设置的不同梯度均做3个平行实验。
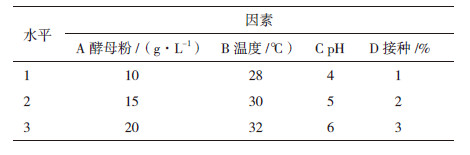
2 结果 2.1 菌种筛选在采集40份油污土壤样品中经富集、涂布平板后分离得到12株产脂肪酶菌株,通过摇瓶发酵复筛得到产酶能力较强的菌株一株,命名为LZ-6,测定其酶活力值为7.49 U/mL。该菌在维多利亚蓝筛选培养基上形成明显水解圈(图 1),故选LZ-6作为实验研究菌株。
 |
| 图 1 菌株LZ-6 在维多利亚蓝平板上的水解圈 |
菌株LZ-6在罗丹明B平板培养基上28℃培养2-5 d。菌落迅速生长,单个菌落近似圆形,表面湿润,中心颜色较深,菌落初期为白色,后期长出菌丝变为灰褐色直至黑色,菌丝宽约5-7 µm(图 2),镜下观察菌丝无横隔,有侧生菌丝,菌丝柄处可见单个或聚集成堆大小不等的椭圆形、球型、壁薄、光滑的孢囊孢子,孢子直径约为3-4 µm(图 3)。结合以上LZ-6菌落形态观察,符合毛霉菌的相关描述,初步确定LZ-6为毛霉。
 |
| 图 2 菌株LZ-6 在罗丹明B 培养基上的菌落形态 |
 |
| 图 3 菌株LZ-6 在显微镜10×100 倍下的形态 |
以菌株LZ-6的基因组DNA为模板,采用真菌ITS序列通用引物ITS1、ITS4进行PCR扩增,结果(图 4)显示,在750 bp处有一条特异性条带。PCR产物测序结果表明,片段大小为726 bp,符合ITS序列特征。
 |
| 图 4 LZ-6 菌株PCR 产物电 |
将得到的扩增序列在NCBI网站上进行序列同源性比对。取与LZ-6菌一致性在99% 以上的序列,用MEGA5.0进行多序列比对并构建基因进化树。结果(图 5)显示,菌株LZ-6与菌株Actinomucor elegans(AB113008.1、AM745431.1、JN887460.1、JN943000.1)位于同一族群,亲缘关系最近,表明菌株LZ-6属于毛霉属的雅致放射毛霉(Actinomucor elegans)。
 |
| 图 5 LZ-6 菌株的ITS rDNA 系统发育树 |
将菌株在6种不同的氮源培养基中进行发酵培养,分别测其发酵液中脂肪酶的活力值。结果(图 6)表明,菌株在这6种发酵培养基中,酶活力值最高的为酵母粉,其次为蛋白胨。因此可知LZ-6菌株发酵产酶最适氮源为酵母粉,与刘光[18]的报道结果相一致。
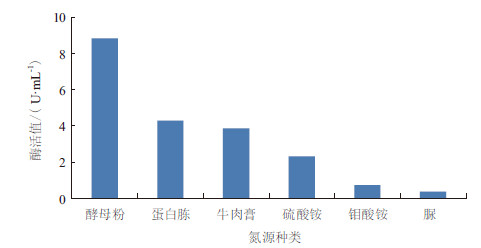 |
| 图 6 氮源对产酶的影响 |
设置26℃、28℃、30℃、32℃、34℃、36℃六种不同温度梯度,在这6种温度下分别测发酵液中的酶活力值,结果(图 7)显示,该菌株的适宜产酶温度范围为30℃-32℃,30℃时达到最高。
 |
| 图 7 温度对产酶的影响 |
将菌株在不同pH值的发酵培养基中进行培养,分别测定发酵液中脂肪酶的活力,结果(图 8)表明当发酵液中的pH值为5时,LZ-6菌株的酶活力值达到最大。
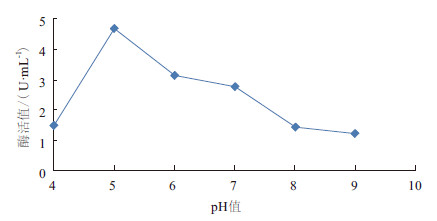 |
| 图 8 pH 值对产酶的影响 |
将菌株按照不同的接种量,接种于发酵培养基中进行培养,分别测定发酵液中脂肪酶的活力,结果(图 9)表明当接种量为2%时,该菌株酶活力值达到最大。
2.3.2 正交实验根据单因素的实验结果,选取酵母粉、温度、pH值、接种量4种因子,根据其设置的不同梯度,采用正交表L9(34)进行正交实验,摇床振荡培养5 d,以酶活值为指标,探讨产酶培养基中的最优组合。结果见表 1和表 2。
对表 2中的数据进行直观分析,得知各因素的极差大小RC>RA>RD>RB,影响脂肪酶产生的各因素的主次顺序为:C(pH)>A(温度)>D(酵母粉)>B(接种量)。结合SPSS软件中Duncana方差分析法筛选最优组合,可知当酶活力值为13.349 6 U/mL时所对应的组合C2A1D2B2与其它组合间的差异显著(P<0.05),最优组合为:C2A1D2B2 ,即pH为5、温度30℃、酵母粉10 g/L、接种量为2% 。在此组合下酶活力值为13.349 6 U/mL,比优化前提高1.78倍。
3 讨论 3.1 高产酶菌株的筛选与鉴定产脂肪酶的微生物分布广泛,主要存在于细菌、真菌及放线菌中,近年来随着工业化的生产及社会发展的需要,国内外对产脂肪酶菌株的报道也越来越多,但多集中在细菌及放线菌上,而真菌报道较少,目前主要集中在青霉属[19]、酵母属[20]、根霉属[21]、曲霉属[22]上。因此筛选出一株能够产酸性脂肪酶的真菌,成为微生物脂肪酶工业化生产中的迫切需求。本实验通过分离筛选,获得产脂肪酶菌株,根据ITS区基因序列的测序比对,同时结合形态学鉴定,确定该菌为毛霉属雅致放射毛霉。目前关于毛霉属菌株的报道主要集中在该属菌株所产的蛋白酶[23]上,对该属菌株产脂肪酶的研究报道甚少,而且该菌株具有耐酸性,易成活,发酵成本低等优势,尤其是在食品加工业[24]上该菌株具有较大的应用前景与研究价值。
3.2 产脂肪酶菌株的酶活力测定脂肪酶活力的检测,是脂肪酶在工业生产及科学实验中的一个重要指标,同时又是脂肪酶产生菌筛选过程中的一个关键步骤。目前检测脂肪酶活力的方法有多种,但常用的主要为以下3种:碱滴定法[25]、对硝基苯酚法[26]、铜皂法[27]。碱滴定法在使用时不好掌握其用量,其精确性及合理性常遭人质疑,而对硝基苯酚法与铜皂法在实验操作中因使用大量的苯而易对环境造成污染,同时又对人体造成伤害。本实验采用改进后铜皂-分光光度法进行脂肪酶活力检测,具有较高的精确性与稳定性,在脂肪酸萃取过程中用异辛烷代替苯,大大降低了实验过程中对环境造成的污染及对人体造成的伤害。
3.3 不同条件对产酶菌株的影响氮源对菌株产酶活性的影响,一些研究报道中多采用蛋白胨为最佳氮源,而本实验中真菌LZ-6菌株以酵母粉为最佳氮源,其产酶活性明显高于蛋白胨,出现此种原因,可能是因菌株种类不同所导致。实验中LZ-6菌株的适宜发酵产酶温度为30℃,与陈文强等[28]报道的真菌的发酵温度在30℃左右相一致。本实验中菌株的适宜发酵pH值为5,低于马宏瑞等[29]报道的 Teratosphaeriaceae Cr12 菌株的最适发酵pH值5.5,充分显示了该菌株的耐酸性。实验中接种量为2%时酶活力值为最大,当高于2%时,酶活力值下降,可能是由于高接种量导致菌群繁殖过快,制约了菌株的产酶能力。本实验分离出的嗜酸性菌株通过单因素实验与正交实验对其产酶条件进行优化,寻找出最优产酶组合,与其他工业用产脂肪酶菌株比较,该菌株产酶量相对较低,有待通过相关诱变方法,基因克隆与表达等操作,进一步提高产酶量,为酸性脂肪酶的开发、生产及应用奠定基础。
4 结论获得一株嗜酸性产脂肪酶真菌,通过形态学观察与分子生物学鉴定该菌株为雅致放射毛霉(Acinomucor elegans)。产酶最佳条件为:酵母粉1%、橄榄油2%、MgSO4·7H2O 0.05%、(NH4)2SO4 0.1%、K2HPO4 0.2%、温度30℃、pH5.0、接种量为2%、发酵5 d。通过正交实验该菌株LZ-6的产酶活力比优化前提高1.78倍。
| [1] | Messias JM, da Costa BZ, de Lima VMG, et al. Screening Botryosph-aeria species for lipases:Production of lipase by Botryosphaeria ribis EC-01 grown on soybean oil and other carbon sources[J]. Enzyme and Microbial Technology, 2009, 45(67):426-431. |
| [2] | 孙晓璐, 孙玉梅, 陈莉, 等. 不同酵母菌发酵产油脂及脂肪酶的研究[J]. 粮油加工, 2007, 8:80-82. |
| [3] | 李香春, 甄宗国. 脂肪酶特性及其应用[J]. 粮食与油, 2003, 3:19-20. |
| [4] | El Khattabi M, Van Gelder P, Bitter W, et al. Role of the lipase-specific foldase of Burkholdcria glumae as a steric chaperone[J]. Journal of Biological Chemistry, 2000, 275(35):268-291. |
| [5] | 王海燕, 李富伟, 高秀华. 脂肪酶的研究进展及其在饲料中的应用[J]. 饲料工业, 2007, 28(6):14-17. |
| [6] | 韩雪. 催化生物柴油生产的脂肪酶产生菌的筛选及其相关基因的研究[D]. 哈尔滨:黑龙江大学, 2008. |
| [7] | Dharmaraj S. Marine Streptomyces as a novel source of bioactive substances[J]. World Journal of Microbiology Biotechnology, 2010, 26(12):2123-2139. |
| [8] | 高蓓. 变形杆菌属脂肪酶的筛选、表征及基于理性设计的改造[D]. 上海:华东理工大学, 2010. |
| [9] | 杨军方. 产脂肪酶细菌的筛选与酶学性质的研究[D]. 南京:南京理工大学, 2004. |
| [10] | 张勇, 孙新城, 王开放, 等. 一株细菌产生的脂肪酶性质的研究[J]. 湖北农业科学, 2011, 50(1):53-55. |
| [11] | 滕宏飞, 王丹静, 徐青, 等. 橄榄油乳化法测定脂肪酶活性的优化研究[J]. 食品工业, 2011, 6:80-83. |
| [12] | 陈羽. 枯草芽孢杆菌高密度培养及保护剂的优化研究[D]. 哈尔滨:东北农业大学, 2011. |
| [13] | 侯爱军, 徐冰斌, 梁亮, 等. 改进铜皂-分光光度法测定脂肪酶活力[J]. 皮革科学与工程, 2011, 21(1):22-27. |
| [14] | Hobson PN, Summers R. Effect of growth rate on the lipase activity of a rumen bacterium[J]. Nature, 1966, 209:736-737. |
| [15] | 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社, 1979. |
| [16] | 燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J]. 中国卫生检验杂志, 2008, 18(10):1958-1961. |
| [17] | 郭威, 郭晓军, 袁洪水, 等. 高效脂肪酶产生真菌的筛选、鉴定及产酶条件的优化[J]. 饲料工业, 2013, 34(4):39-44 . |
| [18] | 刘光. 黑曲霉脂肪酶的分离纯化及其性质的研究[D]. 广州:华南理工大学, 2013. |
| [19] | Mhetras N, Bastawde K, Gokhale D. Purification and characterization of acidic lipase from Aspergillus niger NCIM 1207[J]. Bioresearch Technology, 2009, 100:1486-1490. |
| [20] | 李雪玲. 污水处理系统中酵母菌的种属分布及产酶特征研究[D]. 新乡:河南师范大学, 2013. |
| [21] | 马歌丽, 王建民, 彭新榜, 等. 发酵条件对根霉产脂肪酶的影响[J]. 食品科技, 2006, 8:39-42. |
| [22] | 李军红, 姜绍通, 童洋洋. 产脂肪酶真菌的筛选及产酶条件优化[J]. 安徽农业科学, 2011, 39(26):15840-15842. |
| [23] | 刘芳, 曹新志, 游见明, 等. 毛霉高产蛋白酶菌株产酶条件的优化[J]. 食品与发酵科技, 2011, 8(1):40-43. |
| [24] | Yegin S, Fernandez-Lahore M, Jose Gama Salgado A, et al. Aspartic proteinases from Mucor sp in cheese manufacturing[J]. Applied Microbiology and Biotechnology, 2011, 89(4):949-960. |
| [25] | 夏宇, 周文化, 邓学良, 等. 脂肪酶高产菌株的筛选及产酶条件的优化[J]. 中南林业科技大学学报, 2013, 9:116-120. |
| [26] | Takeshi Suzuki, Tour Nakayama, Tatsuo Kurihara, et al. A cold-active esterase with a substrate preference for vinyl esters from a psychrotroph, Acinetobacter sp. strain No. 6:Gene cloning, spurification, and characterization[J]. Journal of Molecular Catalysis B, Enzymatic, 2002, 16(5-6):255-263. |
| [27] | 江慧芳, 王雅琴, 刘春国, 等. 三种脂肪酶活力测定方法的比较及改进[J]. 化学与生物工程, 2007, 24(8):72-75. |
| [28] | 陈文强. 发酵条件对产酶的影响[J]. 中国医药指南, 2014, 14:65-67. |
| [29] | 马宏瑞, 罗茜, 朱超. 制革污泥中产脂肪酶真菌的筛选及产酶条件的优化[J]. 陕西科技大学学报, 2013, 31(6):25-31. |