植物内生菌是指那些在生活史的一定阶段或全部阶段生活于植物组织内,不引起宿主植物明显感染症状的微生物[1]。主要包括细菌、真菌和放线菌。几乎所有植物中都存在内生菌,它们主要存活于植物细胞内或细胞间隙的特殊环境中,种类丰富。由于植物内生菌与植物之间长期的共生关系,使得这类微生物的功能和活性有别于其他环境中的微生物。除了具有对植物的促生长[2]和赋予植物抗逆性[3]的作用之外,一些植物中的内生菌还可以产生同植物宿主相同或者相似的活性物质,是潜在的微生物药物开发资源。随着抗生素和防腐剂的大量使用,耐药性菌株大量产生,开发新的抑菌活性物质迫在眉睫。
柴胡味苦、性微寒。归肝、胆经。有疏散退热,舒肝,升阳之功能。用于感冒发热,寒热往来,疟疾,胸胁胀痛,月经不调,子宫脱垂,脱肛等症。近代研究多用于治疗流感病毒、结核杆菌、疟原虫所引起的疾病。近年来,国内学者对柴胡种植、快繁、保健作用及活性成分方面进行了广泛研究,如沈亮亮等[4]在对柴胡抗菌成分进行研究时发现柴胡皂苷Bp3在体外具有广谱抗菌活性,刘泽坤等[5]发现烟台柴胡地上部分提取出的挥发油具有广谱抗菌活性。在柴胡内生菌研究方面,高宁等[6]进行了狭叶柴胡内生真菌分布特征的研究,未对内生真菌进行抑菌活性研究。孙月[7]也进行了柴胡内生真菌的分离,分离到3株内生真菌,但未见有抑菌活性报道。
本研究以四川省甘孜藏族自治州的柴胡为材料,从其各个部位大量分离内生真菌,并对其进行形态方面的初步鉴定和抗菌活性筛选,旨在寻找具广谱抗菌活性的内生真菌奠定基础。
1 材料与方法 1.1 材料药用植物标本:一株健康柴胡植株采自四川省甘孜藏族自治州。采集的新鲜植物样品4℃保存,48 h内处理。
供试指示菌:大肠埃希菌(Escherichia coli)购自中国工业微生物菌种保藏管理中心,枯草芽孢杆菌(Bacillus subtilis)和金黄色葡萄球菌(Staphylococcus aureus)为重庆工贸职业技术学院微生物实验室保存。
培养基:PDA培养基(马铃薯葡萄糖培养基)配方:马铃薯200 g,葡萄糖20 g,琼脂18 g,水1 000 mL,马铃薯去皮,切成小块煮沸30 min,用纱布过滤得滤液,加入糖及琼脂,溶化后补足水至1 000 mL,121℃灭菌30 min。
1.2 方法 1.2.1 材料的表面消毒分别将柴胡根、茎、叶流水冲洗5 h后,晾干放入干净的烧杯里,用75%酒精浸泡2 min,无菌水冲洗3次,再用5.4% NaClO溶液浸泡一定时间(叶5 min,根、茎浸泡10 min)后,无菌水冲洗3次,最后一次冲洗液留下备用。
1.2.2 内生真菌的分离和纯化用无菌滤纸将各材料水分吸干后,分别称取2 g,加10 mL无菌水研磨 后,取上清液0.1 mL涂布在PDA平板上,倒放于28℃培养7 d。
待平板上菌落长出,根据菌落形态、颜色、边缘状态、透明度、表面干湿状态等特征判断分离出的菌落种类并计数,用平板划线及直接用接种针取尖端菌丝等分离纯化方法,经过反复的分离、纯化,直至得到纯化的典型菌落。
将已纯化的菌株分别转接到斜面培养基上培养,待菌株生长旺盛时。取出置4℃保藏。
1.2.3 消毒可靠性检验 1.2.3.1 漂洗液培养把最后一次漂洗消毒材料的漂洗液吸取0.1 mL涂布于PDA平板上进行培养,观察培养结果。
1.2.3.2 组织印迹检查用灭菌镊子夹住已消毒灭菌过的供试植物组织小片,使其表面与相应固体培养基接触几分钟后取出,置于相同条件下培养1周,观察培养基上是否有菌落生长。良好的消毒灭菌效果,培养基上应该均无任何微生物生长。
1.2.4 内生真菌的形态学鉴定 1.2.4.1 点植培养法(观察真菌菌落及常规镜检)用接种针从斜面上蘸极少量孢子。点植于平板上适当的位置,使成三角形的3点,倒放于28℃恒温箱中培养10 d,观察菌落大小、颜色、表面纹饰、质地、边缘形状等。
1.2.4.2 小室培养法将菌种接种在小室边缘,28℃恒温箱中培养,在光学显微镜下观察记录菌丝和孢子的形态特征,依据真菌的形态分类学方法,初步确定分离菌株的种属地位。
1.2.4.3 分离频率种属确定后,用分离频率(Isolation frequency,IF)比较和判断优势菌群。分离频率:分离到的某一指定类型内生真菌的菌株数量占分离的内生真菌菌株数量的百分率。
1.2.5 抑菌实验 1.2.5.1 抗菌活性菌株的初筛待检内生真菌培养:挑取经活化的内生真菌菌丝或孢子点接至PDA固体平板中央,28℃恒温培养7 d,备用。
指示菌培养:将抑菌实验指示菌枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌分别接种于牛肉膏蛋白胨斜面上,37℃培养18 h,用无菌水分别制备成浓度约为105-106 CFU/mL的菌悬液。
抑菌实验:采用琼脂块法[8]。取浓度为105-106 CFU/mL的3种指示菌菌悬液0.1 mL,分别接种于牛肉膏蛋白胨平板上,涂布均匀。用打孔器从PDA平板上生长的待检内生真菌菌落上截取直径为6.0 mm的琼脂块,用无菌镊子将琼脂块菌面朝上直接放置于含有不同指示菌的平板上,每株内生真菌作3个重复,35℃培养18 h,观察抑菌圈。
1.2.5.2 抗菌活性菌株的复筛指示菌培养:将抑菌实验指示菌枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌分别接种于牛肉膏蛋白胨斜面上,37℃培养18 h,4℃保存备用。
待检内生真菌液体培养及发酵液处理:液体培养采用马铃薯葡萄糖液体培养基(PDB)。在250 mL三角瓶中装入100 mL培养基,灭菌冷却后,将初筛抑菌效果较好的菌种接入三角瓶中,28℃,130 r/min,培养3 d。无菌条件下取发酵液5 mL于离心管中,8 000 r/min离心5 min,收集上清作抑菌实验,不接种的液体培养基作同样处理,作为阴性对照。
抑菌复筛:采用双层平板法[9]。倒底层培养基,约15 mL,待凝;制备菌层培养基:10 mL无菌冷却生理盐水加入3种指示菌斜面上,将菌苔洗下,打散,制备成菌悬液,在经灭菌冷却至60℃左右的牛肉膏蛋白胨琼脂培养基中分别加入适量的3种指示菌菌悬液,使其浓度约为106 CFU/mL,倒平板。在双层平板上放置牛津杯,使其自然下沉10 min;将离心后的待检内生菌上清液加入牛津杯中,每只牛津杯加入100 μL,每种待检上清液3个重复。以阴性发酵液作对照。放入4℃冰箱预培养7 h,后转入30℃培养箱培养16 h,观察并测量抑菌圈的直径。
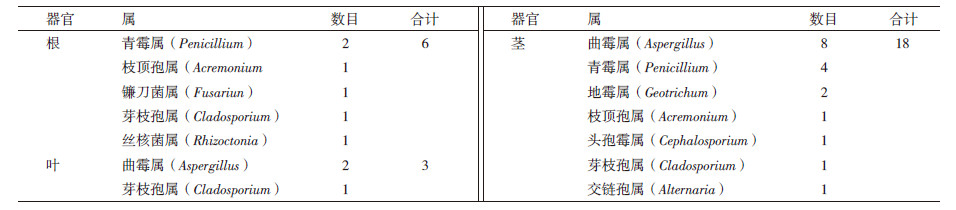
2 结果 2.1 柴胡内生真菌的组成从柴胡根、茎、叶中共分离到内生真菌27株,其中6株来自于根部,18株来自于茎,3株来自于叶。经菌落形态以及小室镜检,参照《真菌鉴定手册》,经初步鉴定分别属于9个属,说明内生真菌在柴胡中普遍存在(表 1和图 1)。其中青霉属(Penicillium)和曲霉属(Aspergillus)较普遍,分别占分离菌株总数的37.04%和22.22%,为优势种群;芽枝孢属(Cladosporium)其次,所占比例为11.11%;枝顶孢属(Acremonium)和地霉属(Geotrichum)所占比例均为7.41%;其他属只有1株,为稀有属,见表 2。
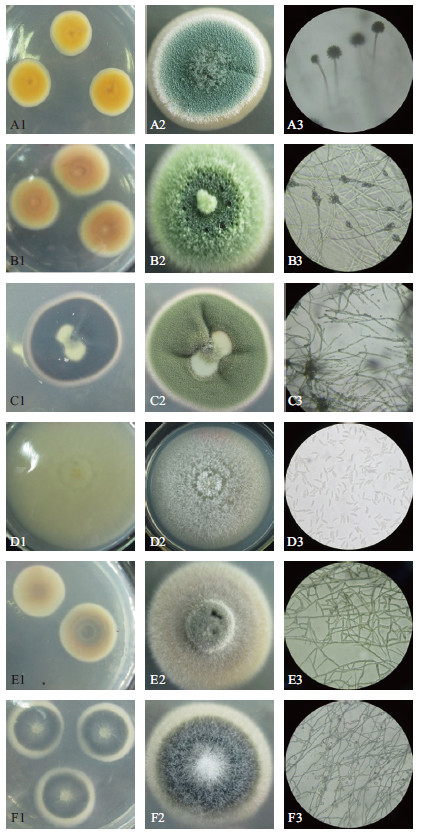 |
| A-F :曲霉属、青霉属、地霉属、镰刀菌属、丝核菌属、头孢霉属;1-3 :每属真菌的菌落背面形态、正面形态和孢子或分生孢子头形态 图 1 部分内生真菌菌落及孢子或孢子头形态 |
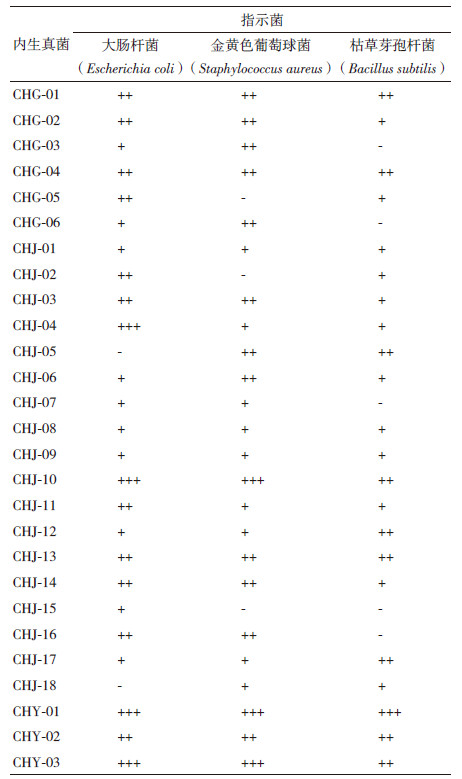
用琼脂块法对分离到的27株内生真菌进行抗菌活性初选,结果(表 3)表明,26株内生真菌对两种或3种指示菌均具有抑菌活性,占分离菌株总数的96.30%,说明柴胡内生真菌中存在着天然抑菌资源。
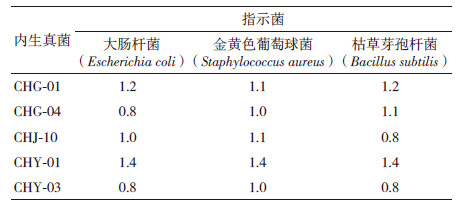
选择初筛时对3种指示菌抑菌效果均较好的5株内生真菌:CHG-01、CHG-04、CHJ-10、CHY-01和CHY-03,采用管碟法对其进行复筛,结果(表 4)显示,5种内生真菌发酵上清液对3种指示菌均有一定的抑菌活性,其中对3种指示菌抑菌效果都最好的为CHY-01(图 2),其次为CHG-01。
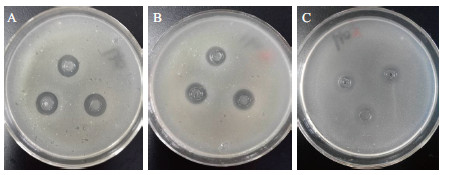 |
| A :枯草芽孢杆菌(Bacillus subtilis);B :金黄色葡萄球菌(Staphylococcus aureus);C :大肠杆菌(Escherichia coli) 图 2 CHY-01 对3 种指示菌的抑菌效果 |
目前测定内生菌抑菌活性时采用的方法有琼脂块法、滤纸片法[10]、平板孔阱扩散法[11]、双层平板法等,研究过程中复筛采用了双层平板法,该方法影响因素较多,实验结果重现性较差,在实验过程中,为了使复筛能够出现清晰的抑菌圈,对影响柴胡内生真菌抑菌活性物质效价测定的主要因素(加液量、琼脂浓度和培养方式)进行了分析。关于加液量的多少,在研究过程中发现,若将牛津杯加满,18 h后杯内有近一半的残留溶液,因此在实验过程中,将牛津杯加液量调整为100 μL保证能够渗透完全。琼脂浓度也会影响抑菌活性物质的扩散,Sebt[12]在模拟nisin于琼脂糖凝胶中扩散时发现,琼脂糖浓度增加可使凝胶孔径狭小致密,影响nisin在琼脂糖中的扩散;而琼脂糖浓度过低时,培养基不易凝固,且牛津杯易陷于培养基内,增加nisin扩散的困难[13]。因此在实验的过程中,将培养基中添加不同琼脂浓度1.1%、1.3%、1.5%和1.8%,考察抑菌活性物质的渗透情况,结果发现:琼脂浓度越小,渗透量越多,越易出现清晰地抑菌圈,因此在管碟法复筛时采用了1.1%琼脂浓度。张国只等[14]发现低温预培养非常有利于提高琼脂扩散法的测定效果。在本研究中,4℃预培养8 h后再进行培养比直接进行培养更能增加抑菌圈的清晰度。
药用植物内生菌的分布既受寄主植物影响,又受环境影响。同一种植物在不同的地理区域具有不同的内生菌类群分布,同一种植物在同一地区的内生菌类群基本相似,但是不同年龄植株和组织上的内生菌丰度和分布明显不同。从环境角度(海拔、土壤、温度、湿度、pH等)来讲,内生真菌类群的分布也受宿丰植物树冠的高度和郁闭度影响[15]。与高宁等[6]的狭叶柴胡内生真菌分离结果(13株,无优势属,根茎叶无相同属的内生真菌)不同,本研究分离到的内生真菌中,有优势属(青霉属和曲霉属),并且叶和根、叶和茎中均分离到了一株相同形态的真菌。
影响内生真菌分离结果的因素比较多。首先在体外培养内生菌的过程中,很难将药用植物体内的微生物全部分离出来。这主要是因为就目前的技术而言,人工培养环境不可能完全模拟植物体内环境。例如,内生真菌在体外大多数采用PDA培养基进行分离,这与植物体内复杂的环境完全不同,而且不同的植物体内环境也不同。事实上,同样的植物样品在不同的培养基能分离得到的微生物种类和数量差别较大[16]。即使用不同的培养基来分离植物组织的内生菌,也不能保证所有生活在植物体内的内生菌全部被分离出来,因为有的内生菌不能在人工培养基上培养[17]。另外,研究方法对内生真菌多样性结果也有一定的影响,刘淮等[18]考察了不同研究方法对真菌多样性结果的影响,认为在内生真菌研究中,采用单一的研究方法可能会导致植物组织内生真菌多样性被低估,将组织块分离培养方法和分子生物学方法结合起来将会更全面地反映植物内生真菌的多样性。
4 结论从柴胡植株体内分离到了27株内生真菌,青霉属和曲霉属是优势种群。26株内生真菌对两种或3种指示菌均具有抑菌活性,占分离菌株总数的96.30%,其中两株抑菌效果良好,具有潜在的开发价值。
| [1] | Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994, 372 (6505):425-432. |
| [2] | Chaintreuil C, Giraud E, Prin Y, et al. Photosynthetic bradyrhizobia are natural endophytes of the African wild rice Oryza breviligulata [J]. Appl Environ Microbial, 2000, 66(12):5437-5447. |
| [3] | Chen C, Bauske EM, Musson G, et al. Biological control of Fusarium wilt on cotton by use of endophytic bacteria[J]. Biological Control, 1995, 5(1):83-91. |
| [4] | 沈亮亮. 抗真菌新药筛选方法的建立及柴胡抗菌成分初步研究[D]. 上海:同济大学医学院, 2006. |
| [5] | 刘泽坤, 陈海霞, 李兵兵, 等. 烟台柴胡挥发油的GC-MS分析及抑菌活性研究[J]. 中国实验方剂学杂志, 2011(21):123-126. |
| [6] | 高宁, 王强, 王振月, 等. 狭叶柴胡内生真菌分布特征的研究[J]. 中国林副特产, 2012(1):10-11. |
| [7] | 孙月. 抑菌内生真菌的分离及人参内生菌抑菌活性物质初步研究[D]. 长春:吉林农业大学, 2007. |
| [8] | 林敏, 宁喜斌. 抑菌活性海洋微生物的筛选[J]. 微生物学杂志, 2005, 25(5):23-25. |
| [9] | 王玉君, 崔晋龙, 苏红, 等. 远志内生真菌抑菌活性筛选[J]. 微生物学通报, 2009, 36(3):404-411. |
| [10] | 张传博, 陈荣林, 殷幼平, 等. 金荞麦和苦荞麦抗菌活性内生真菌的筛选及鉴定[J]. 微生物学通报, 2011, 38(1):70-77. |
| [11] | 刘小莉, 周剑忠, 黄开红, 等. 古银杏内生真菌的分离及其抑菌活性[J]. 微生物学通报, 2009, 36(10):1513-1518. |
| [12] | Sebti I, Blanc D, Carnet-Ripoche A, et al. Experimental study and modeling of nisin diffusion in agarose gels[J].Journal of Food Engineering, 2003, 63(2):185-190. |
| [13] | 伊守亮, 肖林, 顾正华, 等. 管碟法测定Nisin效价[J]. 无锡轻工大学学报, 2004, 2(4):41-45. |
| [14] | 张国只, 陈林海, 杨天佑, 等. 琼脂扩散法测定乳链菌肽效价的优化[J]. 食品科学, 2007, 28(3):175-178. |
| [15] | 范丽霞, 郑继平, 白新鹏. 药用植物内生菌及其对道地药材影响的研究进展[J]. 安徽农业科学, 2012, 40(22):11221-11223, 11467. |
| [16] | 王志伟, 陈永敢, 王庆璨, 等. 中国植物内生微生物研究的发展和展望[J]. 微生物学通报, 2014, 41(3):482-496. |
| [17] | 周松林, 陈双林, 黄风迎, 等. 一株具有抗疟活性的金鸡纳树内生真菌的研究[J]. 菌物学报, 2013, 32(2):309-313. |
| [18] | 刘准, 陶刚, 刘作易, 等. 兰科植物黄花白及Bletilla ochracea内生真菌多样性分析[J]. 菌物学报, 2013, 32(5):812-818. |