RNA干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链RNA(Double-stranded RNA,dsRNA)引发的同源基因特异性沉默现象。RNA干扰的可传播性又称非细胞自主性,是指沉默效应可以由最初产生dsRNA的细胞或组织向其他细胞或组织进行扩散,也可以在生物个体间进行传播,从而使非产生dsRNA的细胞、组织或生物体发生沉默效应。在植物中关于沉默效应可以通过嫁接点发生长距离传递,以及在胞间局部扩散的现象早有报道[1, 2],虽然当时这种沉默信号不能被直接检测到,但沉默效应的序列特异性暗示沉默信号中涉及RNA组分。RNA干扰现象在线虫中的阐明及其表现出的扩散效应进一步证明了RNA分子在介导系统性沉默中所起的作用[3],然而对该类胞间RNA分子的特性了解一直较少。近年来对非细胞自主性RNAi(Non-cell-autonomous RNAi)的研究使一系列胞间小RNA分子被发现和鉴定,明确了不同类型的小RNA分子包括小干扰RNA(Small interfering RNAs,siRNAs)中的异染色质siRNA(Heterochromatic siRNAs,hc-siRNAs)、反式作用siRNA(Trans-acting siRNAs,tasiRNAs)和病毒及转基因来源的siRNAs以及内源微小RNA(MicroRNAs,miRNAs)等均可以作为信号分子介导沉默效应的传递。与激素和胞间转录因子相类似,通过传递胞间信息,植物非细胞自主性小RNA在调控发育模式、响应环境胁迫、增强病毒抗性和维持转座子的沉默方面发挥了重要作用。本文综述了近年来在植物非细胞自主性RNAi研究中取得的主要进展,主要介绍了通过韧皮部和胞间连丝途径传递沉默信号的各种小RNA分子及其生物学作用、非细胞自主性小RNA的分子特征和运输效率的调控,并对存在的问题及其研究前景进行了展望。
1 通过韧皮部运输的小RNA植物中沉默信号的长距离传递需要依靠维管组织,且沉默效应的传递方向一般是由光合组织(源)向根和生长中心(库)方向移动,因此最可能通过韧皮部运输[4]。对植物韧皮部汁液的测序中能检测到丰富的miRNA和18-25 nt的各种siRNA[5],而在木质部汁液中却检测不到RNA分子[6],说明通过韧皮部运输的小RNA分子可能参与基因表达的长距离调控。
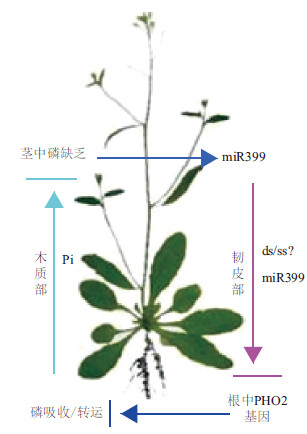
植物中的miRNA由内源miRNA基因(MIR)产生,MIR首先被RNA聚合酶Ⅱ(RNA polymerase II,Pol II)转录成初级转录产物(pri-miRNA),再由DCL(Dicer-like protein)家族蛋白DCL1经两轮切割形成成熟的miRNA,miRNA产生后与效应蛋白AGO1(Argonaute1)结合作为RNA诱导的沉默复合体(RNA-induced silencing complex,RISC)的核心组份切割靶mRNA或抑制其转录[7]。在油菜韧皮部汁液内检测到的miRNA中,miR395、miR398和miR399分别受硫酸盐、铜离子和磷饥饿的诱导[6],说明miRNA可能作为胁迫响应因子传递长距离信号。在拟南芥中miR399由地上部分产生,其靶基因PHO2(PHOSPHATE 2)在根中表达并编码一种泛素结合酶E2以调控体内磷平衡。在对拟南芥的微嫁接实验中,过表达miR399的接穗嫁接到野生型的砧木上,在嵌合体根中可以检测到丰富的miR399,说明miR399产生后由地上部分向根中进行运输;嵌合体根中PHO2转录本水平下降且地上部分检测到大量磷积累,这与pho2突变体作砧木的嵌合体表型一致,表明在磷缺乏下miR399被诱导产生并作为信号分子经韧皮部运送到根中,通过抑制PHO2的表达增强磷的吸收和转运[8, 9](图 1)。
病毒侵染植物后,植物可通过多种DCL蛋白识别并切割病毒来源的dsRNA产生不同长度的siRNA,这些siRNA通过维管系统或胞间连丝先于病毒运送到未感染细胞中以获得对该病毒的免疫能力,当该病毒扩散时,RNA病毒可被DCL4切割而成的21 nt siRNA识别并降解,而DNA病毒则被DCL3依赖的24 nt siRNA介导起始甲基化[10],因此沉默信号的系统性传递可以将病毒隔离在茎顶芽和分生组织之外[11]。病毒在长期的进化中也产生了应对策略,如产生病毒沉默抑制子(Silencing suppressors)以阻碍RNA干扰的作用或传递过程[12],沉默抑制子的作用模式反过来也证明了非细胞自主性的siRNA在抗病毒中发挥作用。
植物中的异染色质siRNA(hc-siRNAs)由基因组中的转座子等重复DNA序列区域产生。在hc-siRNA合成途径中,由RNA聚合酶Ⅳ(RNA polymerase Ⅳ,Pol Ⅳ)转录出的非编码RNA首先被RNA依赖的RNA聚合酶2(RNA-dependent RNA polymerase 2,RDR2)复制成RNA双链,该双链结构可以被DCL3识别并切割成24 nt的hc-siRNA[13]。24 nt的hc-siRNA产生后可以与AGO4/6/9结合并被招募回其源头处引发DNA甲基化和转录水平沉默,还可以随光合同化物一起被运到分生组织中使非自身细胞中的染色体同源序列发生沉默。siRNA的移动可能将环境信息传递给这些组织以调控成花转化[14]或胁迫响应[15]等,还可能通过介导表观修饰的改变使分生组织将环境的变化信息传递给后代,这对于胁迫环境下后代种群的繁衍意义重大[16]。
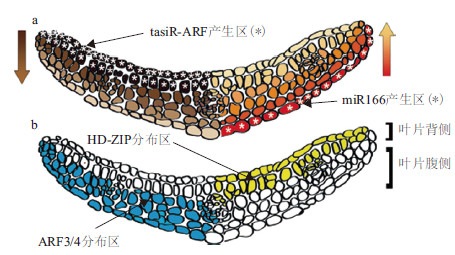
2 通过胞间连丝扩散的小RNA在沉默信号的短距离扩散中可能存在共质体和质外体两条途径,其中通过胞间连丝相连的共质体途径被证明最可能介导沉默信号的传递[17]。应用原位杂交技术或荧光标记技术可以直接检测到小RNA的短距离扩散,而通过报告基因沉默所引发的表型变化也可以获得小RNA扩散的信息。由于细胞自主性的miRNA在生长发育过程中具有广泛调控作用[18],这暗示非细胞自主性miRNA也可能具有类似功能。近年来多个参与发育模式调控的胞外miRNA被鉴定,使miRNA成为胞间小RNA信号分子的典型。miR166和miR165仅一个碱基不同,可以通过调控植物中一类HD-ZIPⅢ(Class III homeodomain-leucine zipper)转录因子而参与多种生长发育过程[19]。在拟南芥根发育过程中,中柱细胞中产生的转录因子SHR(SHOOT-ROOT)通过胞间连丝向外扩散到内皮层细胞中并与SCR(SCARCROW)互作激活miR165/166前体的转录。成熟miR165/166产生后通过胞间连丝向周围细胞扩散,导致其靶基因PHB(PHABULOSA)形成与之相反的浓度梯度,在中柱内侧细胞中丰度最高,向外侧逐渐降低,到内皮层细胞中则完全被降解。由于PHB在低浓度下促进初生木质部合成,高浓度下促进次生木质部合成,因此位于中柱外侧的细胞发育成初生木质部,而靠内侧的细胞发育成次生木质部[20, 21](图 2)。在叶片发育过程中,miR166还参与叶片极性(背腹性)的调控[22],miR166在叶原基腹面表皮细胞产生并向背面扩散,导致HD-ZIPⅢ只在叶原基背面积累而在腹面被降解,HD-ZIPⅢ作为转录因子通过调控下游基因促进了叶片背面细胞的发育命运(图 3)。
与miR165/166一同决定叶片发育极性的还有一类反式作用siRNA(tasiRNAs)。tasiRNAs是一类由miRNA引发产生的次级siRNA分子[23],在其合成过程中,内源TAS位点转录产生的初级转录本首先被miRNA介导的沉默复合体识别并切割,形成的单链片段随后被RNA依赖的RNA聚合酶6(RDR6)复制成双链结构并被DCL4依次切割成具有相位特征的siRNA,由于这些siRNA能够与AGO1结合对TAS以外的同源基因进行转录后水平沉默,因此称为反式作用siRNA。tasiR-ARF是一类由miR390引发的ta-siRNA分子,因其产生后作用于ARF(AUXIN RESPONSE FACTOR)而得名。miR390合成后可扩散至叶原基背面最外侧的两层细胞中并通过细胞自主性的AGO7作用于TAS3产生21 nt的ta-siRNA[24]。tasiR-ARF产生后可向叶片腹面扩散,通过浓度效应将其靶标基因ARF3和ARF4合成限制在叶片腹面[25]。与HD-ZIPⅢ的作用相反,ARF3/4调控了叶片腹面细胞的发育(图 3)。tasiR-ARF与miR166通过在叶片背腹面分别以浓度梯度效应调控ARF3/4和HD-ZIPⅢ的定位并依赖两者之间复杂的相互作用调控了叶片的极性发育[26, 27],小RNA这种通过胞间扩散以浓度效应调控靶基因表达的作用方式与动物形态素非常类似。
最近的研究发现miR394可以作为短距离信号分子维持茎顶端分生组织(Shoot apical meristem,SAM)的干细胞特性。miR394在SAM和子叶的最上层细胞中产生并向内层细胞扩散使其靶基因LCR(LEAF CURLING RESPONSIVENESS)在SAM最顶端的三层细胞中被降解,结果这些细胞获得了响应下方组织中心中产生的干细胞促进因子WUS(WUSCHEL)的能力,从而在持续的分裂中保持干细胞活性而不发生分化[28](图 4)。近来研究还发现miR394在促进叶片形态发育方面也起到重要作用,其可能与miR166、tasiR-ARF一起调控了叶片的发育极性[29]。除胞间连丝外,小RNA的短距离扩散还可能通过其他途径。在种子萌发过程中胚乳细胞转座子活化产生的hc-siRNA能够进入胚胎细胞中帮助其维持转座子的沉默[30],由于胚乳与胚胎细胞间不存在胞间连丝,参与该过程的小RNA分子很可能通过质外体途径。在配子发生过程中花粉营养核中转座子活化产生的hc-siRNA能进入生殖核中促进其转座子的沉默[31],而该过程需要穿越生殖-体细胞屏障,其具体传递途径尚不清楚。植物中可能存在类似线虫SID家族的特异膜转运蛋白或通道蛋白进行胞间小RNA的运输[32, 33, 34],但在植物中至今尚未发现该类蛋白。
3 非细胞自主性小RNA的分子特征高通量测序技术的应用使得对胞间小RNA进行检测成为可能,通过从韧皮部汁液丰富的植物中获取少量汁液进行测序,可以直接对韧皮部中的小RNA进行检测[6, 35];而对拟南芥等无法获得韧皮部汁液的植物也可以利用嫁接实验检测通过嫁接点传递的小RNA分子[36]。
在韧皮部汁液中可以检测到包括miRNA和siRNA在内的多种类型的小RNA[5, 6]。在检测到的miRNA中,既包括miRNA的引导链也包含miRNA随从链,说明miRNA在结合到AGO之前可能存在双链运输的形式,然而随从链的数量低于引导链,表明miRNA在运输前或运输过程中发生了链的选择,且引导链优先于随从链被运输[5, 6]。Molnar等[36]通过巧妙设计的嫁接实验结合二代测序技术鉴定出了拟南芥中长距离运输的siRNA分子。他们以不能产生siRNA的dcl2/3/4三重突变体的拟南芥根为砧木,以野生型拟南芥茎叶部分作接穗进行嫁接,对根中的小RNA进行高通量测序检测到了来自接穗的21-24 nt siRNA,且对接穗和砧木的高通量测序结果还表明参与长距离运输的siRNA可能在运输前已经发生了链的选择且偏向于运输24 nt的siRNA[36]。
为鉴定短距离扩散的小RNA分子特性,Dunoyer等[37]通过粒子轰击的方法将荧光标记的双链siRNA分子导入细胞中,一定时间后可以观察到荧光向周围细胞进行扩散,而相同长度的单链则不发生扩散,证明胞间短距离运输是以双链siRNA形式。但由于体外注射的游离RNA单链可能易降解,因此不能完全排除单链运输的可能性。如果单链形式的小RNA可以参与胞外运输,其可能以形成蛋白复合体的形式如与AGO蛋白相结合进行运输以避免被胞外核酸酶降解,但AGO蛋白的细胞自主性表明其不可能参与小RNA的胞外运输[37],Yoo等[5]在南瓜等植物的韧皮部中发现了一种小RNA结合蛋白PSRP1,该蛋白可以特异的结合25 nt的单链小RNA分子而不能与双链小RNA结合,其可能介导了小RNA的长距离运输。
在小RNA的长度特征方面,无论是在长距离运输还是在短距离运输中都能同时检测到21 nt和24 nt的siRNA,但它们在两种运输途径中发挥的作用却完全不同。在长距离运输中只有24 nt的siRNA起到传递沉默信号的作用[36],相反短距离沉默效应的扩散仅依靠21 nt的siRNA作为信号分子[37],这表明具有非细胞自主性的小RNA分子不一定都可以作为信号分子存在,与激素的识别相类似,其能否发挥沉默效应可能由受体细胞的类型决定。值得注意的是,除小RNA分子外,前体RNA分子也可能具有非细胞自主性。部分小RNA前体可能具有非细胞自主性长链RNA的分子特征使其可以在胞外运输[38]。长链小RNA前体可能同DCL蛋白等一同被输送到胞外,在其进入受体细胞中后被DCL蛋白切割成小RNA分子发挥调控功能。已有研究中既有支持小RNA前体参与运输的证据[39],也有证明其不具有可运性的报道[9, 37],小RNA前体是否具有非细胞自主性还需进一步研究。
4 小RNA运输效率的调控小RNA在源头处的丰度可能是影响其扩散距离的主要因素之一。在Dunoyer等[37]的研究中,转基因产生的siRNA可以穿过10-15层细胞的距离,而内源具有调控作用的小RNA扩散距离则小的多,如miR394只能穿过大约三层细胞[28],tasiR-ARF和miR166则能扩散到其周围的4-6层细胞中[26, 40],该扩散能力的差异可能与小RNA自身丰度有关,已有研究证明小RNA的扩散距离与其丰度间存在正相关[41]。小RNA的丰度由其合成和降解的速率决定,虽然对小RNA合成的过程和涉及的组分已经比较清楚,但对小RNA合成中的调节因子包括基因转录过程中和成熟小RNA加工过程中的调节还都不清楚。此外,影响小RNA的降解的因素也会影响其扩散距离,已知小RNA的降解可能和AGO装载[42]及靶序列切除[43]相关,但不清楚其降解是否与运输过程相关联[44]。
多种细胞自主性蛋白也会选择性的调节某些小RNA的运输。胞内蛋白可能通过选择性的将某种小RNA隔离到某一亚细胞结构中阻止其扩散,已知经ta-siRNA途径产生的小RNA较miRNA途径产生的相同小RNA扩散距离更远[41],由于ta-siRNA在细胞质中合成,而miRNA合成的关键步骤在细胞核中[44],因此参与miRNA外运的核转运蛋白如HST(HASTY)等可能起到了上述作用[45]。此外细胞质中的各种蛋白质也可能通过直接结合小RNA而阻碍其扩散,如拟南芥中细胞自主性的AGO10被证明可以阻断miRNA的运输。AGO10在SAM下方的维管束结构中表达,其可以与AGO1竞争miR166,但AGO10不具有催化活性,其作用类似套索或诱饵,通过隔离miR166使之不能扩散到顶端分生组织最上层细胞,这些细胞得以在持续的分裂中保持其干细胞的活性而不发生分化[46](图 5-a),而在AGO10的突变体中miR165/6扩散到上述细胞中积累导致顶端分生组织停止分裂[47](图 5-b)。
胞间连丝是相邻细胞间物质和信息交流的重要通道,小到离子、糖类和激素,大到蛋白质、病毒颗粒等均可以通过该途径运输。由于不同细胞和组织的胞间连丝孔径和密度各不相同且受发育和环境胁迫的调控[48, 49],因此胞间连丝可能在调控小RNA分子运输上起到重要作用。事实上,不同组织中胞间连丝的开放程度与沉默的扩散速度存在较好的相关性[50],然而通过遗传学筛选的方法并未获得通过调控胞间连丝而影响小RNA运输的因子,这可能是因为胞间连丝对维持正常的生长发育起到关键作用以至于相关突变体难以存活[16]。
许多病毒沉默抑制子也可以特异抑制沉默信号的运输,如源于兰花花叶病毒的P19可以特异的与21 nt的siRNA结合,通过在供体细胞中阻断21 nt小RNA的外运从而抑制沉默效应的短距离扩散[37];黄瓜花叶病毒抑制子2b(Cmv2b)则能通过结合24 nt的siRNA和多种AGO蛋白以抑制沉默效应的长距离传递[51, 52]。小RNA的运输还可能受到多种未知因素的影响,如膜结构中可能的转运蛋白或通道蛋白等可能会选择性的控制小RNA进出细胞。可以肯定的是小RNA运输的调控是一个复杂而严密的过程,已知或未知的因素必须准确的识别小RNA的特征信息并结合发育环境、外界因素变化等信息精准的调控其运输效率,而小RNA自身的特性如合成途径、分子结构、序列信息、碱基修饰和随从链的稳定性等均有可能是影响其运输效率的因素[27, 53]。
5 展望植物利用具有非细胞自主性的小RNA作为胞间信号分子并不令人惊奇,因为其提供了一个可以传递高度特异性信息的灵活平台,结合RNA干扰的高效性,植物可以快速而严密的“开关”其下游反应。虽然近年来一系列重要研究的发表初步阐明了植物非细胞自主性小RNA的分子基础,但对许多细节问题仍不清楚,如胞外小RNA是以双链还是单链的形式被运输,胞外单链小RNA是否会形成蛋白复合体,小RNA的哪些特征赋予其可运性,是否存在主动运输以及长链RNA分子能否作为胞间沉默信号等问题还有待进一步研究。测序技术尤其是针对单细胞测序技术的快速发展可以极大的方便人们对小RNA的移动进行追踪并将其与下游反应相联系[54],结合原位检测技术的进步,越来越多的参与小RNA运输的辅助因子将会得到鉴定。
| [1] | Voinnet O, Baulcombe DC. Systemic signalling in gene silencing[J]. Nature, 1997, 389(6651):553. |
| [2] | Palauqui JC, Elmayan T, Pollien JM, et al. Systemic acquired silencing:transgene-specific post-transcriptional silencing is transmitted by grafting from silenced stocks to non-silenced scions[J]. The EMBO Journal, 1997, 16(15):4738-4745. |
| [3] | Fire A, Xu SQ, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391(6669):806-811. |
| [4] | van Bel AJE. The phloem, a miracle of ingenuity[J]. Plant, Cell & Environment, 2003, 26(1):125-149. |
| [5] | Yoo BC, Kragler F, Varkonyi-Gasic E, et al. A systemic small RNA signaling system in plants[J]. The Plant Cell Online, 2004, 16(8):1979-2000. |
| [6] | Buhtz A, Springer F, Chappell L, et al. Identification and characterization of small RNAs from the phloem of Brassica napus[J]. The Plant Journal, 2008, 53(5):739-749. |
| [7] | Chen X. MicroRNA biogenesis and function in plants[J]. FEBS Letters, 2005, 579(26):5923-5931. |
| [8] | Pant BD, Buhtz A, Kehr J, et al. MicroRNA399 is a long-distance signal for the regulation of plant phosphate homeostasis[J]. The Plant Journal, 2008, 53(5):731-738. |
| [9] | Lin SI, Chiang SF, Lin WY, et al. Regulatory network of microRNA399 and PHO2 by systemic signaling[J]. Plant physiology, 2008, 147(2):732-746. |
| [10] | Ding SW, Voinnet O. Antiviral immunity directed by small RNAs[J]. Cell, 2007, 130(3):413-426. |
| [11] | Schwach F, Vaistij FE, Jones L, et al. An RNA-dependent RNA polymerase prevents meristem invasion by potato virus X and is required for the activity but not the production of a systemic silencing signal[J]. Plant Physiology, 2005, 138:1842-1852. |
| [12] | Burgyán J, Havelda Z. Viral suppressors of RNA silencing[J]. Trends in Plant Science, 2011, 16(5):265-272. |
| [13] | Herr AJ, Jensen MB, Dalmay T, et al. RNA polymerase IV directs silencing of endogenous DNA[J]. Science, 2005, 308:118-120. |
| [14] | Bäurle I, Smith L, Baulcombe DC, et al. Widespread role for the flowering-time regulators FCA and FPA in RNA-mediated chromatin silencing[J]. Science, 2007, 318(5847):109-112. |
| [15] | Borsani O, Zhu J, Verslues PE, et al. Endogenous siRNAs derived from a pair of natural cis-antisense transcripts regulate salt tolerance in Arabidopsis[J]. Cell, 2005, 123(7):1279-1291. |
| [16] | Melnyk CW, Molnar A, Baulcombe DC. Intercellular and systemic movement of RNA silencing signals[J]. The EMBO Journal, 2011, 30(17):3553-3563. |
| [17] | Vatén A, Dettmer J, Wu S, et al. Callose biosynthesis regulates symplastic trafficking during root development[J]. Dev Cell, 2011, 21(6):1144-1155. |
| [18] | Jones L. Revealing micro-RNAs in plants[J]. Trends in Plant Science, 2002, 7(11):473-475. |
| [19] | Ariel FD, Manavella PA, Dezar CA, et al. The true story of the HD-Zip family[J]. Trends in Plant Sci, 2007, 12(9):419-426. |
| [20] | Carlsbecker A, Lee JY, Roberts CJ, et al. Cell signalling by microRNA165/6 directs gene dose-dependent root cell fate[J]. Nature, 2010, 465(7296):316-321. |
| [21] | Furuta K, Lichtenberger R, Helariutta Y. The role of mobile small RNA species during root growth and development[J]. Current Opinion in Cell Biology, 2012, 24(2):211-216. |
| [22] | Husbands AY, Chitwood DH, Plavskin Y, et al. Signals and prepatterns:new insights into organ polarity in plants[J]. Genes & Development, 2009, 23(17):1986-1997. |
| [23] | Allen E, Xie Z, Gustafson AM, et al. microRNA-directed phasing during Trans-acting siRNA biogenesis in plants[J]. Cell, 2005, 121(2):207-221. |
| [24] | Montgomery TA, Howell MD, Cuperus JT, et al. Specificity of ARGONAUTE7-miR390 interaction and dual functionality in TAS3 Trans-acting siRNA formation[J]. Cell, 2008, 133:128-141. |
| [25] | Chitwood DH, Nogueira FTS, Howell MD, et al. Pattern formation via small RNA mobility[J]. Genes & Development, 2009, 23(5):549-554. |
| [26] | Nogueira FTS, Madi S, Chitwood DH, et al. Two small regulatory RNAs establish opposing fates of a developmental axis[J]. Genes & Development, 2007, 21(7):750-755. |
| [27] | Benkovics AH, Timmermans MCP. Developmental patterning by gradients of mobile small RNAs[J]. Current Opinion in Genetics & Development, 2014, 27:83-91. |
| [28] | Knauer S, Holt AL, Rubio-Somoza I, et al. A protodermal miR394 signal defines a region of stem cell competence in the Arabidopsis shoot meristem[J]. Dev Cell, 2013, 24(2):125-132. |
| [29] | Song JB, Huang SQ, Dalmay T, et al. Regulation of leaf morphology by microRNA394 and its target LEAF CURLING RESPONSIVENESS[J]. Plant and Cell Physiology, 2012, 53(7):1283-1294. |
| [30] | Mosher RA, Melnyk CW. siRNAs and DNA methylation:seedy epigenetics[J]. Trends Plant Sci, 2010, 15(4):204-210. |
| [31] | Slotkin RK, Vaughn M, Borges F, et al. Epigenetic reprogramming and small RNA silencing of transposable elements in pollen[J]. Cell, 2009, 136(3):461-472. |
| [32] | Winston WM, Molodowitch C, Hunter CP. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1[J]. Science, 2002, 295(5564):2456-2459. |
| [33] | Winston WM, Sutherlin M, Wright AJ, et al. Caenorhabditis elegans SID-2 is required for environmental RNA interference[J]. Proc Natl Acad Sci USA, 2007, 104(25):10565-10570. |
| [34] | Hinas A, Wright AJ, Hunter CP. SID-5 is an endosome-associated protein required for efficient systemic RNAi in C. elegans[J]. Current Biology, 2012, 22(20):1938-1943. |
| [35] | Varkonyi-Gasic E, Gould N, Sandanayaka M, et al. Characterisation of microRNAs from apple(Malus domestica’Royal Gala’)vascular tissue and phloem sap[J]. BMC Plant Biology, 2010, 10(1):159. |
| [36] | Molnar A, Melnyk CW, Bassett A, et al. Small silencing RNAs in plants are mobile and direct epigenetic modification in recipient cells[J]. Science, 2010, 328(5980):872-875. |
| [37] | Dunoyer P, Schott G, Himber C, et al. Small RNA duplexes function as mobile silencing signals between plant cells[J]. Science, 2010, 328(5980):912-916. |
| [38] | 李苹芳, 羊杏平, 徐锦华, 等. RNA分子在植物韧皮部长距离运输的研究进展[J]. 园艺学报, 2013, 40(10):2058-2066. |
| [39] | Brosnan CA, Mitter N, Christie M, et al. Nuclear gene silencing directs reception of long-distance mRNA silencing in Arabidopsis[J]. Proc Natl Acad Sci USA, 2007, 104(37):14741-14746. |
| [40] | Juarez MT, Kui JS, Thomas J, et al. microRNA-mediated repression of rolled leaf1 specifies maize leaf polarity[J]. Nature, 2004, 428(6978):84-88. |
| [41] | de Felippes FF, Ott F, Weigel D. Comparative analysis of non-autonomous effects of tasiRNAs and miRNAs in Arabidopsis thaliana[J]. Nucleic Acids Research, 2011, 39:2880-2889. |
| [42] | Zhai J, Zhao Y, Simon SA, et al. Plant microRNAs display differential 3' truncation and tailing modifications that are ARGONAUTE1 dependent and conserved across species[J]. The Plant Cell Online, 2013, 25(7):2417-2428. |
| [43] | Ameres SL, Horwich MD, Hung JH, et al. Target RNA-directed trimming and tailing of small silencing RNAs[J]. Science, 2010, 328(5985):1534-1539. |
| [44] | Rogers K, Chen X. Biogenesis, turnover, and mode of action of plant microRNAs[J]. Plant Cell, 2013, 25(7):2383-2399. |
| [45] | Park MY, Wu G, Gonzalez-Sulser A, et al. Nuclear processing and export of microRNAs in Arabidopsis[J]. Proc Natl Acad Sci USA, 2005, 102(10):3691-3696. |
| [46] | Zhu H, Hu F, Wang R, et al. Arabidopsis argonaute10 specifically sequesters miR166/165 to regulate shoot apical meristem development[J]. Cell, 2011, 145(2):242-256. |
| [47] | Liu Q, Yao X, Pi L, et al. The ARGONAUTE10 gene modulates shoot apical meristem maintenance and establishment of leaf polarity by repressing miR165/166 in Arabidopsis[J]. The Plant Journal, 2009, 58(1):27-40. |
| [48] | Brunkard JO, Runkel AM, Zambryski PC. Plasmodesmata dynamics are coordinated by intracellular signaling pathways[J]. Current Opinion in Plant Biology, 2013, 16(5):614-620. |
| [49] | Liarzi O, Epel BL. Development of a quantitative tool for measuring changes in the coefficient of conductivity of plasmodesmata induced by developmental, biotic, and abiotic signals[J]. Protoplasma, 2005, 225(1-2):67-76. |
| [50] | Voinnet O, Vain P, Angell S, et al. Systemic spread of sequence-specific transgene RNA degradation in plants is initiated by localized introduction of ectopic promoterless DNA[J]. Cell, 1998, 95(2):177-187. |
| [51] | Guo HS, Ding SW. A viral protein inhibits the long range signaling activity of the gene silencing signal[J]. The EMBO Journal, 2002, 21(3):398-407. |
| [52] | Zhang X, Yuan YR, Pei Y, et al. Cucumber mosaic virus-encoded 2b suppressor inhibits Arabidopsis Argonaute1 cleavage activity to counter plant defense[J]. Genes Dev, 2006, 20:3255-3268. |
| [53] | Chitwood DH, Timmermans MCP. Small RNAs are on the move[J]. Nature, 2010, 467(7314):415-419. |
| [54] | Shapiro E, Biezuner T, Linnarsson S. Single-cell sequencing-based technologies will revolutionize whole-organism science[J]. Nature Reviews Genetics, 2013, 14(9):618-630. |