2.曲靖师范学院生物资源与环境科学学院,曲靖 655011
2. College of Biological Resource and Environmental Science,Qujing Normal University,Qujing 655011
小桐子(Jatropha curcas L.)属大戟科(Euphor-biaceae)麻疯树属(Jatropha)植物[1, 2],原产美洲,现广布于世界各热带地区及我国南方诸省[3]。作为重点开发的油料植物,其种子含油量高,可提取加工成生物柴油。根、茎及树皮乳汁中富含多种药用成分,可用作生物医药及生物农药的药源。另外,加工后的油饼蛋白质含量高,脱毒后可直接用于动物饲料,因此小桐子具有广阔的开发利用前景[4]。
赤霉素(Gibberellins,GAs)是一种重要的植物激素,目前发现有100多种,但只有部分形式具有生物学活性,在高等植物整个生命周期的种子萌发、茎的伸长及花的发育等方面都起着重要作用[5]。作为一种四环二萜羧酸,其合成从牻牛儿牻牛儿基焦磷酸(Geranylgeranyl pyrophosphate,GGPP)开始,经历了贝壳杉烯(Ent-kaurene)、GA12-醛(GA12-aldehyde)等关键中间分子。赤霉素20氧化酶(Gibberellin 20 oxidase)是从GA12-醛到各种有活性GAs的关键限速酶[6]。自从1994年利用蛋白质抗体技术,从南瓜胚乳表达文库中筛选到编码赤霉素20氧化酶的cDNA以来,目前已经从拟南芥[7]、小麦[8]、板栗[9]、甘蔗[10]等许多植物中克隆到了该基因,但关于小桐子的GA20ox还未见报道。本研究利用本课题组前期获得的小桐子低温锻炼转录组和数字基因表达谱数据[11, 12],克隆获得小桐子JcGA20ox基因的全长cDNA序列,并对其进行生物信息学分析及低温下表达分析,旨在为研究小桐子通过调节内源性赤霉素生物合成对各种逆境因子的应答机制研究提供参考。
1 材料与方法 1.1 材料 1.1.1 实验材料供试小桐子种子取自云南省楚雄州元谋县。
1.1.2 菌株与主要试剂大肠杆菌Trans1-T1(DH5α)菌株由本实验室保存;TransZol Up、DNase I、TransStart Taq DNA Polymerase、Amp、X-gal、IPTG、2×EasyTaq PCR SuperMix(+dye)、TransScript Two-Step RT-PCR SuperMix、EasyPure Quick Gel Extraction Kit、EasyPure Plasmid MiniPrep Kit、pEASY-T1 Cloning Kit、pEASY-E1 Expression Kit、Trans 2K Plus II DNA Marker购自北京全式金生物技术有限公司;引物合成和测序由深圳华大基因有限公司完成。
1.2 方法 1.2.1 材料处理选取饱满的小桐子种子,用1.5% CuSO4消毒20 min,无菌水漂洗5次,于26℃的恒温培养箱中吸涨24 h[13]。将吸涨的种子在无菌水中漂洗3次,播于垫有5层用无菌水湿润滤纸的白磁盘(24 cm×16 cm)中,于相对湿度(RH)75%、26/20℃、16/8 h光周期的恒温培养箱中萌发5 d。将发芽的种子播于消毒的培养土中并于同样恒温培养箱中生长15 d至第二片真叶展开,每天用无菌水润湿培养土。将生长15 d的小桐子幼苗置于相对湿度(RH)75%、12℃、16/8 h光周期的低温培养箱中进行低温处理,分别取低温锻炼12、24和48 h与对照(正常培养)的根、茎及第二片真叶,用铝箔纸包好,液氮速冻后保存于-80℃冰箱中以用于RNA的提取。
1.2.2 引物的设计利用与小桐子同属大戟科的蓖麻(Ricinus communis)的GA20ox基因全长mRNA序列(XM_002510827.1),以我们测序得到的小桐子低温锻炼转录组(GenBank登录号GAHK00000000.1)的45 251条Unigenes为数据库,进行本地Blast,检索到与蓖麻GA20ox基因相似性最高的Unigene序列Unigene12450_JC-CK_1A(1 417 bp),以此序列设计基因全长扩增引物及半定量表达分析引物;同时根据18S rRNA(GenBank登录号AY823528)设计内参引物进行基因表达的半定量分析。实验中用到的引物序列,见表 1。
利用TransZol Up试剂提取小桐子对照与12℃低温锻炼12、24和48 h的根、茎及叶片的总RNA,并利用DNase I消化RNA中的残余基因组DNA,得到纯化的总RNA。分别取3 μg总RNA,以Anchored Oligo(dT)18为逆转录引物,利用TransScript Two-Step RT-PCR SuperMix合成第一链cDNA。
1.2.4 小桐子JcGA20ox基因全长cDNA的克隆以小桐子12℃低温锻炼24 h根提取总RNA并反转录的cDNA为模板,使用热启动双封闭DNA聚合酶TransStart Taq DNA Polymerase进行PCR扩增,扩增条件为:94℃ 5 min;94℃ 30 s,51.6℃ 30 s,72℃ 1.5 min,35个循环;72℃ 20 min。扩增完成后用1%的琼脂糖凝胶电泳检测PCR产物,利用EasyPure Quick Gel Extraction Kit从琼脂糖凝胶回收目的基因条带(1 307 bp)。将目的基因片段与克隆载体pEASY-T1连接,转化大肠杆菌Trans1-T1感受态细胞,涂布LB抗性平板(LB-Amp++IPTG+X-gal),过夜生长,进行蓝白斑筛选。菌落PCR验证的阳性克隆,取名为pEASY-T1-JcGA20ox,送深圳华大基因公司利用pEASY-T1质粒上的M13F与M13R通用引物进行双向测序。
1.2.5 小桐子JcGA20ox基因的生物信息学分析利用Spidey软件进行克隆cDNA序列与基因组序列(小桐子基因组数据库http://www.kazusa.or.jp/jatropha/)比对以确定基因的内含子与外显子结构。利用BioEdit软件将克隆cDNA序列翻译成氨基酸序列,利用在线工具ProtParam计算蛋白质的理论分子量、等电点等基本参数。利用SignalP3.0 Server分析蛋白质信号肽序列,接着利用在线工具TMHMM与Proscale检测其跨膜结构与亲水/疏水特性。利用Prosite与NCBI CDD工具进行结构域与功能元件的鉴定。从NCBI下载其它物种的GA20ox氨基酸序列,利用ClustalX进行序列相似性比对,然后用MEGA4.0软件通过邻接法构建系统进化树,并采用泊松法进行检验。利用Phyre2进行蛋白质三维结构的同源建模,利用VMD软件显示其三维空间结构,并结合Ramachandram图验证其准确性。
1.2.6 半定量RT-PCR表达分析利用1.2.3中制备的各组织及低温锻炼条件下的cDNA为模板,以18S rRNA为内参,进行JcGA20ox的RT-PCR扩增。18S rRNA的扩增条件为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,26个循环;72℃ 10 min。JcGA20ox的扩增条件为:94℃ 5 min;94℃ 30 s,51℃ 30 s,72℃ 1 min,28个循环;72℃ 10 min。反应完毕后取5 μL进行1%的琼脂糖凝胶电泳检测。以18S rRNA为内参进行JcGA20ox基因表达差异性的分析。
2 结果 2.1 小桐子JcGA20ox基因全长cDNA的克隆以小桐子12℃低温锻炼24 h的根提取总RNA,并反转录cDNA为模板,利用全长扩增引物,扩增JcGA20ox基因的全长cDNA。结果表明,扩增得到的产物约1.3 kb(图 1-A),与预期大小一致。将目的条带切胶回收后与T/A克隆载体pEASY-T1连接,转化大肠杆菌,菌落PCR验证阳性克隆(图 1-B),对阳性克隆提取重组质粒pEASY-T1-JcGA20ox(图 1-C)。
 |
| A:PCR扩增;B:菌落PCR;C:重组质粒pEASY-T1-JcGA20ox图 1 小桐子JcGA20ox基因的cDNA克隆 |
经过测序,克隆的JcGA20ox基因cDNA序列全长1 307 bp,包含完整开放阅读框(1 131 bp),编码376个氨基酸(aa),结果如图 2所示。将其编码区序列与对应基因组序列(Jcr4S02347的34 254-35 595位,1 342 bp)进行比对,发现JcGA20ox基因包含3个外显子与2个内含子。其推导蛋白质的理论分子量为43 kD,等电点为6.7,单体属于稳定蛋白。氨基酸组成以非极性氨基酸为主,其中Leu、Ile、Val、Ala共占23.4%。二级结构显示,该蛋白质富含α-螺旋(134 aa),占35.64%,主要分布于70-110位、160-210位及C末端的340-370位;β-折叠(73 aa)占19.41%;β-转角(28 aa)占7.45%;无规则卷曲(141 aa)占37.50%。存在1个明显的跨膜区域,位于189-208位,这与二级结构中α-螺旋富集区相吻合。SignalP分析发现该蛋白质在N端没有信号肽。
 |
| 起始(ATG)与终止(TAA)密码子用下划线标注图 2 小桐子JcGA20ox基因的cDNA与推导的氨基酸序列 |
GA20ox蛋白质属于2-ODD(2-oxoglutarte depen-dent dioxygenase)家族。目前研究表明,2-ODD家族成员在核酸甚至氨基酸序列上的保守性较低,约为19%-75%,如该家族的赤霉素合成酶的氨基酸序列在不同物种间保守性仅为50%-60%。应用NCBI中的BlastP工具对不同物种的GA20ox氨基酸序列进行同源性比对分析,并利用GeneDOC软件生成比对图(图 3-A),发现GA20ox蛋白的N端与C端的氨基酸差异性变化都较大,在不同物种之间没有相似性,而在中间部位100-170、210-320位之间的序列较为保守,其中100-170位主要构成α-螺旋,210-320区间的氨基酸序列则构成多段β-折叠。
 |
| A:多重序列比对(实线表示依赖Fe2+与2-酮戊二酸双加氧酶结构域,虚线表示非血红素双加氧酶结构域,◆表示Fe2+结合位点,*表示2-酮戊二酸结合位点);B:NCBI推测的保守结构域图 3 小桐子JcGA20ox推导氨基酸序列与其它植物JcGA20ox的多重序列比对(A)及保守结构域预测(B) |
通过Prosite服务器功能结构域分析发现,该小桐子Ga20ox蛋白质在218-318位存在1个依赖Fe2+与2-酮戊二酸双加氧酶结构域(Fe2+ 2-oxoglutarate dioxygenase,Fe2OG_OXY或2GO-FeII_Oxy),Fe2+结合位点位于该功能域的His243、Asp245、His299位,而Arg309位则为2-酮戊二酸的主要结合部位,属于典型的2-ODD家族蛋白质。另外,在N端还发现了1个非血红素双加氧酶结构域,该结构域是催化吗啡合成中的核心结构域(DIOX_N),同样依赖Fe2+与2-酮戊二酸(图 3-B)。
下载不同植物的GA20ox氨基酸序列,利用MEGA4.0软件通过邻近法与我们得到的小桐子GA20ox构建系统进化树。结果(图 4)显示,小桐子GA20ox与同科的蓖麻最先聚类,在进化上亲缘关系最近,接着与杨柳科的大叶杨与小叶杨聚合,而与豆科的蒺藜苜蓿亲缘关系最远。另外,进化树显示同属番茄GA20ox家族的不同GA20ox,被聚类在不同的亲缘关系簇中,尤其是GA20ox1和GA20ox4与其它两种GA20ox亲缘关系较远,说明GA20ox家族中的不同成员可能有不同的功能侧重,推测其基因表达调控方式也是不同的。
 |
| 图 4 通过ClustalW序列比对MEGA4.0邻接法构建的JcGA20ox系统进化树 |
通过同源建模得到的三维结构显示,小桐子GA20ox蛋白质具有典型的2-ODD蛋白结构模型,表现出结构的层次性,由8条β-折叠片层组成主体平面位于蛋白质结构的中心位置,另外4条β-折叠片层构成第二平面,两平面平行组成一个中空结构作为催化中心而存在;在主体平面的外围主要为3段长α-螺旋与3段短α-螺旋共同组成的平面维持结构,保护中心主体平面结构的稳定;而第二平面的外围主要由无规则卷曲构成;2-酮戊二酸的主要结合部位Arg309位于主体平面上,组成催化中心的氨基酸残基也主要位于主体平面上,而Fe2+结合位点His243、Asp245、His299(H-D-H)位于第二平面上(图 5-A)。另外,Ramachandram能量图(图 5-B)显示,该预测结构的95.2%的氨基酸残基处于能量稳定区域,说明预测的小桐子GA20ox蛋白质三维结构可信。
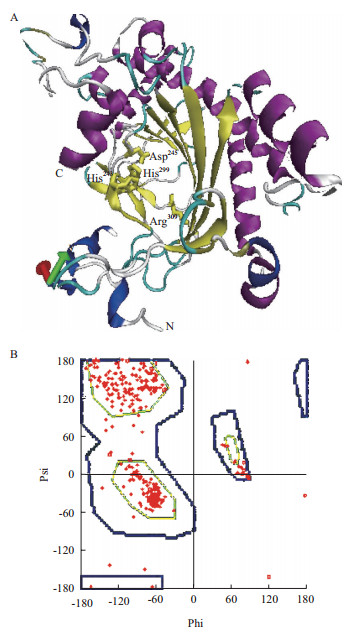 |
| A:三维结构卡通模型;B:Ramachandram能量图图 5 小桐子JcGA20ox蛋白的三维空间结构 |
利用半定量RT-PCR方法分析了JcGA20ox基因在小桐子不同组织及不同低温锻炼条件下的表达情况。结果(图 6)表明,JcGA20ox基因在本研究所涉及的组织中都有表达,但表现出明显的组织特异性。在茎中表达量较高,且存在明显的低温诱导特性:随着低温锻炼时间的延长,在茎中的表达量逐渐升高,在低温锻炼48 h后仍然表现出继续增加的趋势;在根中其表达量随低温锻炼表现出先下调后上调再恢复本底表达水平的变化模式;而在叶中其表达变化模式与根中基本相同,但其表达量较根中低。
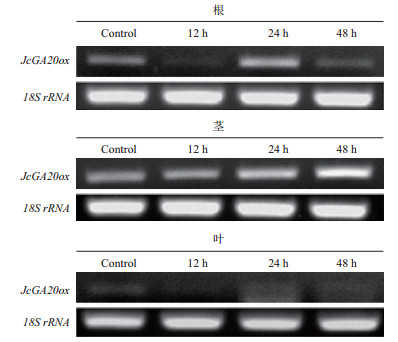 |
| 图 6 低温锻炼下不同组织中JcGA20ox基因的差异表达分析 |
目前,在植物中研究清楚的2-ODD酶类包括赤霉素合成酶类如GA2ox(Gibberellin 2 oxidase,EC 1.14.11.13)、GA3ox(Gibberellin 3 oxidase,EC1.14.11.15),黄酮类合成代谢过程中限速酶类如黄烷酮羟化酶(Flavanone 3-hydroxylase,F3H)、花青素合成酶(Anthocyanidin synthesis,ANS)、白花色素双加氧酶(Leucoanthocyanidin dioxygenase,LDOX,EC1.14.11.19)、1-羧基氨基环丙烷氧化酶(1-aminocyclopropane-1-carboxylate oxidases,ACCO,EC1.14.17.4)等。此类酶参与动物如脯氨酸羟化、植物(乙烯、赤霉素、花色素苷、黄酮类化合物)与微生物(抗生素盘尼西林、头孢菌素)的初生及次生代谢物等的合成[14, 15]。
另外,此类酶都包含依赖Fe2+与2-酮戊二酸的双加氧酶结构域。2-ODD酶在催化反应中都需要Fe2+与2-酮戊二酸或抗坏血酸作为辅助因子,在反应中氧分子的两个氧原子,一个进入底物,另一个参与2-酮戊二酸脱羧反应生成琥珀酸盐和CO2[16, 17]。Fe2+与2-酮戊二酸依赖性双加氧酶结构域在三维结构中,都包含由β-折叠构成的双层β-桶结构(PDB:2G19)[15],类似于cupin亚家族的保守结构域。保守的两个His和Asp残基(H-D-H或H-X,X代表任意氨基酸)结合辅助金属离子如Fe2+,如本研究中小桐子GA20ox蛋白的His243-Asp245-His299保守残基,而距N-端更近的两个保守的碱性氨基酸如Arg或Lys(R-X-S,X代表同上)直接催化酸性底物的氧化反应。
在植物中,GA20ox基因属于小基因家族。目前,在拟南芥中有5个GA20ox基因被分离出来(AtGA20ox1-AtGA20ox5)[18],在水稻中发现有4个GA20ox基因(OsGA20ox1-OsGA20ox4),且存在于不同的染色体上。而GA20ox基因在植物中也表现出表达特异性,如OsGA20ox1在水稻的几乎所有器官中都有表达,OsGA20ox2仅在未开的花中表达,OsGA20ox3则在所有器官中的表达量都极低,OsGA20ox4在叶与茎中表达较多,而在根中表达水平较低[19]。刘文超等[20]克隆到丹参(Salviamiltio-rrhiza bunge)的GA20ox同源基因2-酮戊二酸依赖性双加氧酶基因,表达分析显示,该基因在丹参各器官都有表达,但表现出组织特异性,同时受茉莉酸甲酯(MeJA)、脱落酸(ABA)、赤霉素3(GA3)的诱导表达,且分别在诱导表达的8、4及12 h达到最高表达量。另外,GA20ox基因的表达还受到植物激素如吲哚乙酸、萘乙酸及脱落酸等的调控,拟南芥幼苗经吲哚乙酸处理AtGA20ox1基因表达量上调明显[21],经萘乙酸处理24 h后,AtGA20ox1与AtGA20ox2基因表达水平均提高[22],而经脱落酸处理后AtGA20ox表达量下降[23]。转基因研究表明,GA20ox过表达在不同植物中有不同的效应。例如,卡里佐枳橙(Carrizo citrange)中过量表达CcGA20ox1后,转基因植株呈现出伸长的表型,其体内赤霉素浓度增高[24];而南瓜GA20ox基因在莴苣(Lactuca sativa cv Vanguard)中过量表达则导致有生物活性的 GAs(GA1和GA4)大大减少,莴苣出现矮化表型[25]。此外,还有研究表明,GA20ox基因的表达受到其它因子如homeo-box转录因子、激素运转抑制子、光及低温的调控[26],但其具体机理还不甚了解。
4 结论本研究克隆到小桐子GA20ox基因。序列分析表明,其包含1 131 bp的开放阅读框,编码376个氨基酸,分子量为43 kD,理论等电点为6.7。GA20ox蛋白存在1个依赖Fe2+与2-酮戊二酸双加氧酶结构域,属于2-ODD家族。半定量RT-PCR分析显示,低温锻炼条件下,JcGA20ox基因在本研究所涉及的小桐子各组织中表达水平具有组织特异性,其中茎中表达量较高,且受低温诱导表达最显著,而在叶中表达量较茎与根低。
| [1] | 何璐, 虞泓, 范源洪, 等. 麻疯树(Jatropha curcas L. )植物学研究进展[J]. 长江流域资源与环境, 2010, 19:120-127. |
| [2] | 曾觉民. 可大力发展的生物质能源植物-膏桐[J]. 云南林业, 2006, 27:21-22. |
| [3] | 陈冀胜, 郑硕. 中国有毒植物[M]. 北京:科学出版社, 1987:258. |
| [4] | Lin J, Zhou X, Tang KX, et al. A survey of the studies on the resources of Jatropha curcas L.[J]. J Trop Subtrop Bot, 2004, 12:285-290. |
| [5] | Silverstone AL, Sun TP. Gibberellins and green revolution[J]. Trends Plant Sc, 2000, 5:1-2. |
| [6] | 王伟, 朱平, 程克棣. 植物赤霉素生物合成和信号传导的分子生物学[J]. 植物学通报, 2002, 19:137-149. |
| [7] | Rieu I, Ruiz-Rivero O, Fernandez-Garcia N, et al. The gibberellin biosynthetic genes AtGA20ox1 and AtGA20ox2 act, partially redundantly, to promote growth and development throughout the Arabidopsis life cycle[J]. Plant J, 2008, 53:488-504. |
| [8] | 武晶, 孔秀英, 高丽峰, 等. 小麦TaGA20ox2基因的克隆及分析[J]. 中国农业科学, 2009, 42:3405-3412. |
| [9] | 鲍晓兰, 杨凯, 冯永庆, 等. 板栗GA20-氧化酶基因的克隆及序列分析[J]. 北京农学院学报, 2009, 24:5-8. |
| [10] | 吴建明, 李杨瑞, 王爱勤, 等. 赤霉素诱导甘蔗GA20-Oxidase基因实时荧光定量PCR分析[J]. 分子植物育种, 2009, 7:922-927. |
| [11] | Wang HB, Zou ZR, Wang SS, et al. Global analysis of transcriptome responses and gene expression profiles to cold stress of Jatropha curcas L.[J]. PLoS ONE, 2013, 12:e82817. |
| [12] | Wang HB, Zou ZR, Wang SS, et al. Deep sequencing-based transcriptome analysis of the oil-bearing plant Physic Nut(Jatropha curcas L. )under cold stress[J]. Plant Omics Journal, 2014, 7:178-187. |
| [13] | 李忠光, 龚明. 不同化学消毒剂对小桐子种子萌发和幼苗生长的影响[J]. 种子, 2010, 30:4-7, 12. |
| [14] | Aravind L, Koonin EV. The DNA-repair protein AlkB, EGL-9, and leprecan define new families of 2-oxoglutarate- and iron-dependent dioxygenases[J]. Genome Biol, 2001, 2:research0007. 1-research0007. 8. |
| [15] | McDonough MA, Li V, Flashman E, et al. Cellular oxygen sensing:Crystal structure of hypoxia-inducible factor prolyl hydroxylase(PHD2)[J]. Proc Natl Acad Sci USA, 2006, 103:9814-9819. |
| [16] | Carolis E, Deluca V. 2-oxoglutarate dependent dioxygenase and related enzymes:biochemical characterization[J]. Phytochemistry, 1994, 36:1093-1107. |
| [17] | Schofield CJ, Zhang ZH. Sturctural and mechanistic studies on 2-oxoglutarate-dependent oxygenases and related enzymes[J]. Curr Opin Str Bio, 1999, 9:722-731. |
| [18] | Rieu I, Ruiz-Rivero O, Fernandez-Garcia N, et al. The gibberellin biosynthetic genes AtGA20ox1 and AtGA20ox2 act, partially redundantly, to promote growth and development throughout the Arabidopsis life cycle[J]. Plant J, 2008, 53:488-504. |
| [19] | Laura H, Andres GL, Jose LGM. Characterization of gibberellin 20-oxidases in the citrus hybrid Carrizocit range[J]. Tree Physiol, 2009, 29:569-577. |
| [20] | 刘文超, 王东浩, 王喆之, 等. 丹参2-酮戊二酸依赖性双加氧酶基因克隆及表达分析[J]. 西北植物学报, 2012, 32:1289-1294. |
| [21] | Goda H, Sawa S, Asami T, et al. Comprehensive comparison of auxin-regulated and brassinosteroid-regulated genes in Arabidopsis[J]. Plant Physiol, 2004, 134:1555-1573. |
| [22] | Frigerio M, Aladi D, Perze-Gomez J, et al. Transcriptional regulatino of gibberellin metabolism genes by auxin signaling in Arabidopsis[J]. Plant Physiol, 2006, 143:553-563. |
| [23] | Son O, Hur YS, Kim YK, et al. ATHB12, an ABA-inducible homeodomain-leucine zipper(HD-Zip)protein of Arabidopsis, negatively regulates the growth of the inflorescence stem by decreasing the expression of a gibberellin 20 oxidase gene[J]. Plant Cell Physiol, 2010, 51:1537-1547. |
| [24] | Fagoaga C, Tadeo FR, Iglesias DJ, et al. Engineering of gibberellin levels in citrus by sense and antisense overexpression of a GA 20-oxidase gene modifies plant architecture[J]. J Exp Bot, 2007, 58:1407-1420. |
| [25] | Niki T, Nishijima T, Nakayama M, et al. Production of dwarf lettuce by overexpressing a pumpkin gibberellin 20-oxidase gene[J]. Plant Physiol, 2001, 126:965-972. |
| [26] | Vidal AM, Ben-Cheikh W, Talon M, et al. Regulation of gibberellin 20-oxidase gene expression and gibberellin content in citrus by temperature and citrus exocortis viroid[J]. Planta, 2003, 217:442-448. |