马铃薯腐烂茎线虫(Ditylenchus destructor)作为一种植物内寄生线虫,生命周期的大部分时间都寄生在寄主植物体内。在长期的进化过程中,寄主植物对病原线虫形成了各种各样的防御体系[1, 2, 3],其中氧化防御体系是重要的防御体系之一。为应对线虫侵染,寄主在线虫侵染初期会产生大量的活性氧(reactive oxygen species,ROS)从而诱导植物产生相应的防御反应,阻止寄生关系的建立。而线虫为成功完成其生活史,在暴露于寄主植物各种防御反应下,相应的进化出了多种保护机制使其免受损伤。其中,在抗氧化防御机制方面,植物寄生线虫形成了多种抗氧化酶体系,已知的有过氧化氢酶(catalase,CAT)[4]、超氧化物歧化酶(superoxide dismutase,SOD)[4]、过氧化物还原酶(peroxiredoxins,PRXs)[5]和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)[6]。在这些抗氧化酶中,GPX是最为重要的抗氧化酶系之一。作为防御ROS破坏的第一道防线,谷胱甘肽过氧化物酶广泛分布于耗氧生物各组织中。根据活性位点是否含硒,又分为硒谷胱甘肽过氧化物酶(Se-GPX)和非硒谷胱甘肽过氧化物酶(non-Se-GPX)两类。在哺乳动物中,当Se-GPX缺乏足够的硒浓度时,non-Se-GPX被当作Se-GPX的后备系统行使抗氧化功能[7]。但在线虫体内,GPX常以non-Se-GPX形式存在[8, 9]。已有研究证明,non-Se-GPX 不能代谢H2O2或者以很低的效率代谢,但对于脂氢过氧化物等大分子活性氧却有更高的亲和力[10, 11],而许多重要的植物防御通路均由脂质氢过氧化物激活[12]。因此,可通过代谢这些脂氢过氧化物来阻止植物寄主启动一系列防御反应。
目前,国内外对于谷胱甘肽过氧化物酶的研究主要集中在动物、植物及真核微生物方面[13, 14],对植物线虫的谷胱甘肽过氧化物酶的克隆和表达少有报道。为此,本研究利用RACE技术获得一条马铃薯腐烂茎线虫谷胱甘肽过氧化物酶基因Dd-Gpx,并克隆到pET-41b载体上进行融合表达,以期为进一步研究植物寄生线虫GPX的结构和功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试材料马铃薯腐烂茎线虫为本实验室用半裸镰刀菌(Fusarium semitectum)在25℃条件下进行纯培养[15,16]。
1.1.2 试剂Dynabeads ® mRNA DIRECTTM Kit购自Life Technologies 公司;3'-FullRACECoreSetwithPrimeScriptTMRTase,TaKaRa RNA PCR Kit(AMV)Ver.3.0,Ex Taq DNA聚合酶,Prime STAR GXL高保真酶,DNA Marker购自TaKaRa 公司;pGEM-T easy载体购自美国Promega公司;大肠杆菌(Escherichia coli)DH5α和BL21(DE3)感受态细胞,卡那霉素(Kan)购自北京全式金生物技术有限公司;琼脂糖胶回收试剂盒购于天根生化科技(北京)有限公司;DNeasy Blood & Tissue Kit购自德国QIAGEN公司;限制性内切酶BamH I和Xho I 购自NEB公司;原核表达载体pET-41b由本实验室保存。
1.2 方法 1.2.1 马铃薯腐烂茎线虫Gpx核心片段扩增收集新鲜分离的马铃薯腐烂茎线虫,清水及灭菌去离子水离心清洗3次后采用Dynabeads mRNA DIRECT Kit进行mRNA提取,使用TaKaRa RNA PCR Kit(AMV)Ver.3.0试剂盒合成第一链cDNA。根据NCBI上公布的线虫谷胱甘肽过氧化物酶氨基酸序列进行比对,找出保守序列并合成简并引物GPX1R(表 1)。以合成的第一链cDNA为模板扩增Gpx核心片段,反应体系为:10×Ex PCR buffer 5µL,dNTP Mix(10 mmol/L)4 µL,GPX1R(10 μmol/L)3 µL,SL1(10 μmol/L)1 µL,Ex Taq DNA聚合酶(5 U/µL)0.5 µL,cDNA 1 µL,用ddH2O补足至50 µL。PCR反应条件为:94℃ 5 min;94℃ 30 s,52℃ 30 s,72℃ 1 min,35个循环;72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳鉴定与胶回收后连接到pGEM-T easy克隆载体并热激转化到DH5α感受态细胞中。菌液PCR检测阳性克隆后送上海生工生物工程技术服务有限公司测序。
1.2.2 Gpx cDNA全长扩增根据上一步获得的Gpx核心片段序列,采用Primer Premier 5.0软件设计3' RACE 引物GPXJ1和GPXJ2(表 1),以RACE cDNA为模板进行PCR扩增。PCR反应体系和扩增条件按3'-FullRACECoreSetwithPrimeScriptTMRTase说明书进行。PCR产物经1.5%琼脂糖凝胶电泳后按照说明书进行回收、连接和转化,菌液PCR检测阳性克隆后送上海生工生物工程技术服务有限公司测序。
根据上一步获得的马铃薯腐烂茎线虫Gpx cDNA全长序列,采用Primer Premier5.0软件设计基因组全长引物对GPXJYZ-1F/GPXJYZ-1R和 GPXJYZ-2F/GPXJYZ-2R(表 1),按DNeasy Blood & Tissue Kit试剂盒说明提取基因组DNA并以之为模板进行PCR扩增。PCR反应体系和扩增条件参照1.2.1进行。PCR产物经1.5%琼脂糖凝胶电泳后按照说明书进行回收、连接和转化,菌液PCR检测阳性克隆后送上海生工生物工程技术服务有限公司测序。
1.2.4 序列分析使用DNAMAN5.2软件进行序列拼接和比对;使用NCBI工具 BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)和ORF finder(http://www.ncbi.nlm.nih.gov/gorf/)比对序列和查找开放阅读框及蛋白质翻译;用MEGA5.0软件的最大似然法(maximum likelihood,ML)构建分子系统进化树;使用SignalP4.0Server(http://www.cbs.dtu.dk/services/SignalP-4.0/)软件进行信号肽预测,跨膜结构域的预测则使用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM/);使用Scanprosite软件分析特征性肽段;蛋白质等电点和分子量预测使用在线软件(http://web.expasy.org/compute_pi/);使用GSDS在线软件(http://gsds.cbi.pku.edu.cn/)分析基因组结构。使用SECISearch2.9在线软件检测Gpx是否含硒。
1.2.5 Gpx阅读框克隆与构建表达载体根据获得的Gpx cDNA全长进行特异性引物设计(上游引物41B-B-GPXF含BamHⅠ酶切位点;下游引物X-GPXR含Xho I酶切位点,见表 1),用Prime STAR GXL高保真酶扩增Gpx阅读框。PCR反应条件为:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。PCR产物用1.5%琼脂糖凝胶电泳鉴定并胶回收。分别将Gpx PCR产物和pET-41b表达质粒用BamH I和Xho I进行双酶切,胶回收后通过T4连接酶连接构建pET-41b-DdGpx表达载体并转入BL21(DE3)中。菌液PCR检测阳性克隆后送上海生工生物工程技术服务有限公司测序。
1.2.6 重组Dd-GPX蛋白表达条件优化及鉴定吸取2 µL测序正确的阳性菌液在5 mL含50 µg/mL卡那霉素(Kan)的LB液体培养基中过夜培养,次日按1∶100接种至含50 µg/mL Kan的LB培养基37℃培养至OD600≈0.6,向菌液中加入适量 IPTG,使 IPTG 终浓度为 0.2、0.6、1.0和1.4 mmol/L四个浓度,25℃继续培养至OD600=1.4。SDS-PAGE电泳比较不同浓度IPTG对表达量的影响。选用最适IPTG浓度,分别于18℃、25℃和 37℃培养菌浓度约为OD600=1.4,超声(3 s+3 s 10 min,功率10%,3个循环)冰浴破解后,4℃ 13 000 r/min收集上清与菌液一起进行SDS-PAGE电泳比较可溶性表达的最适温度并切取目的条带送生工生物工程(上海)股份有限公司做质谱检测。
2 结果 2.1 Dd-Gpx基因克隆采用SL1及下游简并引物进行PCR扩增,获得3条明显条带(图 1-A)。对3条明显条带均进行回收、测序,Blast比对结果显示,大小为392 bp的目的片段与马铃薯金线虫(CAD38523)、秀丽小杆线虫(CAB02659)和扭转血矛线虫(AAT28332)的相似度分别为66%、74%和84%,由此推测所获得片段为马铃薯腐烂茎线虫Gpx 5'端片段,再根据此片段设计3' RACE引物GPXJ1和 GPXJ2,扩增Gpx 3'端片段(图 1-B),回收、测序获得了770 bp的片段。与5'端片段拼接后得到Gpx cDNA全长。分别在5'端和3'端设计特异性引物GPX2F和 GPX2R以验证拼接结果的准确性,PCR结果显示在约1 000 bp处有单一条带,回收、测序结果表明验证序列与拼接序列一致。谷胱甘肽过氧化物酶(Gpx)cDNA全长为950 bp(图 1-C),使用NCBI ORF finder 分析开放阅读框(ORF)表明该序列包含1个681 bp的ORF,编码226个氨基酸,在5'端起始密码子“ATG”前存在36 bp的非编码区(UTR),3'端终止密码子“TAA”后存在233 bp的非编码区(UTR),C末端包含12 bp的poly(A)尾巴,其上游含有“AATAAA”加尾信号,表明获得的GPX序列为一个完整的基因,将cDNA序列命名为Dd-Gpx-1,基因登录号为:JQ609355。
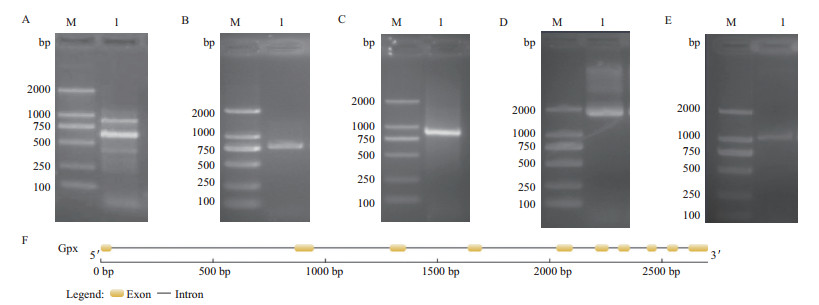 |
| M:D2000 DNA 标准分子量;A:Gpx 核心片段扩增;B:3' RACE 扩增;C:cDNA全长扩增;D、E:基因组全长扩增;F:基因组结构图图 1 马铃薯腐烂茎线虫谷胱甘肽过氧化物酶基因克隆及基因组结构图 |
以马铃薯腐烂茎线虫基因组DNA为模板,用GPXJYZ-1F和 GPXJYZ-1R、GPXJYZ-2F和GPXJYZ-2R两对引物进行PCR扩增,分别得到长度约2 000 bp和1 000 bp的条带(图 1-D,1-E),测序、拼接后得到的Dd-Gpx-1基因组全长为2 706 bp,用GSDS软件进行基因组结构分析显示Gpx基因组包括9个内含子和10个外显子(图 1-F)。
2.2 Dd-Gpx序列分析预测蛋白由226个氨基酸残基组成多肽,分子量(Mw)和等电点(pI)分别为26513.10 Da和6.31。信号肽和跨膜结构域分析显示,预测蛋白N端有明显信号肽,第16个和17个氨基酸处为最可能的剪切位点,信号肽可能性为78.5%,剪切的可能性为45%,无跨膜结构域。采用Scanprosite软件分析表明,预测蛋白存在3处特征性肽段,分别在62-79、99-115和186-195位氨基酸处,且64-79氨基酸处符合谷胱甘肽过氧化物酶的活性位点签名序列[GNDRC]-[RKHNQFYCS]-x-[LIVMFCS]-[LIVMF](2)-x-N-[VT]-x-[STCA]-x-[CU]-[GA]-x-[TA]。SECISearch2.9在线软件检测Gpx表明GPX属于non-Se-GPX。
将马铃薯腐烂茎线虫GPX与其他线虫GPX进行氨基酸序列比对,结果(图 2)表明,马铃薯腐烂茎线虫Dd-GPX-1与马铃薯金线虫(Globodera rostochiensis,CAD38523)、捻转血矛线虫(Haemonchus contortus,AAT28332)、秀丽小杆线虫(Caenorhabditis elegans,CAB02659)、锡兰钩口线虫(Ancylostoma ceylanicum,AEO32082)的相似度分别为71%、80%、76%和78%。
 |
| 方框为谷胱甘肽过氧化物酶的活性位点签名序列;Dd-GPX:马铃薯腐烂茎线虫(AFJ15101);GR-GPX:马铃薯金线虫(CAD38523);HC-GPX:捻转血矛线虫(AAT28332);AC-CAT:锡兰钩口线虫(AEO32082);CE-GPX-5:秀丽小杆线虫(NP_509615);CE-GPX-3:秀丽小杆线虫(NP_509616);BP-GPX:彭亨布鲁线虫(CAA48882)图 2 马铃薯腐烂茎线虫谷胱甘肽过氧化物酶(DD-Gpx-1)与其它线虫同源谷胱甘肽过氧化物酶的氨基酸序列比对结果 |
将已在NCBI登录的部分线虫GPX序列采用MEGA5.0软件中的最大似然法(Maximum Likelihood,ML)进行系统发育树的构建。结果(图 3)显示,植物寄生线虫和动物寄生线虫各聚为一支,马铃薯腐烂茎线虫DD-GPX与捻转血矛线虫HC-GPX(AAT28332)、锡兰钩口线虫AC-GPX(AEO32082)、秀丽小杆线虫的CE-GPX-5(CAB02659)和CE-GPX-3(CAB02655)以及马铃薯金线虫GR-GPX(CAD38523)聚为一支,且与马铃薯金线虫GR-GPX(CAD38523)有较近的亲缘关系。
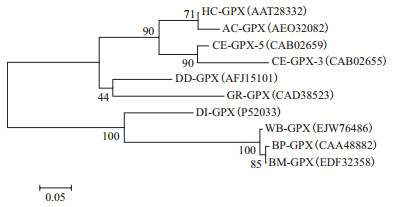 |
| HC:捻转血矛线虫;AC:锡兰钩口线虫;CE:秀丽小杆线虫;DD:马铃薯腐烂茎线虫;GR:马铃薯金线虫;DI:犬丝虫;WB:班氏丝虫;BP:彭亨布鲁丝虫;BM:马来丝虫。Bootstrap取1 000次重复图 3 基于最大似然法(ML)构建的线虫谷胱甘肽过氧化物酶系统发育树 |
以Dd-Gpx cDNA为模板,用分别带有BamH I和Xho I酶切位点的引物41B-B-GPXF和X-GPXR(表 1)扩增开放阅读框,经1.5%的琼脂糖凝胶电泳检测显示在700 bp左右有一条单一明亮的特异条带。分别将Gpx PCR产物和pET-41b表达质粒用BamH I和Xho I进行双酶切,胶回收后通过T4连接酶连接并转入BL21(DE3)中。用41B-B-GPXF和T7TER引物进行菌落PCR鉴定及酶切鉴定后,随机取3管阳性菌液送生工生物工程(上海)股份有限公司测序,测序结果表明Gpx阅读框成功克隆进入pET-41b载体上。
2.4 重组Dd-GPX蛋白表达条件优化及鉴定重组质粒pET41b-Dd-GPX在大肠杆菌BL21 中表达,表达的融合蛋白分子量约60 kD,与预期的理论值相符(图 4)。经质谱鉴定(图 5)分析,此条带有7个肽段与马铃薯腐烂茎线虫谷胱甘肽过氧化物酶匹配。结果表明,重组Dd-GPX蛋白表达成功。
 |
| M:即用型蛋白质分子量标准(低);A:1-5:分别为IPTG浓度为0、0.2、0.6、1.0和1.4 mmol/L时重组DdGpx蛋白表达量。 B:1,2:分别为18℃下,BL21(DE3)感受态细胞表达重组DdGpx蛋白超声破菌的上清和全菌液;3:无IPTG诱导的全菌液。 C:1,2:分别为25℃下,BL21(DE3)感受态细胞表达重组DdGpx蛋白超声破菌的上清和全菌液;3:无IPTG诱导的全菌液。 D:1:无IPTG诱导的全菌液,2,3:分别为37℃下,BL21(DE3)感受态细胞表达重组DdPrx蛋白全菌液和超声破菌的上清图 4 诱导IPTG浓度及温度对重组DdGPX蛋白表达量的影响 |
 |
| 导入重组DdGPX质粒的BL21(DE3)菌液诱导培养后经SDS-PAGE电泳,切取目的条带送生工生物工程(上海)股份有限公司进行质谱检测,结果为7个肽段与马铃薯腐烂茎线虫GPX蛋白匹配,图中用箭头和红色字体标记。图 5 GPX质谱鉴定图 |
IPTG浓度优化结果显示,0.2、0.6、1.0和1.4 mmol/L四个浓度的IPTG对重组Dd-GPX蛋白的表达量无明显影响(图 4-A)。采用IPTG浓度为0.2 mmol/L,分别于18℃、25℃和37℃培养检测温度对重组Dd-GPX蛋白可溶性表达的影响,超声破解取上清,SDS-PAGE电泳显示,当温度在18℃时,重组Dd-GPX蛋白基本以可溶性形式表达(图 4-B),25℃时,表达部分可溶性蛋白(图 4-C),37℃时,全部以包涵体形式表达(图 4-D)。
3 讨论本研究首次克隆了马铃薯腐烂茎线虫Gpx基因。使用SECISearch2.9在线软件分析发现Dd-GPX不含编码硒代半胱氨酸残基的UGA密码子,也不含Se-GPX mRNA 的3'端非编码区特有的茎环结构,此结构是识别UGA编码硒代半胱氨酸而不是终止密码子的功能结构。多肽预测显示蛋白N端具有明显信号肽。由此推测,Dd-GPX为一个分泌型non-Se-GPX。氨基酸序列对比发现Dd-GPX具有与其它GPX相同的催化三联体C-Q-W,表明Dd-GPX属于GPX超家族中的一员。系统发育树分析发现,植物寄生线虫马铃薯腐烂茎线虫DD-GPX和马铃薯金线虫GR-GPX(CAD38523)聚为一支,可自由生活的秀丽小杆线虫CE-GPX-5(CAB02659)和CE-GPX-3(CAB02655)聚为一支,动物寄生线虫捻转血矛线虫HC-GPX(AAT28332)、锡兰钩口线虫AC-GPX(AEO32082)等则聚集在其它分支。表明GPX在进化上具有保守性,但又各自具有特有的进化机制使其展现出不同功能。有研究发现,线虫non-Se-GPX中许多与催化底物谷胱甘肽作用的氨基酸并不具有保守性,因此推测线虫non-Se-GPX可能具有与其他类型GPXs不同的作用机制[7]。如Tang等[17]对彭亨布鲁线虫(Brugia pahangi)、Jones等[11]对马铃薯金线虫和Sun等[10]对捻转血矛线虫的non-Se-GPX研究发现,真核表达的non-Se-GPX重组蛋白对H2O2无明显活性,且均推测non-Se-GPX存在修复细胞膜氧化损伤的功能。但这一推测目前还没有找到直接的证据。此外,Jones等[11]对马铃薯金线虫的研究还发现,在取食和快速生长的J2期,Gpx mRNA被大量转录,且一个分泌型non-Se-GPX蛋白gr-gpx-1被大量分泌到线虫表皮,表明马铃薯金线虫在受到寄主植物防御体系攻击时gr-gpx-1具有汇聚于线虫表皮抵抗寄主攻击的能力,包括清除脂氢过氧化物等大分子活性氧来减轻或消除氧化应激反应及阻止由脂氢过氧化物启动的植物寄主的一系列防御反应,以及可能的修复细胞膜氧化损伤功能。而Dd-GPX与gr-gpx-1同属于分泌型non-Se-GPX,是否也具有gr-gpx-1的相关功能还有待进一步验证。
在Dd-GPX原核表达的实验中,为获得较多的可溶性表达蛋白,本研究对Dd-GPX融合蛋白的表达做了IPTG浓度及温度的优化。结果表明,0.2-1.4 mmol/L 的IPTG对Dd-GPX融合蛋白的表达无明显影响,而培养基中高浓度的IPTG会阻碍蛋白的表达[18],所以,本研究选用0.2 mmol/L IPTG作为诱导浓度。在温度优化方面,18℃条件下,Dd-GPX融合蛋白几乎全是可溶性表达,25℃时包涵体和可溶性蛋白共存,但两个温度条件下都不能获得可观的表达量。37℃条件下,表达量有所提高,但蛋白又均为包涵体形式存在,不利于体外活性研究。此外,本研究还在蛋白表达方面做了一些其他条件的优化,如pH值优化(pH7.2和pH7.5),表达时长的优化(4、6和8 h及过夜培养),载体(pET-41b、pET-42a)和宿主菌[BL21(DE3)、Transetta(DE3)]的更换,溶氧量优化(包括封口膜透气性的选择及培养基体积的选择),但仍然无法获得可供实验用量的可溶性蛋白。即使以包涵体形式表达,表达量也不高,因而无法尝试复性。因此,还需对诱导时间、培养基成分、菌体密度[19]、表达载体和表达菌株[20]等条件做进一步优化,以期获得可观的可溶性GPX蛋白,为后续GPX蛋白功能研究奠定基础。
4 结论本研究克隆了马铃薯腐烂茎线虫谷胱甘肽过氧化物酶基因Dd-Gpx-1,通过原核表达获得了大小约60 kD的目的蛋白,经质谱鉴定此蛋白为重组Dd-GPX蛋白。
| [1] | Williamson VM, Gleason CA. Plant-nematode interactions[J]. Current Opinion in Plant Biology, 2003, 6(4):327-333. |
| [2] | 符美英, 陈绵才, 肖彤斌, 等. 根结线虫与寄主植物互作机理的研究进展[J]. 热带农业科学, 2008, 28(3):73-77. |
| [3] | 叶建仁, 黄麟. 松材线虫病病原学研究的几个问题[J]. 中国森林病虫, 2012, 31(5):13-21. |
| [4] | Molinari S, Miacola C. Antioxidant enzymes in phytoparasitic nematodes[J]. Journal of Nematology, 1997, 29(2):153. |
| [5] | Dubreuil G, Deleury E, Magliano M, et al. Peroxiredoxins from the plant parasitic root-knot nematode, Meloidogyne incognita, are required for successful development within the host[J]. International Journal for Parasitology, 2011, 41(3):385-396. |
| [6] | Brigelius-Flohé R, Maiorino M. Glutathione peroxidases[J]. Biochimica et Biophysica Acta(BBA)-General Subjects, 2013, 1830(5):3289-3303. |
| [7] | Henkle-Dührsen K, Kampkötter A. Antioxidant enzyme families in parasitic nematodes[J]. Molecular and Biochemical Parasitology, 2001, 114(2):129-142. |
| [8] | Callahan HL, Crouch RK, James ER. Helminth anti-oxidant enzymes:a protective mechanism against host oxidants?[J]. Parasitology Today, 1988, 4(8):218-225. |
| [9] | Selkirk ME, Smith VP, Thomas GR, et al. Resistance of filarial nematode parasites to oxidative stress[J]. International Journal for Parasitology, 1998, 28(9):1315-1332. |
| [10] | Sun W, Song X, Yan R, et al. Cloning and characterization of a selenium-independent glutathione peroxidase(HC29)from adult Haemonchus contortus[J]. Journal of Veterinary Science, 2012, 13(1):49-58. |
| [11] | Jones JT, Reavy B, Smant G, et al. Glutathione peroxidases of the potato cyst nematode Globodera Rostochiensis[J]. Gene, 2004, 324:47-54. |
| [12] | Farmer EE. Fatty acid signaling in plants and their associated microorganisms // Signals and Signal Transduction Pathways in Plants[M]. Springer Netherlands, 1994:187-201. |
| [13] | 马森. 谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展, 2008, 29(10):53-56. |
| [14] | 付瑞燕, 陈坚, 李寅. 谷胱甘肽/谷胱甘肽过氧化物酶系统在微生物细胞抗氧胁迫系统中的作用[J]. 生物工程学报, 2007, 23(5):770-775. |
| [15] | 徐进军, 李世东, 杨之为. 马铃薯茎线虫的培养[J]. 西北农林学报, 2004, 13(4):77-80. |
| [16] | 丁中, 彭德良, 高必达, 等. 甘薯茎线虫乙酰胆碱酯酶基因ace-3全长cDNA的克隆和序列分析[J]. 农业生物技术学报, 2008, 16(2):326-331. |
| [17] | Tang L, Gounaris K, Griffiths C, et al. Heterologous expression and enzymatic properties of a selenium-independent glutathione peroxidase from the parasitic nematode Brugia pahangi[J]. Journal of Biological Chemistry, 1995, 270(31):18313-18318. |
| [18] | Patnaik PR. Investigation of induction effect on the steady state performance of a continuous fermentation for recombinant β-ga1actosidase[J]. Process Biochemistry, 2001, 36(11):1069-1074. |
| [19] | 黄演婷, 卢雪梅, 汪洁, 等. 肝靶向干扰素(IFN-CSP)融合基因原核表达条件的优化[J]. 生物医学工程学杂志, 2014, 2:36. |
| [20] | Weickert MJ, Pagratis M, Curry SR, et al. Stabilization of apoglobin by low temperature increases yield of soluble recombinant hemoglobin in Escherichia coli[J]. Applied and Environmental Microbiology, 1997, 63(11):4313-4320. |





