1993年,ASR(Abscisic acid-stress-ripening)基因首次在番茄中被发现[1],随后多个物种的ASR基因被分离到。有趣的是,ASR基因在拟南芥基因组中不存在[2, 3]。ASR基因编码的蛋白具有转录因子和LEA(Late embryogenesis abundant protein)蛋白的基本特征。ASR基因的功能主要是参与调控植物生长发育、衰老、果实成熟、激素信号转导以及对逆境胁迫的应答[2, 3]。
多个物种的ASR基因都被报道受水分胁迫(干旱、渗透、脱水胁迫)以及ABA诱 导[2, 3],ASR基因也因此而得名。2005年Yang等[4]研究表明,百合的ASR基因(LLA23)受ABA、脱水胁迫和高盐胁迫诱导。随后,在拟南芥中过量表达百合ASR基因(LLA23)发现,LLA23过表达株系提高了对干旱胁迫的耐受性。生理学分析表明,在干旱处理条件下,转基因株系具有较低的水散失率;在甘露醇渗透胁迫处理条件下,转基因株系的发芽率高于野生型。此外,LLA23的过量表达能够改变转基因植株中ABA和胁迫相关基因的表达水平。这一结果首次从遗传学上证明了ASR基因参与调控ABA信号转导,并能增强植物对干旱胁迫的耐受性。随后,来自于番茄、香蕉、玉米、水稻、小麦的ASR基因都被报道在提高植物抗旱性上发挥着重要作用[5, 6, 7, 8, 9, 10]。这些研究结果证明了ASR基因通过减少水分散失、促进渗透平衡、减少细胞损伤、降低活性氧积累、诱导抗氧化系统等生物学过程增强植物对干旱和渗透胁迫的耐受性[5, 6, 7, 8, 9, 10]。所以可以肯定,ASR基因参与ABA信号转导,并能提高植物对干旱胁迫的耐受性,但是其作用机制仍然有待于进一步研究。
木薯(Manihot esculenta Crantz)是三大薯类作物之一,全球第六大粮食作物,被誉为“淀粉之王”,是世界近8亿人口赖以生存的粮食。在我国,木薯作为新型能源、工业原料和潜在的粮食作物,具有良好的发展潜力,是热带和亚热带地区最重要的经济作物之一。木薯具有耐旱的生物学特性,一般情况下,木薯能够忍耐4-6个月的干旱胁迫,是一种典型的耐旱作物[11]。木薯特殊的耐旱能力表现在通过丰富的根系从土壤深层吸收水分(地下2 m),通过快速的气孔关闭减少水分散失,通过老叶片脱落减少水分消耗,最终提高木薯对水分的利用效率,从而使木薯具有耐旱的特性。而且,在干旱胁迫后恢复浇水,木薯能够快速地再生新叶片,维持正常的新陈代谢,并补偿生物量[12]。木薯在干旱胁迫下对水分的吸收、气孔运动、叶片脱落等生物学过程都是受ABA控制的关键生物学过程。因此,Okogbenin等[12]提出ABA生物合成及信号转导可能是调控木薯特殊耐旱性的关键途径之一。最近的研究表明,木薯在适应干旱胁迫的过程中可能通过减缓生长,从而延长对干旱胁迫的耐受时间;或者通过老叶片的脱落维持一定的生长,从而抵抗干旱胁迫[13]。虽然,近年来的研究取得了一定的研究进展,但是对木薯耐旱机理的研究还不深入。本研究从木薯克隆第一个ASR基因(MeASR),分析MeASR的细胞定位,并研究该基因在干旱和ABA处理的表达水平,旨在研究木薯中的干旱胁迫应答基因,为进一步解析木薯的耐旱机理提供参考。
1 材料与方法 1.1 材料实验所用木薯品种为KU50,由中国热带农业科学院热带生物技术研究所提供。
1.2 方法 1.2.1 材料处理将木薯茎秆用刀切成约10 cm长的小节,每一小节含数个芽眼。将茎秆插入含有营养土和蛭石的盆中,待其发芽、生根。将生长两个月、且长势一致的木薯幼苗作为供试材料,以不处理的木薯幼苗作为对照,设置两个处理组:(1)甘露醇处理组共24颗木薯幼苗,每个样品3颗,用300 mmol/L甘露醇对木薯幼苗进行0 h、2 h、6 h、3 d、14 d、18 d、24 d和36 d灌根处理;(2)ABA处理组共21颗木薯幼苗,每个样品3颗,用100 µmol/L ABA对木薯幼苗进行0、2、6、10、24、48和72 h(甘露醇、脱落酸等生化试剂购自上海生工生物工程有限公司)喷施。取每个处理的木薯幼苗叶片用液氮冷冻,并放入-80℃超低温冰箱保存。
1.2.2 RNA的提取及cDNA的合成分别取1.2.1不同处理后的幼苗叶片,按照RNA提取试剂盒(天根生化科技有限公司)的使用方法提取木薯总RNA。同时,利用RevertAid First Strand cDNA Synthesis Kit(Fermentas公司)将提取的总RNA反转录成cDNA,并于-20℃保存备用。
1.2.3 基因克隆以获得的cDNA第一链为模板,设计正向引物P1:5'-ATGGCAGAAGAGAATAAGCA-3'和反向引物P2:5'-TTAAAAGAGATGGTGATGCTT-CT-3'进行PCR扩增。反应体系为:Taq DNA聚合酶(康为世纪生物公司)0.5 µL,dNTP 0.5 µL,10× Buffer 2 µL,上下游引物各0.5 µL,cDNA 模板1 µL,ddH2O 15.5 µL;反应程序为:94℃预变性5 min;94℃变性20 s,48℃退火20 s,72℃延伸30 s,35个循环;72℃延伸10 min。PCR扩增产物经回收、连接、转化后,挑取单克隆在LB液体培养基中培养,并进行PCR鉴定。然后将已鉴定的阳性克隆送华大基因生物科技公司测序。
1.2.4 生物信息学分析利用DNAMAN 软件和BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列比对和保守结构预测;利用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)及GENSCAN(http://genes.mit.edu/GENSCAN.html)进行基因开放阅读框预测;利用MEGA 5.0软件构建进化树。
1.2.5 亚细胞定位分析根据MeASR基因的ORF序列设计带有酶切位点NcoI/SpeI且不含终止子的引物:P3:5'-CATGCCATGGCGATGGCAGAAGAGAATAAGCA-3';P4:5'-GGACTAGTAAAGAGATGGTGATGCTTCT-3'。从正常生长两个月的木薯幼苗叶片cDNA中扩增MeASR基因的开放阅读框,将扩增产物回收后连接到克隆载体pMD18-T上,获得重组质粒,阳性克隆测序正确后,用NcoI/SpeI进行双酶切并回收目的片段。同时,利用 NcoI/SpeI双酶切pCAMBIA1304载体,并回收载体片段。利用T4连接酶将目的片段和载体片段进行连接,将连接产物转化大肠杆菌DH5α后,挑取单克隆扩大培养,经PCR和质粒双酶切验证后,进行测序分析,构建成植物表达载体pCAMBIA1304-MeASR-GFP。将测序正确的阳性克隆的质粒转入农杆菌LBA4404中。利用农杆菌介导的瞬时转化法将pCAMBIA1304-MeASR-GFP导入洋葱表皮细胞中,随后将洋葱表皮放在铺有滤纸的MS培养基上,25℃暗培养16-24 h,然后制作装片,通过FluoViewTM FV1000激光扫描共聚焦显微镜观察荧光信号。
1.2.6 基因的表达分析根据TaKaRa实时荧光定量标准说明书设计qRT-PCR引物(MeASR:P5 5'-TCACAAGGAAGGCGAAGA-3';P6:5'-GCAAAGGC-AAATCCAATA-3';MeEF1引物:P7:5'-TGAACC-ACCCTGGTCAGATTGGAA-3',P8:5'-AACTTGGG-CTCCTTCTCAAGCTCT-3'),引物均由上海生工生物工程有限公司合成。为了保证引物的特异性,引物设计在非保守区域,PCR产物的长度维持在300 bp以内,并进行了测序分析。以1.2.2中得到的cDNA为模板,以木薯MeEF1基因为内参进行qRT-PCR分析。实时荧光定量PCR 采用SYBR Green Ⅰ试剂盒(TaKaRa公司),按照操作说明在Mx 3005P荧光定量PCR仪(吉泰生物科技有限公司)上进行。荧光定量PCR的反应程序:95℃预变性3 min;95℃变性7 s,55℃退火10 s,72℃延伸15 s,循环40次。荧光定量PCR的反应体系:SYBR GreenⅠ10 µL,ROX 0.4 µL,引物0.5 µL,cDNA模板1 µL,ddH2O 7.6 µL。每个样品的qRT-PCR实验都在相同的反应体系下进行3次生物学重复。结果分析计算采用2-ΔΔCt 法[14]:
ΔΔCt=(CT,Target-CT,Actin)Time x-(CT,Target-CT,Actin)Time 0。
2 结果 2.1 MeASR基因的克隆及生物信息学分析根据木薯数据库中的序列信息,发现一个cDNA序列与ASR家族基因具有较高的同源性。利用P1/P2引物对正常生长两个月的木薯幼苗叶片cDNA进行PCR扩增,克隆该基因的cDNA全长序列(图 1)。将扩增产物插入T载体并测序后,经GENSCAN、Blast和ORF Finder分析发现,该cDNA 序列中存在一个330 bp的开放阅读框(ORF),编码109个氨基酸,将其命名为MeASR。BLASTN分析表明,MeASR与大豆的ASR基因(NM_001250558)具有较高的一致性(84%)。多序列比对分析(图 2)表明,该基因编码的氨基酸序列具有一个保守的组氨酸富集区,两个丙氨酸富集区,一个豆蔻酰化位点。进化树分析(图 3)表明,MeASR蛋白与番茄SlASR4亲缘关系较近。
 |
| M:DNA Marker;1:MeASR 基因的cDNA全长图 1 MeASR基因的cDNA全长电泳图 |
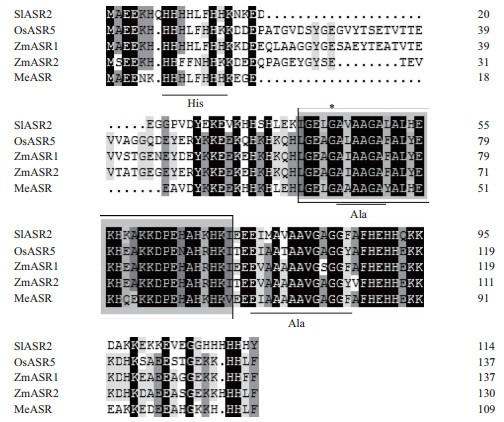 |
| ABA/WDS结构域用方框表示;豆蔻酰化位点用星号表示;组氨酸富集区和丙氨酸富集区用单横线表示图 2 MeASR与其它ASR的多序列比对分析 |
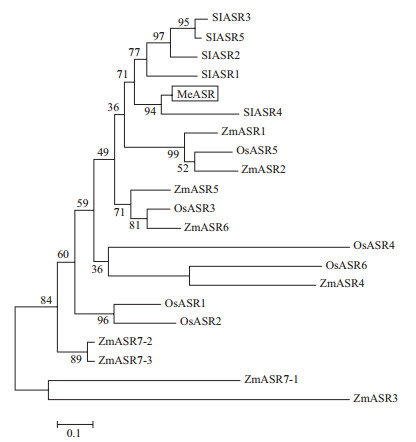 |
| 图 3 MeASR与水稻、番茄、玉米ASR家族成员的系统进化树 |
利用农杆菌介导的瞬时转化法将构建成功的植物表达载体pCAMBIA1304-MeASR-GFP和pCAMBIA1304空载体分别导入洋葱表皮细胞,25℃暗培养24 h后,在激光共聚焦显微镜下观察绿色荧光蛋白信号在细胞内的分布,结果(图 4)显示,pCAMBIA1304-MeASR-GFP仅在洋葱表皮细胞的细胞核中表达,而pCAMBIA1304空载体在细胞膜、细胞质和细胞核中都有分布。这些结果表明MeASR蛋白定位在细胞核上。
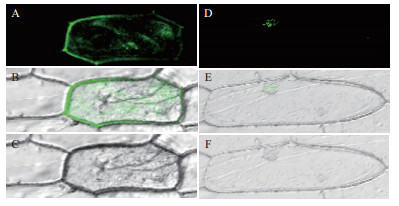 |
| A:pCAMBIA1304的绿色荧光信号图;C:pCAMBIA1304的明场图;B:A与C的叠合图;D:MeASR-GFP的绿色荧光信号图;F:明场图;E:D与F的叠合图图 4 MeASR亚细胞定位分析 |
利用实时荧光定量PCR的方法研究了木薯在渗透胁迫及ABA处理下MeASR基因的表达水平。结果表明,经甘露醇处理2 h和6 h,MeASR表达水平显著增强,处理3-18 d轻微下降,处理时间延长至24 d时其表达水平最高(图 5-A)。在ABA处理10 h,MeASR表达无显著变化,在处理24 h 和48 h显著增强(图 5-B)。这些结果表明,MeASR能够在转录水平受渗透胁迫和ABA诱导。
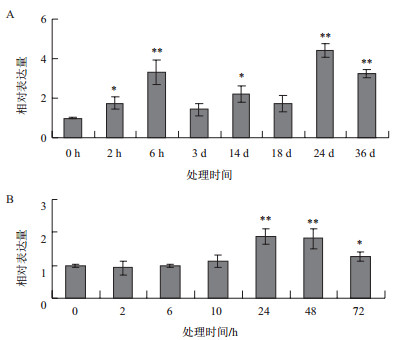 |
| A:甘露醇处理;B:脱落酸处理。误差线表示4次重复的标准差;* 表示t-检验的显著性分析(*P<0.05;**P<0.01)图 5 MeASR基因在甘露醇和脱落酸处理下的表达分析 |
干旱胁迫是影响植物生长发育以及作物产量和品质的重要环境因子。植物对干旱胁迫的应答主要是通过对胁迫信号的感知和转导,促进胁迫相关基因的表达和蛋白质的合成,导致生理生化的变化和代谢物的合成,从而降低胁迫所导致的伤害。植物对干旱胁迫的响应是一个非常复杂的过程,其中转录调控是植物应答干旱胁迫的一种重要方式。所以,转录因子在植物对干旱胁迫的应答过程中起着至关重要的作用[15]。ASR蛋白具有转录因子和LEA蛋白的基本特征。一些研究表明ASR蛋白定位在细胞核中,具有转录激活活力,能够以Zn2+依赖的方式与DNA结合,从而激活转录。然而,ASR蛋白也被认为属于第7类和胚胎发育晚期丰富蛋白(Late embryogenesis abundant protein,LEA),具有分子伴侣功能,能够对细胞进行直接地保护[2, 3]。因此,可以推测,不同的ASR家族成员可能具有不同的生化特征。亚细胞定位分析表明,MeASR蛋白定位在细胞核,这与转录因子的特征相符,这一结果与小麦TaASR1和葡萄ASR定位在细胞核中的结果一致[9, 16],为进一步研究MeASR转录因子的基本特征提供参考。
ASR家族基因被报道广泛地参与植物对干旱胁迫的应答,并且多个物种的ASR基因都被报道在提高植物抗旱性上发挥着重要作用。而且,值得注意的是,在玉米中过表达ZmASR1发现,在正常生长条件下转基因株系的产量比野生型高7%-17%。而且,在干旱胁迫下,ZmASR1转基因植株仍然能够维持这一产量性状[7]。一些ASR家族基因的进化被证明是植物对干旱性状正向选择的结果。所以,ASR基因是作物抗性育种较为重要的候选基因。本研究分析了MeASR基因在干旱及ABA处理下的表达模式,结果表明该基因能够在转录水平显著受干旱和ABA诱导。这一研究结果与番茄ASR1、水稻OsAsr1、香蕉MpASR、玉米ZmASR1、小麦TaASR1等基因在干旱及ABA处理下的表达模式相似[5, 6, 7, 8, 9, 10]。而且,这些基因已经从遗传学上被证明能够提高植物对干旱胁迫的耐受性。因此,木薯MeASR可能具有抗旱功能。
4 结论本研究克隆了木薯ASR基因MeASR,亚细胞定位结果表明MeASR蛋白定位在细胞核上。此外,利用实时荧光定量PCR对MeASR基因在干旱及ABA处理下的表达模式也进行了分析,结果表明该基因在转录水平受渗透胁迫和ABA诱导。
| [1] | Iusem ND, Bartholomew DM, Hitz WD, et al. Tomato(Lycopersicon esculentum)transcript induced by water deficit and ripening[J]. Plant Physiol, 1993, 102(4):1353-1354. |
| [2] | Carrari F, Fernie AR, Iusem ND. Heard it through the grapevine? ABA and sugar cross-talk:the ASR story[J]. Trends Plant Sci, 2004, 9(2):57-59. |
| [3] | González RM, Iusem ND. Twenty years of research on Asr(ABA-stress-ripening)genes and proteins[J]. Planta, 2014, 239(5):941-949. |
| [4] | Yang CY, Chen YC, Jauh GY, et al. A lily ASR protein involves abscisic acid signaling and confers drought and salt resistance in Arabidopsis[J]. Plant Physiol, 2005, 139(2):836-846. |
| [5] | Golan I, Dominguez PG, Konrad Z, et al. Tomato abscisic acid stress ripening(ASR)gene family revisited[J]. PLoS One, 2014, 9(10):e107117. |
| [6] |
Dai JR, Liu B, Feng DR, et al. MpAsr encodes an intrinsically unstructured protein and enhances osmotic tolerance in transgenic |
| [7] | Virlouvet L, Jacquemot MP, Gerentes D. The ZmASR1 protein influences branched-chain amino acid biosynthesis and maintains kernel yield in maize under water-limited conditions[J]. Plant Physiol, 2011, 157(2):917-936. |
| [8] | Joo J, Lee YH, Kim YK, et al. Abiotic stress responsive rice ASR1 and ASR3 exhibit different tissue-dependent sugar and hormone-sensitivities[J]. Mol Cells, 2013, 35(5):421-435. |
| [9] | Hu W, Huang C, Deng X, et al. TaASR1, a transcription factor gene in wheat, confers drought stress tolerance in transgenic tobacco[J]. Plant Cell Environ, 2013, 36(8):1449-1464. |
| [10] | Kim IS, Kim YS, Yoon HS. Rice ASR1 protein with reactive oxygen species scavenging and chaperone-like activities enhances acquired tolerance to abiotic stresses in Saccharomyces cerevisiae[J]. Mol Cells, 2012, 33(3):285-293. |
| [11] | Lokko Y, Anderson JV, Rudd S, et al. Characterization of an 18, 166 EST dataset for cassava(Manihot esculenta Crantz)enriched for drought-responsive genes[J]. Plant Cell Reports, 2007, 26:1605-1618. |
| [12] | Okogbenin E, Setter T, Ferguson M, et al. Phenotypic approaches to drought in cassava:review[J]. Frontiers in Physiology, 2013, 4:1-15. |
| [13] | Zhao P, Liu P, Shao J, et al. Analysis of different strategies adapted by two cassava cultivars in response to drought stress:ensuring survival or continuing growth[J]. J Exp Bot, 2014, doi:10. 1093/jxb/eru507. |
| [14] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Method, 2001, 25(4):402-408. |
| [15] | Umezawa T, Fujita M, Fujita Y, et al. Engineering drought tolerance in plants:discovering and tailoring genes to unlock the future[J]. Curr Opin Biotechnol, 2006, 17(2):113-122. |
| [16] | Cakir B, Agasse A, Gaillard C, et al. A grape ASR protein involved in sugar and abscisic acid signaling[J]. Plant Cell,2003,15(9):2165-2180. |




