干旱、盐碱、低温等非生物逆境胁迫是影响作物生长发育和产量的重要限制因子。为了维持整个植株细胞活动的完整性,植物通过各种各样的机制来适应不良胁迫[1]。迄今为止,人们已经从各种植物中分离和鉴定了许多胁迫应答相关的基因,如锌指蛋白、转录因子和离子通道等[2]。
其中,具有“手指状”结构域的锌指蛋白(Zinc finger protein),是一类在调节植物防卫基因表达和抗性反应上起关键作用的蛋白[3]。该蛋白在真核生物基因组中十分丰富,根据半胱氨酸(C)和组氨酸(H)残基的数目和位置,可将锌指结构分为C2H2、C4和C6三个亚类[4]。其中C2H2型锌指蛋白是真核生物中最大的转录因子,同时也是研究得最为清楚的一类,广泛参与植物的发育过程和非生物响应过程[5]。在一些研究中,过量表达C2H2型锌指蛋白不仅可以提高耐盐、干旱、冷胁迫,还可以改变胁迫响应过程中下游基因的表达及信号传导[6, 7]。在拟南芥(Arabidopsis thaliana)中过量表达锌指蛋白基因AZF1和AZF3,可提高植物的耐盐性和耐冷性[6],表明它们参与到植物的耐盐和耐冷反应过程;矮牵牛(Petunia)中的C2H2型锌指蛋白ZPT2-2在胁迫诱导后表达量上调,过量表达ZPT2-2可增强矮牵牛的耐旱性[8];大豆(Glyycine soja)C2H2型锌指蛋白GsZFP1在拟南芥中过量表达,可增加拟南芥耐冷耐旱反应过程[9];在苜蓿中异位表达可增加苜蓿的耐盐耐旱性[10]。尽管对锌指蛋白的研究很多,但是在大多数植物中C2H2型锌指蛋白的生理和生化功能还不清楚。
无苞芥俗称新疆小拟南芥,具有比拟南芥更耐高盐胁迫的生理特性[11]。前期从无苞芥中克隆到了C2H2型锌脂蛋白基因OpZFP,该基因全长为684 bp,编码174个氨基酸。表达分析表明OpZFP基因受高盐、干旱和低温等胁迫的诱导表达,分析OpZFP基因启动子序列,发现该基因启动子上有多个与胁迫相关的顺式作用元件[12],暗示着OpZFP基因可能参与到无苞芥的耐逆胁迫反应过程。本研究构建过量表达载体,通过叶盘法转化烟草[13],对转基因烟草进行耐盐分析,旨在为进一步研究该基因的功能奠定基础。
1 材料与方法 1.1 材料烟草(Nicotiana tobacum)种子为本实验室保存,种子的灭菌和室内培养参照文献[14]的方法进行。大肠杆菌菌株DH5α、质粒pCAMBIA2300-CaMV35S由本实验保存;质粒pMD18-T vector、限制性内切酶、Ex Taq、IPTG、X-Gal购自TaKaRa公司;凝胶回收试剂盒购自Promega公司。其它试剂为国产分析纯。
1.2 方法 1.2.1 构建过量表达载体将前期得到的测序正确的质粒pMD18-T:OpZFP[12]用KpnⅠ和BamHⅠ酶切回收目的片段,同时用同样的酶对pCAMBIA2300-CaMV35S-OCS载体进行双酶切,回收质粒大片段,经T4连接酶(TaKaRa)连接。将连接产物p35S:OpZFP经热激法转化DH5α感受态细胞,挑取单克隆进行菌落PCR鉴定,提取质粒,进行酶切鉴定。
1.2.2 转基因烟草的鉴定将鉴定正确的质粒,通过冻融法转化农杆菌GV3101菌株,用叶盘法[13]转化烟草,将获得的烟草再生苗移植到恒温培养室中进行培养。用CTAB法提取烟草再生苗DNA,用引物KpnⅠ-OpZFP-F和BamHⅠ-OpZFP-R(表 1)进行PCR鉴定,PCR扩增程序为:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸30 s,30个循环;72℃延伸10 min。用1%的琼脂糖凝胶电泳鉴定。将鉴定正确的烟草植株,通过半定量RT-PCR分析烟草过量表达植株中OpZFP基因的表达情况,以烟草的Actin1基因序列设计内参引物NtActin-F和NtActin-R(表 1)。
对经筛选确定为纯系的T3代种子进行消毒,将种子平铺在0.5×MS培养基上,其成分含有1%的Glucose,2.2 g/L Murashige & Skoog Medium(Duchefa Biochemie,Netherland),0.05%的MES(Amersham,America),0.8 % Agar,pH5.8。4℃春化3 d后,移入22℃(16 h光照/8 h黑暗)培养箱中。培养10 d后,分别将生长状况一致的幼苗转入含有100 mmol/L和300 mmol/L NaCl的0.5×MS培养基中,以不加NaCl的0.5×MS培养基作为对照组,培养5 d后,观察表型并测量盐胁迫后的根长。胁迫后采用TCA-TBA法[15]测定丙二醛(MDA)质量摩尔浓度。称取烟草幼苗,加0.05 g/mL的TCA 5 mL,研磨后所得匀浆于3 000 r/min离心10 min。取上清2 mL,加0.000 67 g/mL硫代巴比妥酸2 mL,混合后于100℃水浴煮沸30 min,冷却后再以3 000 r/min离心10 min。分别测定上清液在450、532和600 nm的吸光度值A450、A532和A600,然后计算MDA浓度(μmol/L)及MDA质量摩尔浓度(μmol/g)。MDA浓度计算公式:MDA浓度=6.45×(A532-A600)-0.56×A450。MDA摩尔浓度=(MDA浓度×4×5/2)/样品质量。
1.2.4 转基因烟草离体叶片耐盐分析分析方法参照文献[16]的方法进行。取同样大小的普通烟草和转基因烟草,在烟草的第5片叶子上打孔(直径为1 cm),分别放入0、100和200 mmol/L的NaCl溶液中,叶片正面朝上,处理3 d,观察表型。
2 结果 2.1 烟草的转化及抗性植株的鉴定用叶盘法转化烟草经卡那霉素筛选获得了12株再生苗。提取野生型和烟草再生苗基因组DNA,经PCR反应(图 1),在12株转基因烟草植株中扩增出与阳性对照一致的684 bp的特异性条带,而野生型的对照植株未出现阳性条带。说明OpZFP基因已转到烟草中。
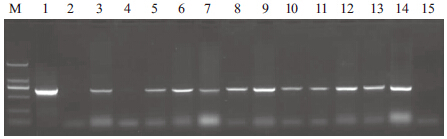 |
| M :分子量Marker DL2000 ;1 :p35S :OpZFP 质粒;2 :野生型烟草对照; 3-14 :转基因烟草L1-L12 ;15 :阴性对照 图 1 转基因烟草的鉴定 |
为了检测转基因烟草中OpZFP基因mRNA的转录水平,以野生型烟草为对照,NtActin为内参基因,用半定量RT-PCR方法检测了转基因烟草株系L9和L11中OpZFP基因的表达情况,结果(图 2)表明OpZFP基因在两个转基因植株中都有很高的表达。
 |
| 图 2 半定量分析转基因烟草中OpZFP基因的表达量 |
为研究OpZFP过量表达株系的耐盐能力,选取OpZFP高表达量株系L9和L11进行耐盐性分析。将转化株自交收获T2代种子,并通过卡那霉素抗性筛选得到稳定遗传的T3代纯合种子。
2.3.1 盐胁迫条件下OpZFP基因过量表达对烟草生长的影响为研究转基因植株幼苗期耐盐性,分别用不同浓度NaCl溶液处理野生型和转基因烟草株系L9和L11。结果表明,随着盐胁迫处理浓度的增加,野生型植株和转OpZFP植株的根长均减少,生长发育延缓,说明盐胁迫对烟草的生长有抑制作用。在未胁迫处理和100 mmol/L NaCl处理下,转基因植株和野生型植株相差不大。但在300 mmol/L NaCl胁迫处理后,转基因植株和野生型植株出现了明显的区别:野生型的叶片变黄,而转基因两个株系在胁迫处理条件下,叶片颜色受抑制程度较小(图 3-A)。分析盐胁迫前后烟草的根长发现,在300 mmol/L NaCl处理下,L11的根长要明显长于野生型植株(图 3-B),说明OpZFP可提高烟草的耐盐性。
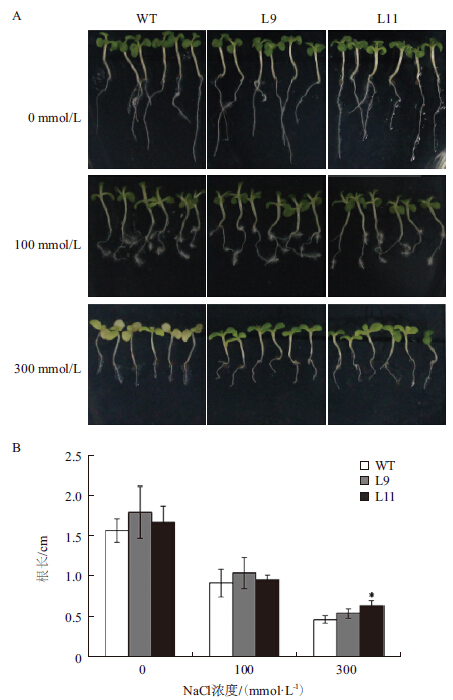 |
| A :不同浓度盐胁迫下OpZFP 转基因植株(L9 和L11)和野生型植株(WT) 的表型变化;B :不同浓度盐胁迫下OpZFP 转基因植株(L9 和L11)和野 生型植株(WT)的根长变化。其中,* 表示P<0.05,差异显著;** 表示 P<0.01,差异极显著,下同 图 3 OpZFP 转基因植株耐盐性表型(A)及根长(B)变 化分析 |
测定盐处理后OpZFP转基因烟草的MDA含量,发现随着胁迫浓度的增大,MDA的含量也增大。未胁迫处理下,野生型和转基因烟草的MDA含量没有明显的差别,但在100 mmol/L和300 mmol/L NaCl胁迫下,转基因和野生型烟草中MDA的含量明显升高,但转基因烟草MDA的含量要比野生型少,说明转基因烟草较野生型来说细胞膜受到的伤害程度低(图 4)。进一步说明OpZFP可提高烟草的耐盐性。
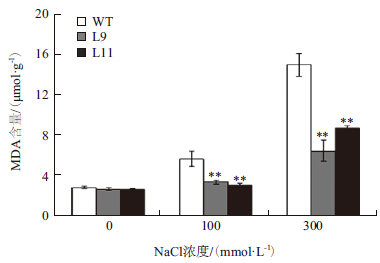 |
| 图 4 野生型和OpZFP 转基因植株盐胁迫后MDA 的含量的测定 |
将野生型烟草和转OpZFP烟草离体叶片用不同浓度NaCl处理3 d,结果(图 5)显示,盐处理后转基因及野生型烟草的离体叶片均表现出伤害症状,且症状随着盐浓度的升高更加明显。在相同浓度盐胁迫下,转基因烟草受伤害程度明显低于野生型。100 mmol/L NaCl处理下野生型叶片整体变黄发白,而转基因的两个line中只有L9叶片变黄,L11的叶片颜色与未处理条件下叶片颜色相同。对处理后叶片的叶绿素进行测定,发现100 mmol/L盐处理后两个转基因叶片的叶绿素的含量要高于野生型含量(图 6)。200 mmol/L NaCl处理下野生型烟草边缘泛白,且叶片中间出现黄化现象,而转基因烟草叶片发黄。并且转基因叶片的叶绿素含量要高于野生型烟草(图 6),说明转基因烟草的抗盐性相对较强。
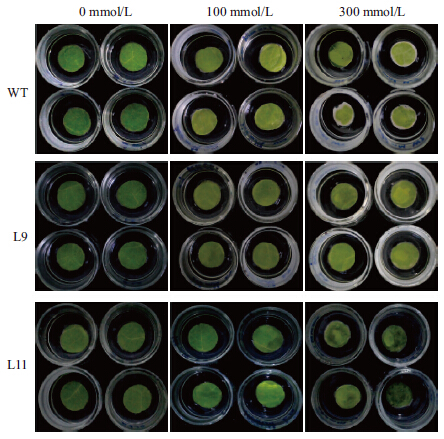 |
| 图 5 离体烟草叶片不同盐浓度处理后比较 |
 |
| 图 6 烟草离体叶片在不同盐浓度处理下叶绿素的测定 |
C2H2型锌指蛋白广泛存在于高等植物中,在植物生长发育和胁迫应答等生命活动过程中具有重要作用。因此更多的C2H2型锌脂蛋白的克隆及其生物学功能研究有助于进一步阐明植物生长发育、胁迫应答等生命过程的分子机制[5]。前期研究表明无苞芥锌指蛋白OpZFP是一个C2H2型转录因子,具有典型的“QALGGH”保守序列和一个EAR结构域。在结构上,无苞芥锌指蛋白OpZFP同拟南芥AtZFP1的相似性最高[12]。本研究发现,在烟草中过量表达OpZFP基因可提高烟草的耐盐能力,并且转基因植株在盐胁迫处理后MDA含量显著低于野生型烟草,叶绿素的含量要高于野生型烟草,这同与角果碱蓬耐盐基因盐液泡质子焦磷酸酶ScVP基因[17]、无苞芥耐盐基因液泡质子焦磷酸酶OpVP基因[18]类似。表明OpZFP基因可降低烟草对盐胁迫的敏感性,增加烟草的耐盐性,暗示着OpZFP基因在植物的耐盐响应过程中具有重要作用。我们发现将烟草幼苗盐胁迫处理后,虽然从烟草的生理指标中可以看出转基因比野生型耐盐,但转基因烟草同野生型烟草植株大小、株型没有明显差别。只有在高盐胁迫下(300 mmol/L NaCl)转基因烟草在形态上才与野生型稍有不同,转化体叶片颜色浅绿而野生型叶片则较黄,且只有一个转化体(L11)的根长要显著长于野生型。以上结果表明OpZFP基因可能只通过生理调节提高烟草耐盐能力,对烟草的形态建成具有较小的影响。
前期研究发现C2H2型锌指蛋白不但参与到植物的耐逆过程,在植物的生理发育过程也具有重要的作用。如大豆GmZFP1参与到大豆种子的后期发育过程中[19];拟南芥TTL基因是胚乳发育中不可或缺的一个基因[20];拟南芥另一个C2H2型锌指蛋白SUPERMAN基因在雄蕊发育、花发育及果实发育过程中具有重要作用[21];与OpZFP结构最相似的锌指蛋白AtZFP1则参与到枝条的发育过程中[22]。表明无苞芥OpZFP基因可能还参与到其他生理发育过程。OpZFP基因是否具有调节生理发育功能如促进植物开花,促进种子发育等仍需进一步研究。
4 结论叶盘法转化获得转OpZFP基因烟草,半定量qRT-PCR表明,OpZFP基因可在烟草中高表达。用不同盐浓度处理烟草幼苗,转基因烟草根长长于野生型幼苗,且MDA含量低于野生型。高盐处理烟草离体叶片使非转基因烟草叶绿素降解严重,表明OpZFP具有耐盐性。
| [1] | Mao X, Zhang H, Qian X, et al. TaNAC2, a NAC-type wheat transcription factor conferring enhanced multiple abiotic stress tolerances in Arabidopsis[J]. J Exp Bot, 2012, 63(8):2933-2946. |
| [2] | Mansur LM, Orf JH, Chase K, et al. Genetic mapping of agronomic traits using recombinant inbred lines of soybean[J]. Crop Sci, 1996, 36(5):1327-1336. |
| [3] | Gamsjaeger R, Liew CK, Loughlin FE, et al. Sticky fingers:zinc-finger as protein as protein-recognition motifs[J]. Trends Biochem Sci, 2007, 32(2):63-70. |
| [4] | MacPherson S, Larochelle M, Turcotte B. A fungal family of transcriptional regulators:the zinc cluster proteins[J]. Microbiol Mol Biol Rev, 2006, 70(3):583-604. |
| [5] | Ciftci-Yilmaz S, Mittler R. The zinc finger network of plants[J]. Cell Mol Life Sci, 2008, 65(7-8):1150-1160. |
| [6] | Huang XY, Chao DY, Gao JP, et al. A previously unknown zinc finger protein, DST, regulates drought and salt tolerance in rice via stomatal aperture control[J]. Genes Dev, 2009, 23(15):1805-1817. |
| [7] | Sakamoto H, Maruyama K, Sakuma Y, et al. Arabidopsis Cys2/His2-type zinc-finger proteins function as transcription repressors under drought, cold, and high-salinity stress conditions[J]. Plant Physiol, 2004, 136(1):2734-2746. |
| [8] | Sugano S, Kaminaka H, Rybka Z, et al. Stress-responsive zinc finger gene ZPT2-3 plays a role in drought tolerance in petunia[J]. Plant J, 2003, 36(6):830-841. |
| [9] | Luo X, Bai X, Zhu D, et al. GsZFP1, a new Cys2/His2-type zinc-finger protein, is a positive regulator of plant tolerance to cold and drought stress[J]. Planta, 2012, 235(6):1141-1155. |
| [10] | Tang L, Cai H, Ji W, et al. Overexpression of GsZFP1 enhances salt and drought tolerance in transgenic alfalfa(Medicago sativa L. )[J]. Plant Physiol Biochem, 2013, 71:22-30. |
| [11] | 张海波, 刘彭, 刘立鸿, 等. 新疆短命植物小拟南芥耐盐性的初步研究[J]. 西北植物学报, 2007, 27(2):286-290. |
| [12] | 郭丹丽, 王崎崎, 吴晓庆, 等. 新疆无苞芥锌指蛋白基因的克隆及表达分析[J]. 西北植物学报, 2014, 34(2):243-250. |
| [13] | Horsch RB, Klee HJ, Stachel S, et al. Analysis of Agrobacterium tumefaciens virulence mutants in leaf discs[J]. Proc Natl Acad Sci USA, 1986, 83(8):2571-2575. |
| [14] | 院海英, 顾超, 徐芳, 等. 小拟南芥Na+/H+逆向转运蛋白基因的克隆及生物信息学分析[J]. 石河子大学学报:自然科学版, 2011, 29(4):401-407. |
| [15] | 闫甜甜, 徐登献, 郭新勇, 等. 转大肠杆菌KatG基因烟草的获得及其抗逆性鉴定[J]. 西北农业学报, 2014, 23(6):118-126. |
| [16] | Sun YG, Wang B, Jin SH, et al. Ectopic expression of Arabidopsis glycosyltransferase UGT85A5 enhances salt stress tolerance in tobacco[J]. PLoS One, 2013, 8(3):e59924. |
| [17] | Liu L, Wang Y, Wang N, et al. Cloning of a vacuolar H+-pyrophosp-hatase gene from the halophyte Suaeda corniculata whose heterolo-gous overexpression improves salt, saline-alkali and drought tolerance in Arabidopsis[J]. J Integr Plant Biol, 2011, 53(9):731-742. |
| [18] | Xu F, Zhao YX, Wang F, et al. Cloning of a vacuolar H+-pryophosp-hatase gene from emphemeral plant Olimarabidopsis pumila whose overexpression improve salt tolerance in tobacco[J]. Afr J Biote-chnol, 2013, 12(49):6817-6825. |
| [19] | Huang F, Chi Y, Meng Q, et al. GmZFP1 encoding a single zinc finger protein is expressed with enhancement in reproductive organs and late seed development in soybean(Glycine max)[J]. Mol Biol Rep, 2006, 33(4):279-285. |
| [20] | Lu X, Li Y, Su Y, et al. An Arabidopsis gene encoding a C2H2-domain protein with alternatively spliced transcripts is essential for endosperm development[J]. J Exp Bot, 2012, 63(16):5935-5944. |
| [21] | Zhao J, Liu M, Jiang L, et al. Cucumber SUPERMAN has conserved function in stamen and fruit development and a distinct role in floral patterning[J]. PLoS One, 2014, 9(1):e86192. |
| [22] | Chrispeels HE, Oettinger H, Janvier N, et al. AtZFP1, encoding Arabidopsis thaliana C2H2 zinc-finger protein 1, is expressed downstream of photomorphogenic activation[J]. Plant Mol Biol, 2000, 42(2):279-290. |





