2.云南省烟草农业科学研究院,昆明 650031;
3.中国医学科学院医学生物学研究所,昆明 650118
2. Yunnan Academy of Tobacco Agricultural Sciences,Kunming 650031;
3. Institute of Medical Biology,Chinese Academy of Medical Sciences,Kunming 650118
海藻糖(Trehalose)是由两个葡萄糖分子以α,α-1-1糖苷键连接而成的一种非还原双糖,广泛存在于细菌、酵母菌、霉菌、食用菌、低等植物、昆虫、无脊椎动物和高等植物等多种有机体中[1, 2]。海藻糖的非还原性决定了它对酸、碱、高温等的稳定性。另外,它本身具有很强的吸水性,使它在生物体内具有抗脱水作用,在逆境条件下可通过识别外界刺激、产生和传递信号、基因表达和代谢调节来保护植物免受不良环境的伤害[3, 4, 5, 6, 7],尤其在干旱条件下,海藻糖通过氢键与氨基酸相连,能起到防止蛋白质变性和细胞融合的作用[8]。内源海藻糖之所以能提高植物的抗逆性,是因为它具有保护恶劣环境下植物细胞活性物质免遭破坏的非特异功能,能增加双层脂膜的流动性和酶的稳定性[9]。
植物体内主要以葡萄糖为底物合成海藻糖。该反应首先在海藻糖-6-磷酸合成酶(trehalose 6-phosphate synthesase,TPS)的作用下,催化尿苷二磷酸葡萄糖(UDP)和6-磷酸葡萄糖反应生成中间产物6-磷酸海藻糖,再在海藻糖-6-磷酸磷酸酶(trehalose 6-phosphate phosphatase,TPP)的作用下去磷酸化,生成海藻糖。海藻糖的分解主要通过以海藻糖为专一底物的海藻糖酶(Trehalase,THase)的水解反应实现[10]。
已有一些研究表明,某些物种对不良环境的抗逆耐受能力与它们体内的海藻糖浓度有直接关系[11]。目前,在烟草[12]、棉花[13]、小麦[14]等作物中已有了较深入的研究,但大多数研究主要集中在某个单一胁迫下海藻糖含量及酶类活性的变化,然而在自然界中,植物往往面临着多种逆境胁迫,如春播作物的幼苗往往同时面临着低温和干旱的胁迫。而目前尚未见到海藻糖参与植物对干旱和低温的共同响应及其响应差异比较的相关报道。因此,本实验以烟草为材料,通过不同时间的干旱和低温处理,研究烟草幼苗海藻糖含量、相关酶活性及基因表达的变化,旨在了解植物细胞海藻糖对干旱和低温的响应及其差异,为进一步研究海藻糖参与植物的抗旱抗冷机制提供理论参考。
1 材料与方法 1.1 材料材料培养及处理方法参照本实验室前期的处理方法[15, 16]。供试材料为烟草(Nicotiana tabacum L.)品种云烟203,采用烟草悬浮育苗(参照GB/T25241.1-2010 烟草集约化育苗技术规程),称重法控制土壤水分含量(漂浮盘每孔中烟草专用基质干重为4.5 g),在26/20℃、光照时间为16/8 h(昼/夜)、相对湿度(RH) 70%的人工气候箱(三洋,日本)中正常培养至十字期。
1.2 方法 1.2.1 胁迫处理 1.2.1.1 干旱胁迫处理当幼苗在漂浮盘中生长到四叶一心时,排干漂浮池中的水分,并将漂浮盘架空,在26/20℃、光照时间为16/8 h(昼/夜)、RH70%条件下,使培养基质逐渐失水,从而对幼苗造成干旱胁迫,并在干旱胁迫的不同阶段(0、0.5、1、2、4和6 d)进行样品采集,取叶片,液氮速冻后迅速置于-80℃保存备用。干旱胁迫6 d后幼苗已严重萎蔫,并已有大量的幼苗死亡[15]。
1.2.1.2 低温胁迫处理当幼苗在漂浮盘种生长至四叶一心时,培养温度降至4℃低温胁迫,其他培养条件不变,在低温胁迫的不同阶段(0、0.5、1、2、4 和6 d)进行样品采集,取叶片,液氮速冻后迅速置于-80℃保存备用。
1.2.2 海藻糖含量的测定海藻糖含量的测定参照宋维民等[17]的蒽酮-硫酸法稍作改动,称取0.2 g植物叶片,在冰水浴中用1 mL 0.5 mol/L三氯乙酸溶液研磨,定容到5 mL,0℃震荡2 h,10 000 r/min离心10 min,取上清液0.2 mL,加入0.2 mL 0.1 mol/L H2SO4,摇匀后沸水浴加热10 min(从水浴中心沸腾算起),冷却后加入4 mL 0.2%蒽酮-硫酸溶液,摇匀后沸水浴中加热10 min,冷却后于630 nm处测吸光值。
1.2.3 海藻糖相关酶活性的测定TPS和TPP酶活性测定参照Shinjinee等[18]的方法稍作改动。酶提取系统的配制:取0.2 g样品,加2 mL提取液(20 mmol/L Tris-HCl,pH8.0,内含1 mmol/L EDTA,1 mmol/L苯甲眯盐酸盐,1 mmol/L苯甲基磺酰氟,15 mmol/L 2-巯基乙醇,10%(W/V)丙三醇,0.1%(W/V)Tween40),冰浴研磨后,12 000 r/min离心10 min,上清液为酶提取液,-4℃保存。
1.2.3.1 TPS酶活性测定TPS酶活性测定参照Shinjinee等[18]的方法稍作改动。以尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)和葡萄糖-6-磷酸(Glucose-6-phosphate,G-6-P)为底物,加入400 μL酶反应液(50 mmol/L Tris-HCl,pH8.5,含10 mmol/L MnCl2,1 μg肝素盐)、适量酶提取液和100 mmol/L HCl,沸水浴10 min,冷却后加入150 mmol/L NaOH,沸水浴10 min,然后用蒽酮比色法测定波长630 nm下的吸光度,用加热灭活的酶液作空白对照。计算时以每分钟催化生成的海藻糖-6-磷酸的微摩尔数为一个酶活单位。
1.2.3.2 TPP酶活性测定TPP酶活性测定参照Shinjinee等[18]的方法稍作改动。以海藻糖-6-磷酸(Trehalose-6-phosphate,T-6-P)为底物,加入400 μL酶反应液(50 mmol/L Tris-HCl,pH7.5,含2 mmol/L MnCl2,0.15 mmol/L T-6-P)和适量酶提取液,37℃水浴15 min后,加入4倍体积的Master Mix(6 mL H2SO4加到30 mL水中,冷却后加入0.044 g孔雀石绿,得到橙色溶液;取该溶液10 mL,加入2.5 mL 7.5%钼酸铵和200 μL 100% Tween20,即为Master Mix),混匀后37℃水浴5 min,测定630 nm处的OD值。以每分钟催化生成的磷酸盐的微摩尔数为一个酶活单位。
1.2.3.3 THase酶活性测定THase酶活性测定参照钟国华[19]的方法稍作改动。但其酶提取系统的提取液与上面两种不一致,采用pH为5.8的0.02 mol/L PBS,其余步骤一样。得到酶液后,取0.25 mL,加入0.25 mL提取液和2 mmol/L海藻糖标准液0.5 mL,摇匀后在37℃水浴中温浴30 min。然后加入3,5-二硝基水杨酸试剂2 mL,混匀,沸水浴加热5 min,冷却后测550 nm处的OD值。烟草海藻糖酶的活力单位定义为:生成1 mmol葡萄糖的量为一个酶活力单位。.
1.2.4 基因表达测定以半定量RT-PCR技术分析海藻糖代谢关键酶基因(TPS、TPP、THase)在干旱和低温胁迫过程中的表达水平。采用Trizol法提取样品的总RNA,逆转录反应以总RNA(5 μg)为模板,使用随机引物,采用一步法合成cDNA(M-MLV Reverse Transcriptase,Promega,USA)。目的基因序列来自本实验室前期借助Illumina Hiseq2000高通量测序平台获得的转录组信息[20],目的基因序列如表 1所示。半定量RT-PCR选用烟草18S rRNA作为内参基因。最后用Image J软件对PCR结果进行灰度分析,根据扩增产物的亮度判断目的基因的表达水平变化。
每组实验重复3次,每次实验2个测定重复。实验原始数据用SPSS11.5统计软件分析和Duncan多重比较。统计结果用Sigmaplot10.0作图。
2 结果 2.1 烟草幼苗在干旱和低温胁迫下叶片海藻糖含量的变化烟草幼苗在干旱和低温胁迫早期,体内会迅速积累海藻糖。如图 1所示,干旱胁迫下海藻糖含量呈现先升高后降低的趋势,在处理2 d时含量达到最大值,是处理前0 d对照海藻糖含量的1.4倍;低温胁迫下也表现出先升高再降低的趋势,在2 d时达到最大值,比处理前0 d对照高了90.8%。两个胁迫下海藻糖含量变化的总体趋势都是先升高后降低,但是干旱胁迫下海藻糖的积累量远高于低温胁迫,在0.5、1、2、4和6 d分别比低温胁迫下的海藻糖含量高96.6%、76.9%、25.6%、78.2%和105.6%,表现出极显著差异,说明海藻糖对干旱响应更敏感。
 |
| ** 和* 分别表示差异极显著(P<0.01)和差异显著(P<0.05),下同 图 1 干旱和低温胁迫下烟草叶片中海藻糖含量的变化 |
海藻糖-6-磷酸合成酶(TPS)和海藻糖-6-磷酸磷酸酶(TPP)是合成海藻糖的关键酶,TPS能首先催化UDPG和G-6-P形成中间产物6-磷酸海藻糖,TPP能将6-磷酸海藻糖脱磷酸,最终形成海藻糖。干旱和低温胁迫下TPS、TPP活性变化(图 2)显示,TPS活性在干旱和低温下均先升高后降低,干旱胁迫下的TPS活性在1 d时达到最大,比处理前0 d升高72.5%;低温胁迫下TPS活性在2 d时达到最大,比处理前0 d高21.2%。从两个胁迫的比较来看,干旱胁迫下TPS活性在1 d和2 d分别比低温下的活性高52.3%和35.5%,表现出极显著差异;低温胁迫下TPS活性在0.5 d时极显著高于干旱胁迫下的活性,比干旱高21.6%,4 d和6 d时也高于干旱胁迫,但差异不显著(图 2-A)。
 |
| 图 2 干旱和低温胁迫下烟草叶片中 TPS 活性(A)和 TPP 活性(B)的变化 |
TPP活性在干旱和低温胁迫下也表现出先升高后降低的趋势,干旱胁迫下TPP活性在1 d时达到最大,比0 d对照高94.1%,此后降低;低温胁迫下TPP活性在0.5 d时达到最大,比0 d对照高30.2%,此后也不断降低。从两个胁迫下TPP活性比较来看,干旱胁迫下TPP活性在1、2和4 d时均高于低温胁迫下的活性,分别高了97.1%、70.0%和26.2%,表现出极显著差异;低温胁迫仅在0.5 d时高于干旱胁迫,比干旱高19.3%(图 2-B)。
海藻糖酶(Thase)是以海藻糖为专一底物来分解海藻糖的关键酶,最终将海藻糖水解为葡萄糖。Thase活性变化趋势(图 3)显示,在干旱和低温胁迫下Thase活性均不断升高,6 d时达到最大,此时干旱和低温下的Thase活性分别是处理前0 d活性的4.5倍和7.1倍。干旱胁迫下的Thase活性均低于低温胁迫下的活性,在0.5、1、2、4和6 d分别比低温胁迫低51.8%、41.2%、35.8%、44.0%和31.8%,均表现出极显著的差异。
 |
| 图 3 干旱和低温胁迫下烟草叶片中海藻糖酶活性的变化 |
从海藻糖含量与相关酶活性变化来看,海藻糖含量与合成海藻糖的TPS、TPP活性呈一定正相关关系,尤其是在干旱胁迫下,TPS、TPP活性在1 d和2 d时较高,海藻糖含量也较高;与分解海藻糖的海藻糖酶呈负相关关系。低温胁迫下合成海藻糖的TPS、TPP活性较低,而海藻糖酶的活性不断升高,最终使低温下海藻糖积累量较低。
2.3 基因表达的变化干旱和低温胁迫下TPS、TPP、THase表达情况如图 4和图 5所示。TPS在干旱胁迫0.5 d时表达量下降,此后上调,在4 d时达到最大,为处理前0 d的2.2倍,之后下降;处理后低温下的表达量均低于0 d的表达量。干旱胁迫下TPS的表达量均高于低温下的表达量,除0.5 d外,均表现出极显著差异,且在0.5 d和1 d分别比低温胁迫下的表达量高10.5%和93.4%,2、4和6 d的表达量分别是低温的1.0倍、2.3倍和2.7倍(图 4和图 5-A)。
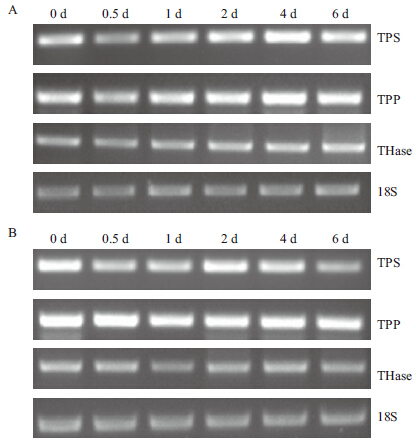 |
| 图 4 干旱(A)和低温(B)胁迫下烟草叶片中TPS、TPP、THase 基因PCR 扩增产物电泳图 |
 |
| 0 d的基因相对表达量设定为100% 图 5 干旱和低温胁迫下烟草叶片中TPS(A)、TPP(B)和THase(C)基因表达情况 |
TPP基因在干旱胁迫下与TPS表现出类似的规律,在0.5 d表达下降,此后上调,到4 d时达到最大,是处理前0 d的1.9倍,之后下降;低温胁迫下TPP表达量在0.5 d时略微升高,之后降低,且都低于0 d的表达量。干旱胁迫下TPP表达量在0.5 d时低于低温胁迫31.0%,之后均高于低温胁迫下的表达量,且都表现出极显著差异,在1 d和2 d分别比低温高73.0%和81.8%,在4 d和6 d时分别是低温的1.3倍和1.2倍(图 4和图 5-B)。
Thase基因在干旱胁迫0.5 d表达下调,此后一直处于上调状态,6 d时达到最大,是处理前0 d的2.0倍。低温胁迫下,THase表达量均低于处理前0 d的表达量。在整个处理期,干旱胁迫下Thase表达量均高于低温胁迫的表达量,0.5 d时比低温高24.8%,表现出显著差异,在1、2、4和6 d表达量分别是低温的2.6倍、1.1倍、1.3倍和2.9倍,表现出极显著差异(图 4和图 5-C)。
从整体来看,干旱胁迫诱导TPS、TPP和Thase基因表达,TPS、TPP活性在1-2 d显著升高,Thase活性不断升高,最终使海藻糖含量呈现先升高后降低趋势,在干旱胁迫2 d时含量达到最大;低温胁迫下TPS、TPP和Thase基因的表达量降低,TPS、TPP活性变化也不大,但Thase活性不断升高,说明低温更利于海藻糖的分解,最终检测到海藻糖的积累量显著低于干旱胁迫下的积累量(图 4和图 5)。
3 讨论海藻糖作为保护性物质,既是一种贮藏性糖类,又是一种典型的应激代谢产物,当生物体生长环境良好时,体内不积累海藻糖;而当生物体处于胁迫环境时,体内就会迅速积累海藻糖,而且这些海藻糖会随着不良环境的解除而被降解[21, 22]。例如,当卷柏处于干旱条件下时,体内会积累大量的海藻糖,含量可达干重的12%[1]。但目前国内外尚未见到同一物种体内的海藻糖对不同逆境胁迫的响应差异及其比较。本研究以烟草幼苗为材料,发现在干旱和低温胁迫早期(2 d),烟草幼苗体内海藻糖大量积累(图 1),这可能是烟草幼苗对干旱和低温的适应性响应;而干旱比低温能诱发更高的海藻糖的积累量,暗示着干旱能更有效地激活烟草幼苗的海藻糖合成途径。
本研究的结果显示,在干旱和低温胁迫下,海藻糖含量、相关酶活性及基因表达都有一定程度的变化。干旱条件下TPS、TPP活性与海藻糖含量呈正相关关系,这与前人的研究结果一致,如Van等[23]将拟南芥和卷柏TPS酶N端的部分氨基酸去除后,转化酿酒酵母,发现TPS活性增加了10-40倍,海藻糖的含量也增加了20-40倍。Garg等[24]将大肠杆菌中的TPS和TPP基因融合在一起形成TPSP,转入籼稻中,海藻糖含量达到非转基因籼稻的3-10倍。在这个基础上,可以推断在干旱胁迫环境中,烟草可能通过激活相关基因的表达来提高这些酶的活性,使海藻糖含量升高,最终提高烟草抗胁迫能力。
低温胁迫下,海藻糖代谢相关基因TPS、TPP和THase表达下降,对应的酶活性TPS、TPP变化不显著,THase不断升高,海藻糖含量却有所积累。相关基因表达下降的原因可能是低温刺激下细胞代谢发生紊乱,使细胞受到不可逆的伤害[25]。本研究中低温下基因表达与酶活性变化不一致,原因可能有两点:一是由于植物对低温胁迫响应是一个复杂的生理生化过程,包括多个基因的共同调控[26],TPS和TPP是多基因家族,低温下并不是所有的基因都同时高表达或低表达[27, 28],本研究中TPS、TPP、THase表达量不仅没有升高,反而降低,是否是因为所选的基因仅为众多调控基因之一,这几个基因刚好在干旱下高表达而在低温下低表达;二是低温下这3个酶活性除了受到转录调控外,还受到转录后调控,具体原因还需进一步验证。另外,结果显示低温下相关酶活性变化不大而海藻糖含量却有所升高,此时的海藻糖是否可能由其他糖转化而来,也需要进一步研究。
总体来看,海藻糖对干旱和低温胁迫的响应不同,干旱胁迫下合成海藻糖的TPS、TPP活性较高,而低温胁迫下较低,因此干旱环境下烟草体内会积累更多的海藻糖。由于烟草在非生物逆境胁迫下,烟草体内的海藻糖含量变化与海藻糖酶活性的变化呈现一种此消彼长的关系[29],低温胁迫下海藻糖酶活性高于干旱胁迫下的海藻糖酶活性,所以低温下海藻糖含量低于干旱。
综上所述,干旱胁迫通过诱导海藻糖相关基因的高表达,使相关酶活性升高,最终促使烟草体内海藻糖含量升高来增强烟草抗胁迫能力,提高抗旱性;低温胁迫下海藻糖相关基因表达降低,除海藻糖酶活性升高外,合成海藻糖的相关酶活性变化较小,最终低温胁迫下海藻糖的积累量远低于干旱胁迫下的积累量。
4 结论在干旱和低温胁迫下,烟草品种云烟203幼苗体内有大量海藻糖积累,以增强抗旱抗冷能力。烟草幼苗体内海藻糖对干旱和低温环境的响应不同,与低温胁迫相比,干旱胁迫下海藻糖代谢相关基因表达量较高、合成海藻糖的TPS、TPP活性较高而分解海藻糖的THase活性较低,最终导致海藻糖含量也较高。因此,与低温胁迫相比,海藻糖对干旱胁迫的响应敏感性更高。
| [1] | Goddijn OJM, Dun KV. Trehalose metabolism in plants[J]. Trends in Plant Science, 1999, 4(8):315-319. |
| [2] | Drennan PM, Smith MT, Goldsworth D, et al. The occurance of trehalose in the leaves of the desiccation-tolerant angiosperm myrothamnus flabellifolius welw[J]. Journal of Plant Physiology, 1993, 142(2):493-496. |
| [3] | Thevelein JM. Regulation of trehalose metabolism and its relevance to cell growth and function // In:Bramb R, Marzluf GA. The Mycota[M]. Berlin:Springer-Verlag, 1996:395-420. |
| [4] | 宋晓丽, 石东升, 温佳文, 等. 海藻糖的生物合成途径及其生物学功能[J]. 食品与发酵工业, 2013, 39(8):167-171. |
| [5] | 李美如, 刘鸿先, 王以柔, 等. 钙对水稻幼苗抗冷性的影响[J]. 植物生理学报, 1996, 22(4):379-384. |
| [6] | 王鹏翔, 艾复清, 钟蕾, 等. 成熟期干旱胁迫对烤烟叶绿素含量及相关酶活性的影响[J]. 安徽农业科学, 2007, 35(31):9945-9946. |
| [7] | 刘蕾, 杜海, 唐晓凤, 等. MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J]. 遗传, 2008, 30(10):1265-1271. |
| [8] | Wingler A. The function of trehalose biosynthesis in plants[J]. Phytochemistry, 2002, 60(5):437-440. |
| [9] | 连俊方, 闫道良, 郭坤, 等. 海藻糖对NaCl胁迫下多年生黑麦草苗期生长和离子平衡的影响[J]. 安徽林业科技, 2012, 38(4):9-12. |
| [10] | 杨平, 李敏惠, 潘克俭, 等. 海藻糖的生物合成与分解途经及其生物学功能[J]. 生命的化学, 2006, 26(3):233-235. |
| [11] | Hottiger T, Virgilio CD, Hall MN, et al. The role of trehalose synthesis for the acquisition of thermotolerance in yeast. Ⅱ. Physio-logical concentrations of trehalose increase the thermal stability of proteins in vitro[J]. Europe Journal of Biochemistry, 1994, 219(1-2):187-93. |
| [12] | 戴秀玉, 王忆琴, 杨波, 等. 大肠杆菌海藻糖合成酶基因对提高烟草抗逆性能的研究[J]. 微生物学报, 2001, 41:427-431. |
| [13] | Kosmas SA, Argyrokastritis A, Loukas MG, et al. Isolation and characterization of drought-related trehalose 6-phosphate-synthase gene from cultivated cotton(Gossypium hirsutum L. )[J]. Planta, 2006, 223(2):329-339. |
| [14] | Tarek EB, Haluk H, Huseyin AO, et al. Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions[J]. Plant Science, 2005, 169:47-54. |
| [15] | 王莎莎, 盛业龙, 马文广, 等. 抗氧化系统参与不同抗性烟草品种幼苗对干旱和低温综合抗性的形成[J]. 生物技术通报, 2014(1):132-141. |
| [16] | 盛业龙, 马文广, 段胜智, 等. 20个烟草品种抗旱性的比较筛选与综合评价[J]. 安徽农业科学, 2013, 41(11):4766-4769. |
| [17] | 宋维民, 周海燕, 贾荣亮, 等.土壤逐渐干旱对4种荒漠植物光合作用和海藻糖含量的影响[J].中国沙漠, 2008, 28(3):449-454. |
| [18] | Shinjinee S, Sagar L, Shakri B, et al. Methylation dependent enhancement of trehalose production in Candida utilis[J]. Carbohydrate Research, 2012:175-181.. |
| [19] | 钟国华, 胡美英, 林进添, 等. 闹羊花素-Ⅲ对菜青虫海藻糖含量及海藻糖酶活性的影响[J]. 华中农业大学学报, 2000, 19(2):119-123. |
| [20] | Hao DH, Ma WG, Sheng YL, et al. Comparison of transcriptomes of chilling- and drought-tolerant and intolerant Nicotiana tabacum varieties and identification of genes associated with stress tolerance[J]. Plant Omics Journal, 2014, 7(6):527-539. |
| [21] | Laere AV. Trehalose, reserve and/or stress metabolite?[M]. FEMS Microbiology Letters, 1989, 63(1):201-209. |
| [22] | Wiemken A. Trehalose in yeast, stress protectant rather than reserve carbohydrate[J]. A ntonie Van Leeuwenhoek, 1992, 58(3):209-217. |
| [23] | Van Dijck P, Mascorro-Gallardo JO, Bus MD, et al. Truncation of Arabidopsis thaliana and Selaginella lepidophylla trehalose-6-phosphate synthase unlocks high catalytic activity and supports high trehalose levels on expression in yeast[J]. Biochem J, 2002, 366:63-71. |
| [24] | Garg AK, Kirn JK, Owens TG, et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J]. Proe Natl Acad Sci USA, 2002, 99:15898-15903. |
| [25] | 李亚鹏, 陈明杰, 赵妍, 等. 低温胁迫下草菇海藻糖磷酸化酶基因表达变化研究[J]. 生物学杂 志, 2014, 31(5):14-18. |
| [26] | 张丹, 付莉莉, 彭明, 等. 实时荧光定量PCR检测木薯海藻糖合成酶基因(MeTPS1-3)干旱胁迫下的表达[J]. 热带作物学报, 2013, 34(7):1274-1277. |
| [27] | Yang HL, Liu YJ, Wang CL, et al. Molecular evolution of trehalose-6-phosphate synthase(TPS)gene family in Populus, Arabidopsis and rice[J]. PLoS One, 2012, 7(8):1-10. |
| [28] | Lunn JE. Gene families and evolution of trehalose metabolism in plants[J]. Functional Plant Biology, 2007, 34:550-563. |
| [29] | 杨军, 易克, 周文辉, 等. 低温胁迫下烟草海藻糖与海藻糖酶的动态关系研究[J]. 湖南文理学院学报:自然科学版, 2010, 3(1):31-34. |





