生物制药是将生物工程技术应用到药物制造领域的过程。它依据微生物学、生物学、医学、生物化学等研究成果,综合利用微生物学、生物化学、生物技术及药学等科学原理和方法在生物体、生物组织、细胞或者体液中制造用于诊断、预防和治疗的药物。近30年来,全球生物制药科技突飞猛进,开发出了一大批新的生物特效药,在很大程度上解决了过去用常规方法不能生产或者生产成本特别昂贵的药物生产问题[1]。2011年全球生物制药的销售额已达1 600亿美元,占药品市场份额的19%,预计到2020年,生物制药在全球药品销售中的比重将超过1/3[2]。
与传统医药产品相比,生物制药对环境污染小,对资源依赖程度低,对疾病具有更好的靶向性且毒副作用小,尤其是在预防和治疗病毒性感染疾病(如乙肝、HIV等)、肿瘤、代谢综合病及遗传性疾病等方面具有独特的优势[1]。目前许多国家都把生物产业作为21世纪优先发展的战略性产业,加大了对生物制药产业的政策扶持与资金投入。据国务院《生物产业发展规划》预测,在2013-2015年期间,生物医药产业产值年均增速达到20%以上,到2015年,我国生物医药市场有望达到1 000亿美元的规模,医药生物技术产业的产值将达到2 000亿元。未来10年随着生物药研发与产业化能力的大幅度提高,将形成化学药、中药、生物药三足鼎立的药物新格局[3, 4]。
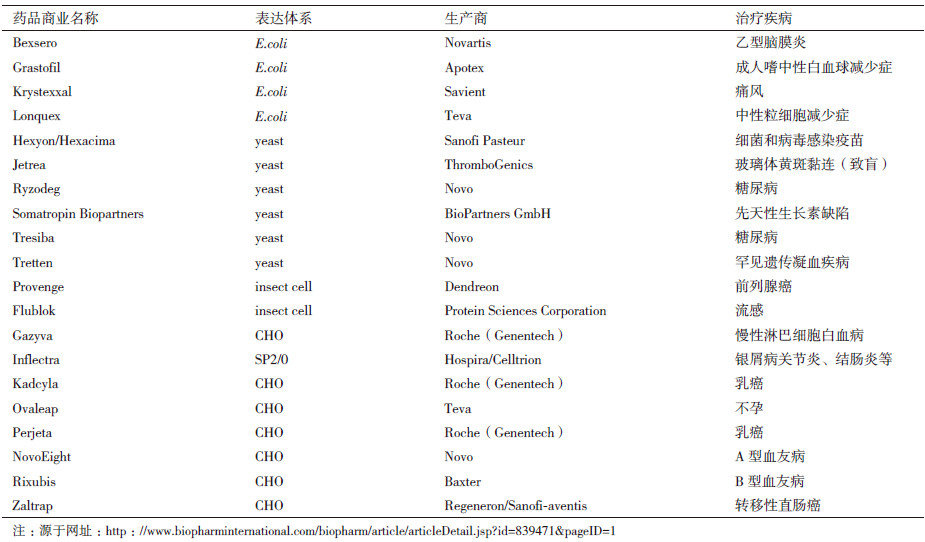
1 生物制药的生产平台目前市场上的生物药主要是具有疾病的诊断、预防和治疗作用的蛋白类药物,如抗生物素蛋白、病毒疫苗、抗体、细胞因子及酶类等。所使用的生物表达平台有细菌、酵母、昆虫细胞、哺乳动物细胞和植物等表达系统。
细菌表达系统在技术上最为成熟,也是目前应用最广的外源基因表达体系,具有培养简单、繁殖迅速、遗传稳定等特点。但不足是作为原核生物,细菌结构简单,缺乏对真核生物蛋白的加工修饰体系,因此细菌表达系统限于表达一些多肽或结构简单的蛋白。例如,预防乙型脑膜炎的脑膜炎球菌疫苗Bexsero;细胞刺激因子Grastofil、Lonquex及尿酸酶Krystexxal等(表 1)。
由于原核生物满足不了真核生物蛋白翻译后加工的需求,人们转向了对真核生物表达体系的研究。其中对酵母表达系统和昆虫细胞表达系统的研究取得了突破性进展并已应用于生物制药领域。表 1列出了2013年利用酵母和昆虫细胞表达系统生产的生物药。但在实际应用时发现这两种表达体系也存在一些问题:酵母在表达外源基因时会出现产物蛋白的不均一、信号肽加工不完全、易降解、易形成多聚体且蛋白分泌率低等情况;而昆虫表达体系由于通过杆状病毒感染宿主细胞表达外源蛋白,容易出现重组杆状病毒筛选难等问题。另外,进化上的差异使这两个表达体系在蛋白糖基化修饰方面存在不足,即仅可形成高甘露糖型寡糖链,很难形成哺乳动物糖蛋白上所特有的半乳糖和唾液酸寡糖链结构,限制了它们在要求表达高度人源化的治疗性抗体药物和糖蛋白方面的应用。
表达药物蛋白最为理想的是使用哺乳动物细胞。其表达的外源蛋白高度人源化,尤其是化学本质为糖蛋白的治疗性单克隆抗体和酶类药物(表 1)。常用的中国仓鼠卵巢细胞(CHO)已被应用于数百种药用蛋白的生产[1, 5]。目前限制哺乳动物细胞表达体系大规模生产应用的因素是培养条件不易掌握,培养基组成复杂且昂贵,同时易受污染或携带人类病原物,建立大规模表达体系耗时长且前期要求巨额投入。
随着基因工程的发展和转基因技术的提高,利用植物也可以成功表达药用蛋白[6, 7]。植物不携带对人类有害的病原微生物,不产生内毒素且种植技术简单,商业化成本低廉,所以非常有利于规模化生产。植物作为药用蛋白表达体系展现出的魅力已经吸引了许多国家及公司的目光,越来越多的产品开始进入临床试验阶段甚至进入市场。
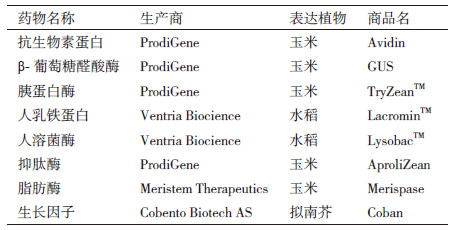
2 植物生物反应器的应用现状最先被国际机构组织如欧洲药品管理局(European Medicines Agency,EMA)、美国食品药品管理局(U.S Food and drug administration,FDA)、世界卫生组织(World health organization,WHO)批准市场化的利用植物生物反应器生产的生物药产品主要是一些诊断和保健性产品(表 2)。目前市场上利用植物表达的蛋白产品有美国星球生物科技公司(Planet biotechnology,USA)研发的治疗龋齿的抗体CaroRX[8];2006年2月获得美国农业部批准(United States Department of Agriculture,USDA)上市的美国陶氏益农公司(Dow AgroSciences,USA)研发的兽用抗新城疫病毒转基因植物疫苗[9];以色列Protalix公司通过胡萝卜细胞悬浮培养技术生产出的治疗I型戈谢病(Gaucher disease,旧称高雪氏病)的葡萄糖苷脂酶。该产品已于2012年5月获得美国FDA批准,也是第一个通过植物生产,可以注射使用的药物[10]。
我国利用植物表达生物药的研究也取得了长足的进展。武汉大学的研究人员在水稻种子中表达出了高丰度的人血清白蛋白(Human serum albumin,HSA)。这些在水稻种子中产生的重组HSA在物理和生化特性上与血浆来源的HSA相同,并且与其具有相近的致免疫性。研究结果为利用植物大规模生产安全、有效的HSA提供了可行、经济的途径[11]。
3 植物生物反应器在应用中存在的主要问题目前限制植物生物反应器大规模应用的因素有很多,最主要的是外源药用蛋白在植物细胞内的表达量普遍偏低[12]。表达量低增加了下游加工的难度及生产的经济成本。同时,表达量低也容易导致免疫耐受性,限制了植物源疫苗的口服使用[13]。因此,提高植物体外源蛋白的表达量是目前亟待解决的关键问题。除此之外,植物与动物细胞内糖蛋白的糖链结构也不尽相同,结果会导致人体对某些植物源蛋白产生过敏反应,引起了人们对植物源药用蛋白安全性的担忧[14]。因此,如何在植物中表达高度人源化的含有半乳糖基和唾液酸基团结构的糖蛋白是其作为生物反应器需要解决的另一难题。
4 提高植物源蛋白表达量的一些措施目前,利用植物表达外源药用蛋白的表达体系主要有核转化系统、叶绿体转化系统和瞬时表达系统。本研究针对这三个体系中现存的问题,总结了在提高植物生物反应器表达效率方面采取的措施。
4.1 核转化系统核转化是最早的植物转化技术,通过转化将目的基因随机插入到植物染色体的核基因组中,后经抗性筛选获得表达外源蛋白的植株。由于外源基因整合到核基因组上,使其在植物体内能够稳定表达。运用核转化系统的不足是外源蛋白在植物中表达水平偏低,即便使用组成型启动子烟草花叶病毒35S启动子,每千克新鲜组织中表达量也仅有几或几十毫克[12]。针对这一问题,研究者们采取了多种措施进行改善。首先是启动子的选择。研究发现,同一启动子在不同植物表达体系中表达效率不同:烟草花叶病毒35S启动子较适用于双子叶植物,而玉米泛素蛋白启动子则较适用于单子叶植物[7];空间上为了让外源蛋白集中表达于某个器官,可以采用组织特异性启动子,包括种子特异性启动子、马铃薯块茎启动子和番茄果实启动子等;另外,为避免外源蛋白的表达对植物个体生长发育造成影响,可以采用诱导型启动子,在需要时通过诱导物刺激表达;再者就是人造启动子的使用:通过把一些能够促进真核基因表达的顺式作用元件与启动子结合或者使用双启动子强化启动子的功能[15]。除了改变表达基因的驱动启动子外,也可给目的基因进行序列修饰,如在两端加上5'UTR和3'UTR非编码区,可以提高转录mRNA的稳定性和翻译的效率[16];而通过给外源蛋白基因带上信号肽序列(如内质网滞留信号肽KDEL),可以使蛋白的表达累积在某个细胞器内,以提高外源蛋白的表达量[7]。
利用核转化技术,外源蛋白在植物的各个组织表达量存在着明显差异,一般以种子作为表达器官最为理想。De Jaeger等[16]通过加入内质网滞留信号和菜豆种子贮藏蛋白基因arc5-I的5'和3'UTR部分序列,在菜豆球蛋白基因(β-phaseolin)启动子驱动下,抗体单链scFv G4基因成功表达。经筛选纯合子后发现,拟南芥种子中scFv G4的表达量较高,达到36.5% TSP(总可溶性蛋白),而对照组由烟草花叶病毒35S启动子驱动表达的scFv G4表达量仅为1% TSP。Hennegan等[17]为提高人溶菌酶在水稻谷粒中的表达量,将小麦中控制籽粒硬度的主效基因启动子、水稻谷蛋白基因的启动子以及内质网滞留信号序列组合形成辅助目的基因表达的盒子,最后人溶菌酶在转基因水稻谷粒中表达量达到了9 g/kg干重,相当于80% TSP,创下了在种子中表达外源蛋白的最高记录。
综上,利用核转化技术的特点是外源基因可以在植物体中稳定遗传,但表达量偏低。虽然可以将外源基因表达产物限定在特定细胞器中(如内质网)累积高表达,但存在的问题是积累在内质网中的蛋白不能进入高尔基体进行深度的加工修饰,以至于此表达系统仅限于表达只需简单加工的蛋白。而且,为了获得能够稳定遗传的纯合子需要多代筛选,比较费时费力。同时,在后代筛选的过程中,转基因植物的花粉可能会给环境带来基因污染,其种植环境和管理要求严格。
4.2 叶绿体转化系统叶绿体转化系统是将外源基因经同源重组的方式定点整合到叶绿体基因组中。由于1 个植物细胞的叶绿体基因组拷贝数可高达10 000,从而决定了其潜在的较高表达量[18]。
Tregoning等[19]将细菌的破伤风毒素的C片段(无毒)基因整合到烟草叶绿体基因中,得到的蛋白表达量为10%-25% TSP。动物实验表明,这种烟草表达的破伤风疫苗在小鼠体内能有效引起机体对破伤风毒素的免疫。2010年,Davoodi-Semiromi等[20]把霍乱毒素的B亚基分别与疟疾两个表面蛋白的基因融合形成双功能性疫苗并成功在烟草和生菜的叶绿体中表达,表达量分别是10.11%和13.17%、6.1%和7.3% TSP,给小鼠口服或者皮下注射此类疫苗,均可引起免疫反应。
相比于核转化,叶绿体转化系统表达量较高,也可稳定遗传。但叶绿体转化技术存在的问题是定点插入了外源基因的叶绿体基因组只占较少的一部分,易形成叶绿体转化的异质体。异质体在遗传上不稳定,必须去除野生型的叶绿体基因组拷贝得到同质体才能够稳定遗传。另外,叶绿体基因表达所用的核糖体体系类似于原核生物,意味着叶绿体中所表达的蛋白也不能进行翻译后加工修饰,不能形成复杂空间结构。因此,此系统也仅适于表达结构简单的蛋白如抗菌、抗病毒的亚基疫苗和生长素等。
4.3 瞬时转化系统瞬时表达技术主要是利用植物病毒作为载体,将目的基因带入植物细胞并随着病毒基因复制和扩散增殖进行快速表达的一项技术。该技术的优势是在提高表达速度和表达量的同时大大降低实验研究的时间和经济成本。
在瞬时表达体系中经常使用的病毒载体包括烟草花叶病毒(Tobacco mosaic virus,TMV)、马铃薯病毒X(Potato virus X,PVX)、苜蓿花叶病毒(Alfalfa mosaic virus,AMV)等。第一代技术中以病毒的完整基因组作为载体,将目的基因插入到病毒基因组某个开放阅读框启动子后面形成表达载体,通过接种到植物体上使目的基因在植物细胞中表达。α-半乳糖苷酶[21]、α-淀粉酶[22]以及抗HIV的高氏红藻蛋白(Griffithsin,GRFT)[23]等都用此法在植物中获得了成功表达。高氏红藻蛋白是一种抗逆转录病毒的蛋白,它能与HIV表面囊膜上的糖蛋白结合,抑制HIV在细胞间的传播。在TMV壳蛋白亚基因组启动子驱动下,高氏红藻蛋白的表达量可达到1 g/kg鲜重。免疫学实验结果表明,植物和大肠杆菌中表达的GRFT与天然的藻红蛋白有类似的生物学活性。但植物中表达的GRFT蛋白中混有TMV的衣壳蛋白,在纯化过程中需要将其去除。
瞬时转化的第二代技术在不影响基因表达功能的前提下缩减了载体中病毒基因长度,从而可载入较长的待表达的目的基因。在这方面德国拜耳子公司IconGenetics已注册了magnICON®技术品牌。目前该公司正在应用这项技术表达一种抗非霍奇金淋巴瘤的疫苗,并且于2010年1月进入临床试验阶段。为提高表达量,他们同时使用TMV和PVX两种病毒载体转化烟草,仅用两周时间就获得5 g/kg鲜重的高表达量。而血清免疫学的结果也显示,此疫苗与杂交瘤细胞表达的疫苗有类似的生物学活性[24]。
由于该项技术可让植物在短时间内表达出大量的药用蛋白,相信其在未来植物源口服疫苗的生产上会得到广泛应用。目前此技术主要以烟草为表达平台,但烟草中固有的生物碱尼古丁引起了人们的担忧。因此如何将该技术广泛应用到其他植物上,如何实现规模化生产、降低流通运输和储存难度等都将是需要解决的问题。
5 植物蛋白糖基化及改进措施在开发的药物蛋白中,糖蛋白约为2/3,且在生物药领域中主要的治疗性单抗和酶基本都是糖蛋白。故高效表达高度人源化的药用糖蛋白是推广植物生物反应器在生物制药中必须解决的重要问题。
5.1 植物与动物蛋白糖基化的差异蛋白的糖基化修饰主要包括N-连接糖基化,即寡糖链连接在蛋白的天冬酰胺残基上,发生在内质网和高尔基体中;O-连接糖基化,即寡糖链连接在蛋白的丝氨酸/苏氨酸或羟脯氨酸/羟赖氨酸残基上,发生在高尔基体中[25]。
高等生物细胞中的N-连接糖基化修饰过程在内质网中高度保守,只是在蛋白折叠离开内质网到达高尔基体进行寡糖链后加工和修饰时存在差异。经比较发现,植物细胞中寡糖链的五糖核心结构具有特异的α1,3-岩藻糖基团和一个β1,2-木糖基团;而动物细胞中的五糖核心主干基部携带一个α1,6-岩藻糖基团和无木糖基团,并且在寡糖链末端连有β1,4-半乳糖基团和唾液酸基团,而在植物中却缺少这样的糖基结构[26](图 3)。
 |
| 图 3 植物细胞(左)和动物细胞中(右)的N-糖链结构 |
在研究人体对某些植物过敏反应时发现,植物糖蛋白上特有的α1,3-岩藻糖基团和β1,2-木糖基团在过敏反应中与免疫球蛋白E特异性结合[27]。在受试者中,50%的人血清中存在抗α1,3-岩藻糖和β1,2-木糖的抗体。这些抗体会很快清除注射入人体内的植物来源的药物蛋白,从而大大降低药性。在免疫实验中,将化学合成的携带植物特异性糖基团的蛋白或植物中表达的抗体2G12(抗HIV的免疫球蛋白)注射入兔子体内,都会引起强烈的过敏反应[28]。因此,从药物安全角度出发,在利用植物生物反应器表达药物蛋白时必须解决植物特有糖基团可能引起免疫原反应的问题。
另外,动物寡糖链末端的唾液酸基团是糖蛋白的帽子结构,它在血液循环中维持着糖蛋白的稳定性,决定了糖蛋白的血液半衰期[25]。研究发现,帽子结构的增多可以延长糖蛋白的血液半衰期。例如,重组人促红细胞生成素rhEPO常被用于治疗由慢性肾衰竭、化疗和艾滋病引起的贫血,与天然EPO一样携带3个唾液酸基团。然而经修饰含有5个唾液酸基团的rhEPO相比于正常的rhEPO,其血液半衰期延长了约3倍[25]。因此,为了延长植物源药物蛋白的血液半衰期以提高药效,最好使植物细胞表达的糖蛋白寡糖链末端也能连上N-乙酰神经氨酸,即唾液酸化。
为了消除植物细胞中特有的糖链结构可能诱导人体产生的过敏性反应,可以通过下调植物中相关糖转移酶的表达或者直接沉默该基因两个措施来解决。例如,可以利用RNA干扰技术沉默α1,3-岩藻糖转移酶和β1,2-木糖转移酶基因。但需要注意的是,基因沉默的效果在不同种类的植物中不同:基因沉默效果较好的是水生植物浮萍Lemna minor[29],而在苜蓿Medicago sativa[30]和烟草Nicotiana bentha-miana[31]中的岩藻糖和木糖转移酶基因往往不能被完全沉默掉,部分表达的药物蛋白中仍然能够检测到植物特有的糖基团。2010年,Castilho等[32]在缺乏α1,3-岩藻糖基转移酶和β1,2-木糖基转移酶烟草突变体中利用瞬时转化技术转入了6个与唾液酸化相关的酶基因,并成功表达出了含有唾液酸基团的抗体2G12,为解决植物源药物蛋白的致敏性和药效持久性问题提供了一条新途径。
6 展望自转基因植物技术问世以来,植物作为低成本、高产出和无污染的“生产工厂”一直备受关注,已被广泛用于蛋白药物如疫苗、激素、单克隆抗体、酶等的生产研究中[4]。此外,近年来在基因治疗中悄然兴起的核酸药物,为拓展植物反应器的应用提供了舞台。
目前,利用化学合成和动物细胞表达的核酸药物——干扰RNA,其安全性、治疗成本及靶向输送等远不能满足临床疾病治疗的需求。而最新的科学研究发现,食物中一些微小核糖核酸可在人体组织及血清中积累,并且可作为自然存在的活性信号分子跨界调控人体的基因表达及影响生理[33]。尽管这些微小核糖核酸如何能突破各种物理屏障及胃肠道内极端生理环境被运送入人体细胞的机制尚不清楚,但这些发现为人们提供了一个全新探索的可能,即可通过对植物基因组的改造使其变成核酸药物的“生产工厂”。利用植物生物反应器表达特异致病基因的干扰RNA,其在经济成本、安全性及药物运输等方面所具有的优势决定了其在未来具有更广阔的前景。我们有理由相信,随着人类对基因组研究的深入以及植物基因改造研究技术的积累,将来会有更多植物源药物进入市场,造福人类。
| [1] | Walsh G. Biopharmaceutical benchmarks 2010[J]. Nature Biotechnology, 2010, 28(9):917. |
| [2] | 于晓鸿. 中国生物制药产业发展研究[J]. 黑龙江科技信息, 2013(4):46. |
| [3] | 前瞻产业研究. 2013-2017年 中国生物制药行业产销需求与投资预测分析报告[R]. 前瞻产业研究院, 2013. |
| [4] | 韩迎. 生物技术药物的优势与前景展望[J]. 中国医院药学杂志, 2013, 33(13):1083-1085. |
| [5] | 范翠英, 冯利兴, 樊金玲, 等. 重组蛋白表达系统的研究进展[J]. 生物技术, 2012, 22(2):76-80. |
| [6] | Chen M, Liu X, Wang Z, et al. Modification of plant N-glycans processing:The future of producing therapeutic protein by transgenic plants[J]. Med Res Rev, 2005, 25(3):343-360. |
| [7] | Sharma AK, Sharma MK. Plants as bioreactors:Recent developments and emerging opportunities[J]. Biotechnology Advances, 2009, 27(6):811-832. |
| [8] | Ma JKC, Hikmat BY, Wycoff K, et al. Characterization of a recombinant plant monoclonal secretory antibody and preventive immunotherapy in humans[J]. Nature Medicine, 1998, 4(5):601-606. |
| [9] | http://www. pharmexec. com/pharmexec/The-First-Plant-Derived-Vaccine-Approved-for-Chick/ArticleStandard/Article/detail/307471. |
| [10] | http://www. popsci. com/science/article/2012-05/first-plant-derived-biologic-drug-approved-human-use-fda. |
| [11] | He Y, Ning T, Xie T, et al. Large-scale production of functional human serum albumin from transgenic rice seeds[J]. Proc Natl Acad Sci USA, 2011, 108(47):19078-19083. |
| [12] | Obembe OO, Popoola JO, Leelavathi S, et al. Advances in plant molecular farming[J]. Biotechnol Adv, 2011, 29(2):210-222. |
| [13] | Pniewski T, Kapusta J, Bociąg P, et al. Low-dose oral immunization with lyophilized tissue of herbicide-resistant lettuce expressing hepatitis B surface antigen for prototype plant-derived vaccine tablet formulation[J]. J Appl Genet, 2011, 52(2):125-136. |
| [14] | Bosch D, Schots A. Plant glycans:friend or foe in vaccine development?[J]. Expert Rev Vaccines, 2010, 9(8):835-842. |
| [15] | Kay R, Chan A, Daly M, et al. Duplication of a CaMV 35S promoter sequences creates a strong enhancer for plant genes[J]. Sciences, 1987, 236:1299-1302. |
| [16] | De Jaeger G, Scheffer S, Jacobs A, et al. Boosting heterologous protein production in transgenic dicotyledonous seeds using Phaseolus vulgaris regulatory sequences[J]. Nature Biotechnology, 2002, 20(12):1265-1268. |
| [17] | Hennegan K, Yang D, Nguyen D, et al. Improvement of human lysozyme expression in transgenic rice grain by combining wheat(Triticum aestivum)puroindoline b and rice(Oryza sativa)Gt1 promoters and signal peptides[J]. Transgenic Research, 2005, 14(5):583-592. |
| [18] | Cardi T, Lenzi P, Maliga P. Chloroplasts as expression platforms for plant-produced vaccines[J]. Expert Rev Vaccines, 2010, 9(8):893-911. |
| [19] | Tregoning JS, Nixon P, Kuroda H, et al. Expression of tetanus toxin fragment C in tobacco chloroplasts[J]. Nucleic Acids Research, 2003, 31(4):1174-1179. |
| [20] | Davoodi-Semiromi A, Schreiber M, Nalapalli S, et al. Chloroplast‐derived vaccine antigens confer dual immunity against cholera and malaria by oral or injectable delivery[J]. Plant Biotechnology Journal, 2010, 8(2):223-242. |
| [21] | Turpen TH. Tobacco mosaic virus and the virescence of biotechnology[J]. Philos Trans R Soc Lond B Biol Sci, 1999, 354(1383):665-673. |
| [22] | Kumagai MH, Donson J, della-Cioppa G, et al. Rapid, high-level expression of glycosylated rice α-amylase in transfected plants by an RNA viral vector[J]. Gene, 2000, 245(1):169-174. |
| [23] | O’Keefe BR, Vojdani F, Buffa V, et al. Scaleable manufacture of HIV-1 entry inhibitor griffithsin and validation of its safety and efficacy as a topical microbicide component[J]. Proc Natl Acad Sci USA, 2009, 106(15):6099-6104. |
| [24] | Bendandi M, Marillonnet S, Kandzia R, et al. Rapid, high-yield production in plants of individualized idiotype vaccines for non-Hodgkin’s lymphoma[J]. Annals of Oncology, 2010, 21(12):2420-2427. |
| [25] | Nagels B, Weterings K, Callewaert N, et al. Production of plant made pharmaceuticals:from plant host to functional protein[J]. Critical Reviews in Plant Sciences, 2012, 31(2):148-180. |
| [26] | Gomord V, Fitchette AC, Menu-Bouaouiche L, et al. Plant-specific glycosylation patterns in the context of therapeutic protein production[J]. Plant Biotechnol J, 2010, 8(5):564-587. |
| [27] | van Ree R, Cabanes-Macheteau M, Akkerdaas J, et al. β(1, 2)-xylose and α(1, 3)-fucose residues have a strong contribution in IgE binding to plant glycoallergens[J]. J Biol Chem, 2000, 275(15):11451-11458. |
| [28] | Jin C, Altmann F, Strasser R, et al. A plant-derived human monoclonal antibody induces an anti-carbohydrate immune response in rabbits[J]. Glycobiology, 2008, 18(3):235-241. |
| [29] | Cox KM, Sterling JD, Regan JT, et al. Glycan optimization of a human monoclonal antibody in the aquatic plant Lemna minor[J]. Nature Biotechnology, 2006, 24(12):1591-1597. |
| [30] | Sourrouille C, Marquet-Blouin E, D’Aoust MA, et al. Down‐regulated expression of plant-specific glycoepitopes in alfalfa[J]. Plant Biotechnology Journal, 2008, 6(7):702-721. |
| [31] | Strasser R, Stadlmann J, Schähs M, et al. Generation of glyco-engineered Nicotiana benthamiana for the production of monoclonal antibodies with a homogeneous human-like N-glycan structure[J]. Plant Biotechnol J, 2008, 6(4):392-402. |
| [32] | Castilho A, Strasser R, Stadlmann J, et al. In planta protein sialylation through overexpression of the respective mammalian pathway[J]. J Biol Chem, 2010, 285(21):15923-15930. |
| [33] | Zhang L, Hou D, Chen X, et al. Exogenous plant MIR168a specifi-cally targets mammalian LDLRAP1:evidence of cross-kingdom regulation by microRNA[J]. Cell Research, 2011, 22(1):107-126. |