扩展功能
文章信息
- 阎慧, 娄石磊, 苗永迪, 岂蕊, 郭子硕, 邱悦, 孙聪
- YAN Hui, LOU Shilei, MIAO Yongdi, QI Rui, GUO Zishuo, QIU Yue, SUN Cong
- 大鼠结肠原代成纤维细胞的分离、培养和鉴定
- Isolation, culture and identification of primary fibroblasts from rat colon
- 吉林大学学报(医学版), 2018, 44(04): 849-852
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 849-852
- 10.13481/j.1671-587x.20180430
-
文章历史
- 收稿日期: 2017-10-11
近年来,器官纤维化已经成为世界医学研究的重点课题之一。其中结肠纤维化是克罗恩病(Crohn’ s disease,CD)和辐射性肠炎等多种慢性肠病较严重的并发症[1]。成纤维细胞作为肠纤维化的主要效应细胞,增殖过度时分泌大量以胶原为主的细胞外基质(extracellular matrix,ECM)和细胞因子,是肠纤维化发生发展的中心环节[2-3]。随着肠纤维化研究的不断深入,成纤维细胞的功能及相应的细胞信号转导机制研究已经成为研究的重点。安彩萍等[4]发现:隔药灸可下调克罗恩病肠纤维化大鼠成纤维细胞中结缔组织生长因子(connective tissue growth factor, CTGF)和纤维连接蛋白(fibronectin, FN)的表达。惠毅等[5]发现:乌梅丸可通过抑制结肠上皮细胞的过度凋亡治疗大鼠溃疡性结肠炎,其机制与抑制Bcl-2和Bax的表达有关。目前对结肠成纤维细胞的研究较少,但肠道慢性疾病导致结肠纤维化已经被证实。本课题组拟从体外培养成纤维细胞入手,通过改进传统的组织块贴壁法,采用胰酶联合差速贴壁培养法结合组织胚胎学、形态学和免疫组织化学法探讨结肠成纤维细胞的原代培养技术,为中药有效成分干预肠纤维化疾病的体外研究提供细胞模型,为研究肠道慢性疾病的发病机制和临床治疗奠定前期实验基础。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康成年Wistar雄性大鼠(封闭群),体质量约200 g,SPF级,购自吉林省长春市亿斯实验动物技术有限责任公司,动物合格证号:SCXK(吉)2011-0004。大鼠胸主动脉平滑肌A7R5细胞,由长春中医药大学生物化学实验室提供。高糖DMED干粉(美国Gibco公司),胎牛血清(上海依科赛生物公司),胰蛋白酶(1:250)(美国GenView公司),Anti-α-SMA、Anti-S100A4、Anti-E-cadherin和Anti-Vimentin(北京博奥森生物技术有限公司),超敏型HRP免疫组织化学试剂盒(上海生物工程股份有限公司)。Nikon Eclipse TS100荧光倒置显微成像系统(日本尼康仪器有限公司),Thermo 3111型CO2细胞培养箱(美国Thermo公司),TOMY ES-315高压灭菌锅(日本TOMY KOGYO公司)。
1.2 大鼠结肠成纤维细胞培养和分离成年Wistar雄性大鼠,禁食不禁水48h,腹腔注射10%水合氯醛3.5mL·kg-1。麻醉后浸泡入75%乙醇中进行外部消毒,转至无菌操作间迅速打开腹腔截取大鼠结肠,放入含1×105U·L-1青霉素和1×105U·L-1链霉素的DMEM培养基中,反复冲洗结肠内残余粪便。纵向切开结肠,剔除肠系膜和脂肪组织,用眼科镊子仔细刮去浆膜层和肌层。移入超净工作台用PBS洗涤,用眼科剪子将黏膜层和黏膜下层组织剪碎至1mm×1mm×1mm大小,均匀铺布在细胞培养瓶中,组织间距0.5cm。小心加入2mL含10%胎牛血清、1×105U·L-1青霉素和1×105U·L-1链霉素的DMEM培养基,将培养瓶倒置放入培养箱中培养。2 h后轻轻翻转培养瓶,使组织块浸入培养基中静置培养。3d后换液,8~12d后组织块边缘有大量细胞爬出。待细胞长满瓶底,采用0.25%胰蛋白酶消化,再进行反复贴壁去除贴壁速度较慢的其他细胞,分离得到成纤维细胞[6-7]。采用荧光倒置显微镜观察细胞形态表现。
1.3 大鼠结肠成纤维细胞HE染色取对数期成纤维细胞,0.25%胰蛋白酶消化,充分吹打,使之成单细胞悬液,接种到细胞爬片上。待细胞接近长满后,吸出培养液,PBS洗涤3次,95%乙醇固定15min。取出细胞爬片PBS洗涤2次,经苏木素染色、稀盐酸酒精分色、淡氨水蓝化细胞核和伊红染色,梯度乙醇逐级脱水,二甲苯透明处理3次,固定于载玻片上显微镜下观察。
1.4 大鼠结肠成纤维细胞免疫组织化学鉴定分别取对数生长期的成纤维细胞和大鼠胸主动脉平滑肌A7R5细胞,0.25%胰蛋白酶消化,充分吹打成单细胞悬液,接种到细胞爬片上。待细胞接近长满后,吸出培养液,PBS洗涤3次,4%多聚甲醛固定20min。取出细胞爬片PBS洗涤2次,加入0.5%Triton X-100 20min,内源性过氧化物酶阻断剂室温孵育15min,封闭液室温封闭45min。分别加入Anti-α-SMA、Anti-S100A4、Anti-E-cadherin和Anti-Vimentin 4℃过夜,次日室温孵育1h,PBS洗涤3次,加入二抗37℃孵育1h,PBS洗涤3次,DAB室温显色30min。固定于载玻片上显微镜下观察波形蛋白(Vimentin)、α平滑肌肌动蛋白(α-SMA)、S100钙结合蛋白A4(S100A4)和E钙黏蛋白(E-cadherin)的表达。
2 结果 2.1 荧光倒置显微镜下大鼠结肠成纤维细胞形态表现荧光倒置显微镜下观察:结肠黏膜组织块贴壁培养8d时成纤维细胞开始从组织块边缘爬出;生长到12d时成纤维细胞增殖速度逐渐加快,细胞呈扁平多突的纺锤形或星形;生长到15~20d时细胞已经达到80%融合状态(图 1,见插页四)。

|
| A:8 d; B:12 d; C:20d. 图 1 不同时期大鼠结肠成纤维细胞形态表现(×40) Figure 1 Morphology of rat colon fibroblasts at different stages(×40) |
|
|
显微镜下观察:大鼠结肠成纤维细胞体积大且突起较多,细胞质被酸性染料伊红染成粉红色,细胞核被碱性的苏木精染成蓝紫色,且细胞核较大,呈卵圆形,着色较浅,核仁着色较深很明显(图 2,见插页四)。

|
| A-C:Different fibroblasts under microscope. 图 2 大鼠结肠成纤维细胞HE染色结果(×200) Figure 2 Results of HE staining of rat colon fibroblasts (×200) |
|
|
免疫组织化学染色结果显示:大鼠结肠成纤维细胞呈扁平多突的纺锤形或星形,细胞规则、大小一致;大鼠胸主动脉平滑肌A7R5细胞呈多角形,细胞核呈卵圆形;结肠成纤维细胞中Vimentin蛋白呈阳性表达,α-SMA、E-cadherin和S100A4蛋白呈阴性表达;大鼠胸主动脉平滑肌A7R5细胞中Vimentin、α-SMA和E-cadherin蛋白呈阳性表达,S100A4蛋白呈阴性表达(图 3,见插页四)。
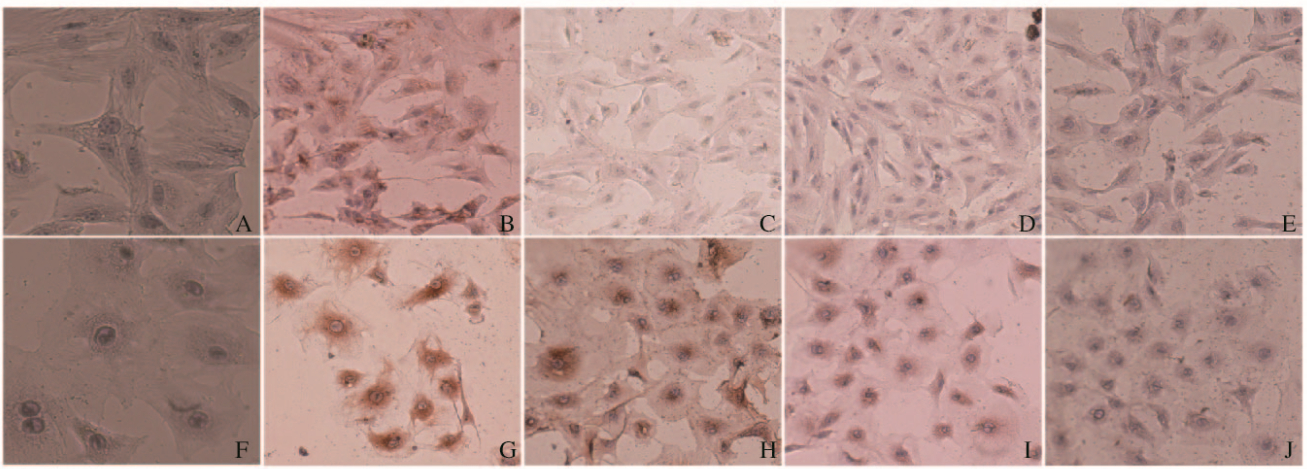
|
| A-E:Fibroblasts; F-J:Smooth muscle cells; A, F:Negative control; B, G:Vimentin; C, H:α-SMA; D, I:E-cadherin; E, J:S100A4. 图 3 大鼠结肠成纤维细胞和胸主动脉平滑肌细胞免疫组织化学染色结果(×100) Figure 3 Results of immunohistochemistry of colon fibroblasts and smooth muscle cells of thoracicaorta of rats(×100) |
|
|
肠纤维化是由于成纤维细胞异常增殖、ECM过度沉积导致,受多种细胞因子和信号通路调控。目前国内外多在动物体内进行研究,鲜有体外相关研究和报道。结肠位于消化道的末端,含有400多种细菌,构成复杂的微生态系统。体外培养成纤维细胞时为避免污染,截取组织后应立即放到含有青霉素和链霉素的培养基中冲洗。结肠由内向外分为黏膜层、黏膜下层、肌层和浆膜层。黏膜层分为上皮层、固有层和黏膜肌层[8],成纤维细胞定位于结肠黏膜固有层[9],需认真剥离其他组织才能获得成纤维细胞。
本研究结果显示:原代培养结肠成纤维细胞初期生长缓慢,第8天细胞开始游出组织块,第12天在显微镜下可观察到组织块周围有大量细胞,15~20d时已达到80%~90%融合状态,镜下观察细胞生长呈旋涡状或放射状。虽然黏膜层也含有上皮细胞和平滑肌细胞,但成纤维细胞贴壁能力强,故采用时间差胰酶消化法和反复贴壁法进行结肠成纤维细胞的分离[10]。本研究结果显示:结肠成纤维细胞对于0.25%胰蛋白酶的敏感度较弱,加入胰蛋白酶消化后,成纤维细胞收缩变圆过程较慢,需要1.5~2.0min才能消化完全。
本研究分别检测细胞中S100A4、Vimentin、α-SMA和E-cadherin的表达,并用大鼠胸主动脉平滑肌细胞进行对照来鉴定细胞种类。S100A4又称成纤维细胞特异性蛋白1(fibroblast specific protein1,FSP-1),是酸性的钙结合蛋白家族的成员,具有调控细胞运动、侵袭和增生的功能,与细胞分化、凋亡和基质降解有关[11-12]。但本研究结果显示:原代培养大鼠结肠成纤维细胞和平滑肌细胞中S100A4蛋白表达均呈阴性,故进一步采用Vimentin来鉴定细胞。Vimentin为Ⅲ型中间丝蛋白,主要表达于中胚层起源的间充质细胞中,在成纤维细胞中大量分布,可作为成纤维细胞的标记[13-14]。本研究结果显示:原代培养的细胞中Vimentin蛋白表达阳性,但平滑肌细胞中Vimentin蛋白表达也呈阳性,虽初步鉴定成纤维细胞但却无法与平滑肌细胞进行区分。α-SMA是细胞骨架的主要成分,是相对局限在平滑肌细胞中表达的少数基因之一,是公认的平滑肌细胞表型转化标志物[15-16]。本研究结果显示:原代培养的成纤维细胞中α-SMA蛋白不表达,而大鼠胸主动脉平滑肌细胞中α-SMA蛋白表达,说明培养的成纤维细胞中不含有平滑肌细胞。考虑成纤维细胞中还可能混有上皮细胞,故采用E-cadherin蛋白来区分,E-cadherin是钙黏蛋白家族中的一员,主要位于上皮组织中,是一种Ca2+依赖的、同亲型结合的细胞黏着糖蛋白,对胚胎发育的细胞识别、迁移、组织分化和组织器官构成具有重要作用[17-18]。E-cadherin可作为上皮来源细胞标志物,用来区别成纤维细胞与上皮细胞。本研究结果显示:原代培养细胞中E-cadherin蛋白表达阴性,说明培养的成纤维细胞中无上皮细胞。
虽然文献中报道S100A4是成纤维细胞的标记蛋白,但本实验原代培养的大鼠结肠成纤维细胞中S100A4表达呈阴性,考虑可能与种属和来源有关,也有文献[19]表明结肠腺癌细胞表达S100A4而正常结肠组织成纤维细胞不表达S100A4。
本研究采用胰酶联合差速组织块贴壁培养法这一原代培养技术成功培养出大鼠结肠成纤维细胞,经细胞传代验证,该细胞在15代内均表现出成纤维细胞的特性,超过15代后增殖速度下降。本研究中的培养方法简便易行,细胞纯度高,增殖速度快,为研究肠纤维化疾病的作用机制、临床治疗奠定了前期实验基础。
| [1] | 李辉, 魏民华, 张晓岚. IL-10家族在肠纤维化中作用的研究进展[J]. 吉林大学学报:医学版, 2017, 43(4): 849–851. |
| [2] | 李苁, 黄德强. TGF-β在炎症性肠病肠纤维化中的作用[J]. 实用临床医学, 2017, 18(5): 104–107. |
| [3] | 徐速. 三棱丸方对克罗恩病肠纤维化的影响及机制研究[D]. 南京: 南京中医药大学, 2017. |
| [4] | 安彩萍, 黄燕, 马晓芃, 等. 隔药灸对克罗恩病肠纤维化大鼠结肠成纤维细胞CTGF、FN、Smad表达的影响[J]. 上海针灸杂志, 2014, 33(6): 487–491. |
| [5] | 惠毅, 闫曙光, 王晓龙. 乌梅丸对溃疡性结肠炎大鼠结肠上皮细胞凋亡和Bcl-2/Bax蛋白表达的影响[J]. 中华中医药学刊, 2016, 34(1): 149–151. |
| [6] | 李如君, 龚开政, 张振刚. 成年小鼠心脏成纤维细胞的分离、纯化和原代培养[J]. 细胞与分子免疫学杂志, 2017, 33(1): 67–71. |
| [7] | 沈俊, 袁平, 唐俊明, 等. SD胚鼠心脏成纤维细胞的原代培养及鉴定[J]. 中国循证心血管医学杂志, 2016, 8(12): 1441–1444. DOI:10.3969/j.issn.1674-4055.2016.12.08 |
| [8] | 邹仲之, 李继承. 组织学与胚胎学[M]. 北京: 人民卫生出版社,2015: 141-156. |
| [9] | Speca S, Giusti I, Rieder F, et al. Cellular and molecular mechanisms of intestinal fibrosis[J]. World J Gastroenterol, 2012, 18(28): 3635–3661. DOI:10.3748/wjg.v18.i28.3635 |
| [10] | 李盼, 蔡红兵. 一种改良宫颈癌相关成纤维细胞原代培养方法的建立[J]. 武汉大学学报:医学版, 2017, 38(2): 193–197. |
| [11] | 查丁胜, 吴昊, 林宏生, 等. S100A4在类风湿关节炎滑膜中的表达及其对成纤维样滑膜细胞分泌VEGF促进血管生成的影响[J]. 中国病理生理杂志, 2017, 33(6): 1119–1124. |
| [12] | 江青山, 谭俞佳, 邓珊. S100A4真核表达载体构建及对鼻咽癌细胞侵袭转移的影响[J]. 中国现代医学杂志, 2016, 26(4): 5–10. |
| [13] | 陈卓, 方成. 波形蛋白在细胞内外的不同功能与相关病理[J]. 中国免疫学杂志, 2016, 32(3): 436–439. |
| [14] | 鲁召辉, 常玉巧, 郭志坤, 等. 新生大鼠多器官成纤维细胞nanog蛋白的表达差异[J]. 解剖学报, 2015, 46(4): 488–494. |
| [15] | 郝思雨, 田江天, 刘洋, 等. 小鼠主动脉平滑肌细胞的分离培养及鉴定[J]. 现代生物医学进展, 2016, 16(27): 5237–5240. |
| [16] | 刘姿麟, 林慕之, 况春燕, 等. 大鼠主动脉血管平滑肌细胞原代培养与鉴定[J]. 贵州医科大学学报, 2017, 42(2): 125–129. |
| [17] | 秦乐, 曾妍. E-cadherin缺失表达与结直肠癌患者预后相关性多元Cox回归分析[J]. 中国临床药理学杂志, 2017, 33(1): 7–9. |
| [18] | 文欢, 聂倩倩, 姜支农, 等. 原代结直肠癌相关成纤维细胞培养及特征分析[J]. 中华病理学杂志, 2015, 44(10): 719–724. |
| [19] | 赵玉泽, 王宏坤, 郑绘霞. S100A4基因在肿瘤研究中的进展[J]. 山西医药杂志, 2009, 38(8): 731–732. |
 2018, Vol. 44
2018, Vol. 44


