扩展功能
文章信息
- 张啸环, 段明华, 闫玉礼, 潘新, 李海清, 周长龙, 赵天倚
- ZHANG Xiaohuan, DUAN Minghua, YAN Yuli, PAN Xin, LI Haiqing, ZHOU Changlong, ZHAO Tanyi
- 人羊膜成纤维细胞的分离和鉴定
- Isolation and identification of human amnion fibroblasts
- 吉林大学学报(医学版), 2018, 44(04): 845-848
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 845-848
- 10.13481/j.1671-587x.20180429
-
文章历史
- 收稿日期: 2017-12-09
2. 空军航空大学, 吉林 长春 130022
2. University of Air Force, Changchun 130022, China
人羊膜是一种胎膜,分为人羊膜上皮层细胞[1]和人羊膜间充质基质细胞[2],其中人羊膜成纤维细胞属于间充质基质细胞。以干细胞为基础的临床医学日益受到关注,所以如何选择一种最适合临床细胞治疗的种子细胞,又不引起伦理争议、不致癌且安全性高,是医学工作者们努力的目标。
陈旭东等[3]对人羊膜上皮细胞体外诱导分化为神经样细胞进行了研究,诱导分化12 h后的细胞呈现双极、多极和锥形的典型神经元形态。研究[4-6]显示:在人羊膜上皮细胞原代培养及肝细胞特异性蛋白表达的研究中,人羊膜上皮细胞能表达肝细胞特异性蛋白,具有肝细胞的部分生物学特性。目前对人羊膜成纤维细胞诱导分化的研究较少,本实验分离人羊膜成纤维细胞,并进行培养和鉴别,旨在为人类胚胎干细胞性质和细胞诱导分化研究奠定基础,并为中药作用于细胞以及细胞的病变研究提供体外细胞培养模型。
1 材料与方法 1.1 主要试剂和仪器DMEM和胎牛血清(美国Gibco公司),表皮生长因子(epidermal growth factor, EGF)、胶原酶、Triton X-100、DNase酶、鼠抗人波形蛋白(Vimentin)抗体和鼠抗人S100钙结合蛋白A4(S100A4)抗体(美国Sigma公司),胰蛋白酶(美国Amreseo公司),鼠抗人角蛋白19(CK19)抗体和HRP/DAB检测试剂盒(美国Gene Tech公司),FSP-FITC单抗(上海研晶商贸有限公司)。Nikon Eclipse TS100荧光倒置显微成像系统(日本尼康仪器有限公司),流式细胞仪(美国BD公司),CO2细胞恒温培养箱(苏州江东精密仪器有限公司),高压灭菌锅(北京北瑞达医药科技有限公司)。
1.2 人羊膜成纤维细胞的获得① 羊膜组织来源于健康、择期剖宫产产妇的胎膜[7]。经产妇知情同意,用机械法剥取羊膜组织12份,用D-Hank’ s液冲洗,直至表面血迹冲洗干净,剪碎后存放于4℃含40 mg·L-1EGF的DMEM培养基中进行原代细胞消化处理。②将组织块放入50 mL含0.02%EDTA的0.1%的胰蛋白酶消化液中,37℃、100~150 r·min-1旋转消化30 min;弃去消化液,重复消化1次。③胰蛋白酶消化结束后,使用PBS溶液清洗3次,再将组织块放入50 mL含0.005%DNase酶的0.25%胶原酶消化液中,消化50 min,直至组织块完全消化为止[8]。④采用200目经过灭菌的尼龙纱布过滤胶原酶细胞消化液,收集滤液于无菌50 mL离心管中,2300 r·min-1离心10 min,弃去上清液,使用PBS溶液冲洗3次,终止胶原酶的消化,然后使用5 mL含40 mg·L-1EGF的DMEM培养基制成细胞悬液。⑤配制Percoll分离液,将5 mL细胞悬液缓慢添加到Percoll梯度液上层,2500 r·min-1离心20 min;离心后Percoll溶液形成3个明显的细胞带,将中部形成的细胞条带回收,使用培养液稀释后2300 r·min-1离心10 min,弃去上清液。⑥采用5 mL含40 mg·L-1EGF的DMEM培养液[9]悬浮细胞,应用细胞计数板进行计数, 使得细胞密度为(2~3)×105mL-1。
1.3 人羊膜成纤维细胞的培养在含40 mg·L-1EGF的DMEM培养基中加入10%胎牛血清。将细胞进行计数和稀释,使细胞密度为3.0×105mL-1。采用24孔细胞培养板,每孔放入盖玻片,加入2.0 mL细胞培养液,放置于5%CO2、37℃恒温培养箱中培养,进行细胞爬片。待细胞接近长满后,取出细胞爬片,进行免疫组织化学检测。
1.4 人羊膜成纤维细胞的鉴别① 人羊膜成纤维细胞形态表现观察:选取培养4、7和12 d的原代细胞。②人羊膜成纤维细胞HE染色:将取出的细胞爬片用PBS溶液冲洗3次。苏木素染色、稀盐酸乙醇分色、氨水返蓝细胞核、伊红染色、乙醇梯度脱水和二甲苯透明处理,固定于载玻片上,显微镜下观察。③人羊膜成纤维细胞免疫组织化学鉴别:将取出的细胞爬片用PBS溶液洗涤3次,4%多聚甲醛固定10 min。PBS溶液洗涤3次,用0.3%Triton-X100室温下作用15~20 min,PBS溶液洗涤3次。3%H2O2室温孵育15 min,用含1%BSA的PBS室温下封闭30 min,PBS溶液洗涤3次,每次5 min。分别加入一抗(PBS、鼠抗人Vimentin抗体、S100A4抗体和CK19抗体),37℃孵育30 min,PBS溶液洗涤3次,每次5 min。加入二抗,37℃孵育30 min,PBS溶液洗涤3次,每次5 min,DAB室温显色30 min。90%甘油封片,显微镜下观察。④人羊膜成纤维细胞生长曲线:以第3代细胞为测试样品,用培养基调整细胞密度为1.0×105mL-1,接种于2个24孔培养板,每孔0.5 mL,于5%CO2、37℃恒温培养箱中培养,每24h换液1次。每天选取3个孔,用含0.02%EDTA的0.25%胰蛋白酶消化后进行细胞计数,每孔重复计数3次,取平均值。连续计数10d,绘制生长曲线。
1.5 人纤维母细胞表面抗原(FSP)-FITC单抗标记法测定人羊膜成纤维细胞纯度① 阴性对照细胞和人羊膜成纤维细胞样品制备:人羊膜成纤维细胞表面特异性抗原为FSP,选择的阴性对照细胞为小鼠肝脏原代细胞,其细胞表面不含FSP。将2种细胞分别传代至第3代时,进行消化,将细胞密度稀释至1.0×106mL-1,取1 mL细胞悬液,离心去上清。针对FSP分别加入FSP-FITC单抗20 μL,充分混匀,室温避光孵育20 min,2 000 r·min-1离心5 min,弃去上清,用PBS溶液洗涤2次,分别加入PBS溶液0.5 mL,成为阴性对照细胞样品和人羊膜成纤维细胞样品,待测。②流式细胞术检测:光源为488 nm氩离子激光器,FITC受激发后发绿色荧光,上机后收集1×105个细胞,以前向散射光(FSC)/侧向散射光(SSC)二维散射光图确定阴性对照细胞和人羊膜成纤维细胞。
2 结果 2.1 人羊膜成纤维细胞形态表现荧光倒置显微镜下观察:人羊膜经含DNase酶的胶原酶溶液消化后收集细胞,24h后大部分贴壁,贴壁2d后细胞从爬片爬出(图 1A,见插页四);5d后细胞生长迅速,增殖明显,细胞数量明显增多(图 1B,见插页四);8d后可见细胞呈梭形、星形和多角形等多种形态,呈放射状或旋涡状分布,可见成纤维样细胞克隆(图 1C,见插页四)。
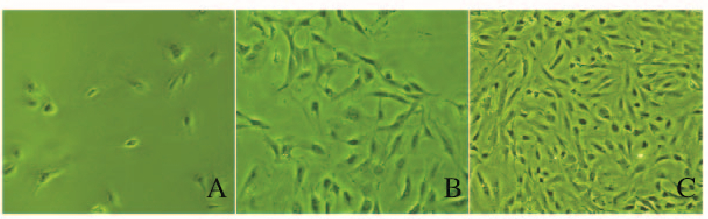
|
| A:2 d; B:5 d; C:8 d. 图 1 不同时期人羊膜成纤维细胞形态表现(×40) Figure 1 Morphology of human amnion fibroblasts at different stages(×40) |
|
|
显微镜下观察:HE染色后成纤维细胞体积较大且突起较多,细胞核被碱性的苏木素染成紫蓝色[10],细胞质被酸性染料伊红染成红色。见图 2(插页四)。
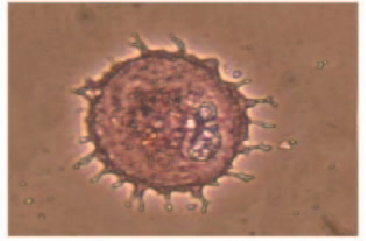
|
| 图 2 人羊膜成纤维细胞HE染色结果(×200) Figure 2 Results of HE staining of human amnion fibroblasts(×200) |
|
|
显微镜下观察:PBS对照组染色呈阴性,表明实验无假阳性现象;人羊膜成纤维细胞中Vimentin蛋白表达阳性,S100A4蛋白表达阳性,CK19蛋白表达阴性。见图 3(插页四)。
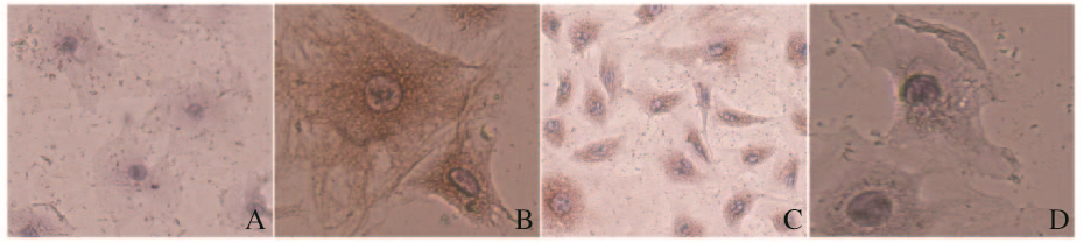
|
| A:Negative control; B:Vimentin; C:S100A4;D:CK19. 图 3 人羊膜成纤维细胞免疫组织化学染色结果(×100) Figure 3 Results of immunohistochemical staining of human amnion fibroblasts(×100) |
|
|
从细胞生长曲线可以看出,接种后1~2 d为细胞生长的潜伏期,也是细胞的贴壁阶段;接种后3~5 d为细胞的对数生长期,细胞增殖活跃,呈指数级递增;第6天后为细胞生长的平台期,细胞增殖速度变慢,趋于平稳。见图 4。
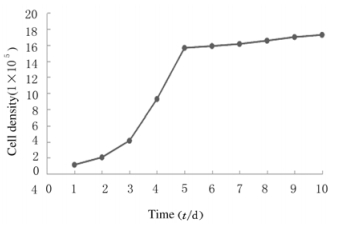
|
| 图 4 人羊膜成纤维细胞生长曲线 Figure 4 Growth curve of human amnion fibroblasts |
|
|
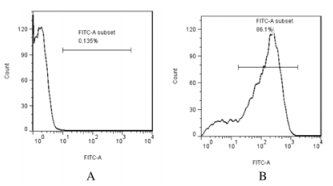
阴性细胞对照图中,细胞主要分布在第四象限,第二象限阳性细胞数量占0.135%,证明该检测方法准确可行(图 5A)。人羊膜成纤维细胞主要分布在第二象限,为阳性细胞,数量占86.1%。表明分离得到的人羊膜成纤维细胞纯度较高,准确度好(图 5B)。
|
| A:Control group; B:Human amnion fibroblasts. 图 5 流式细胞术检测人羊膜成纤维细胞纯度 Figure 5 Purity of human amnion fibroblasts detected by FCM |
|
|
人羊膜细胞为异质性细胞群,主要由人羊膜上皮细胞和成纤维细胞组成。目前尚未建立分离人羊膜成纤维细胞的标准化流程[11]。对人羊膜细胞的研究多采用单纯胰蛋白酶或胶原酶消化和组织块培养法获得人羊膜细胞,但是通过胰蛋白酶消化的细胞绝大多数为羊膜上皮细胞。通过胰蛋白酶和胶原酶的先后消化进行初步分离,胶原酶对纤维细胞有较强的消化作用,可获得人羊膜成纤维细胞。在胶原酶进行消化时,加入DNase酶,能够破坏细胞与细胞之间的连接,降低滤液黏度[12],更容易获得单个分散的、活力好的人羊膜成纤维细胞,这样的细胞更容易贴壁生长。EGF存在于人体多种组织中,具有促进角化细胞、成纤维细胞和平滑肌细胞等细胞生长的作用,并可促进成纤维细胞产生胶原蛋白[13],所以对人羊膜成纤维细胞的增殖可起到促进作用。加入EGF的原代细胞比较容易贴壁,培养至3~5 d呈指数级增殖,第6天细胞增殖开始变慢,因此人羊膜成纤维细胞的传代时间以培养4~5 d为宜。以PBS代替一抗,经与细胞免疫组织化学同步染色后未见有阳性结果,所以排除假阳性的存在。Vimentin为Ⅲ型中间丝蛋白,主要表达于中胚层起源的间充质细胞中,在成纤维细胞内大量分布,可作为成纤维细胞的标记[14]。S100A4是钙结合蛋白S100家族成员,其蛋白阳性表达部位主要定位于细胞质中,少数定位于细胞核。CK19为上皮细胞标记蛋白[15],在人羊膜成纤维细胞分离过程中,可能会掺杂部分人羊膜上皮细胞,所以CK19的阴性表达表明人羊膜成纤维细胞分离效果好,纯度高。流式细胞术是对悬液中的单细胞或其他生物粒子, 通过检测标记的荧光信号[16],实现高速、逐一的细胞定量分析和分选的技术。
本研究采用胰蛋白酶和胶原酶先后消化获得了人羊膜成纤维细胞,显微镜下观察细胞呈放射状或旋涡状生长,人羊膜成纤维细胞明显表达成纤维细胞标志物Vimentin,不同程度地表达S100A4,不表达上皮细胞标志物CK19,采用流式细胞术分析人羊膜成纤维细胞的纯度为86.1%。本研究成功建立了人羊膜成纤维细胞分离和鉴定方法,为今后的干细胞研究奠定了基础。
| [1] | 金玲, 陈剑, 吴静, 等. 人羊膜上皮细胞的分离、纯化及其生物学特性研究[J]. 广东医学, 2010, 31(16): 2055–2057. DOI:10.3969/j.issn.1001-9448.2010.16.003 |
| [2] | 河清义, 陈秉礼, 王智彪, 等. 人羊膜细胞外基质和成纤维细胞体外培养的实验研究[J]. 中华整形外科杂志, 2002, 4: 56–59. DOI:10.3760/j.issn:1009-4598.2002.01.020 |
| [3] | 陈旭东, 刘红敏, 华新宇, 等. 人羊膜上皮细胞体外诱导分化为神经样细胞的研究[J]. 实用医学杂志, 2011, 8: 49–51. DOI:10.3969/j.issn.1006-5725.20101.1.021 |
| [4] | 许姗姗, 顾学范. 人羊膜上皮细胞原代培养及肝细胞特异性蛋白的表达[J]. 上海交通大学学报:医学版, 2009, 29(3): 303–306. |
| [5] | 王慧, 王飞, 白莉平, 等. 人羊膜上皮细胞向卵泡样结构转分化的实验研究[J]. 四川大学学报:医学版, 2017, 4: 58–60. |
| [6] | 张丹英, 许正平, 姜槐, 等. 手机射频电磁场对人羊膜成纤维细胞DNA损伤的研究[A]. 第六届全国环境与职业医学研究生学会研讨会(论文集)[C]. 杭州: 浙江大学, 2007. |
| [7] | 方宁, 宋秀军, 张路, 等. 人羊膜上皮细胞的分离、培养与鉴定[J]. 遵义医学院学报, 2009, 32(2): 121–124. |
| [8] | 金玲, 陈剑, 吴静, 等. 大鼠羊膜上皮细胞体外培养的初步研究[J]. 中国病理生理杂志, 2006, 22(5): 1036–1038. |
| [9] | 金玲, 陈剑, 吴静, 等. 兔羊膜上皮细胞的体外培养和增殖[J]. 细胞生物学杂志, 2008, 30(3): 397–400. |
| [10] | Gu oC, Wang W, Liu C, et al. Induction of PGF2α synthesis by cortisol through GR dependent induction of CBR1 in human amnion fibroblasts[J]. Endocrinology, 2014, 155(8): 3017–3024. DOI:10.1210/en.2013-1848 |
| [11] | Guo CM, Kasaraneni N, Sun K, et al. Cross talk between PKC and CREB in the induction of COX-2 by PGF2α in human amnion fibroblasts[J]. Endocrinology, 2012, 153(10): 4938–4945. DOI:10.1210/en.2012-1441 |
| [12] | Mogami H, Keller PW, Shi H, et al. Effect of thrombin on human amnion mesenchymal cells, mouse fetal membranes, and preterm birth[J]. J Biol Chem, 2014, 289(19): 13295–13307. DOI:10.1074/jbc.M114.550541 |
| [13] | El Ghalbzouri A, Lamme E, Ponce M. Crucial role of fibroblasts in regulating epidermal morphogenesis[J]. Cell Tissue Res, 2002, 310(2): 189–199. DOI:10.1007/s00441-002-0621-0 |
| [14] | Wang W, Guo C, Li W, et al. Involvement of GR and p300 in the induction of H6PD by cortisol in human amnion fibroblasts[J]. Endocrinology, 2012, 153(12): 5993–6002. DOI:10.1210/en.2012-1531 |
| [15] | Lorenzi T, Turi A, Crescimanno C, et al. Syndecan expressions in the human amnion and chorionic plate[J]. Eur J Histochem, 2010, 54(4): e42. DOI:10.4081/ejh.2010.e42 |
| [16] | 郑骏年, 黄健, 谢叔良. 流式细胞双标记技术定量检测淋巴细胞亚群凋亡[J]. 徐州医学院学报, 2001, 21(3): 205–208. |
 2018, Vol. 44
2018, Vol. 44


