扩展功能
文章信息
- 刘洋, 刘艳, 刘宸辛, 冯志桐, 姜丹
- LIU Yang, LIU Yan, LIU Chenxin, FENG Zhitong, JIANG Dan
- 荧光偏振免疫分析法在小分子药物小鼠血药浓度检测中的应用
- Application of fluorescence polarization immunoassay in determination of small molecular drug concentrations in plasma of mice
- 吉林大学学报(医学版), 2018, 44(04): 833-838
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 833-838
- 10.13481/j.1671-587x.20180427
-
文章历史
- 收稿日期: 2017-10-16
小鼠是药物和疾病模型中常用的模式生物,对小鼠给药后的血药浓度准确监测是药理和药剂学研究中必须解决的技术难题之一。目前在药理和药剂学研究中对小分子药物血药浓度的检测方法主要是高效液相色谱法(HPLC法)。虽然该检测方法的特异性、灵敏度和重复性均很好,但所用仪器昂贵、检验成本高、检验时间过长(约3 h),严重限制了其在快速化、高通量检测等实验设计中的应用。且当血药浓度处于高浓度(>90 mg·L-1)时,柱前衍生化程度存在饱和状态,测定数据存在一定偏差[1-3]。因此,急需开发快速、高通量、灵敏和准确的血药浓度检测手段。荧光偏振免疫技术(fluorescence polarization immunoassay, FPIA)利用荧光偏振原理,采用竞争结合法机制,常用来监测小分子物质如药物和激素在样本中的含量[4]。与HPLC法和质谱法比较,FPIA法在测定小分子溶液在液相介质中的浓度方面具有样本量少、成本低、检测速度快和高通量等优点[5-7]。本研究将从药品检出限、线性检测范围、质控分析、日间精密度和杂质干扰等多个方面探讨FPIA技术在3种常见的小分子药物(庆大霉素、地高辛和丙戊酸钠)小鼠血药浓度检测中的应用效果,为FPIA法在药理研究中的广泛应用提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器30只8周龄KM小鼠(雌性,合格证号:211002300022655),购于吉林省长春市亿斯实验动物有限公司。庆大霉素荧光偏振免疫分析试剂盒(77404)、地高辛荧光偏振免疫分析试剂盒(86859)和丙戊酸钠荧光偏振免疫分析试剂盒(67439)(美国雅培制药有限公司),庆大霉素标准品(130326-200314)、地高辛标准品(100015-200709)和丙戊酸钠标准品(100963-201101)(中国药品生物制品检定所)。多功能酶标仪(Synergy2,美国伯腾仪器有限公司)。
1.2 FPIA法检测药物浓度的检出限和标准曲线配制0、1、5、10、20、50、100、200、500、1 000、2 000、5 000和10 000 μg·L-1药物标准品浓度梯度,测定荧光偏振(FP)值并做非线性回归分析。以0 μg·L-1样本的FP值为IC0, 以10 000 μg·L-1样本的FP值为IC100,计算庆大霉素、地高辛和丙戊酸钠在当前检测条件下的检出限(IC10)及FP值的线性变化范围(IC20~IC80)[8]。
在线性范围内选取12个线性浓度梯度位点(庆大霉素50~390 μg·L-1,地高辛80~520 μg·L-1,丙戊酸钠18~128 μg·L-1),配置标准品浓度梯度溶液,测定FP值并绘制标准曲线。对所绘制的标准曲线进行线性回归分析,以r2值作为标准曲线质量的评价标准。
1.3 FPIA法检测药物浓度的质控分析对每种待测药品设置3组质控液,分别为高浓度组、中浓度组和低浓度组,每组质控液包含6个质控样本,每组质控样本的平均药物浓度已知。采用FPIA法分别测定各质控组样本的偏振光强度,代入标准曲线计算相应的药物浓度和每组质控组的平均浓度。将FPIA法测定得出的质控组平均浓度与已知的平均浓度进行比较,误差百分比(ER) < 5%为合格标准。
1.4 FPIA法检测药物浓度的日间精密度分析3组质控液中各取1个质控样本,连续20 d每天用FPIA法测定1次样本血药浓度。计算20 d所测数据的平均值、标准偏差(SD)和变异系数(CV),以此评价该检测方案的日间精密度。以CV < 8%为合格标准。
1.5 FPIA法检测小鼠血药浓度的准确度分析小鼠摘眼球取血,4 000 r·min-1离心5 min收集血清。在3种药品的中浓度组质控液中分别添加不同体积浓度(5%、20%和50%)小鼠血清,血清加入后FPIA法检测药物浓度的偏差值。以偏差值< 10%为合格标准。
1.6 FPIA法检测小鼠血药浓度30只小鼠分为3组,每组10只,采用3种药物分别对每组小鼠进行一次性给药操作,其中庆大霉素肌肉注射5 μg·g-1,地高辛灌胃20 ng·g-1,丙戊酸钠灌胃15 μg·g-1。在给药后1、3、6、12和24 h对小鼠进行眼眶取血(取血量约0.1 mL),血液样本用超纯水稀释50~100倍后用于FP值测定,结果代入标准曲线计算血药浓度。
2 结果 2.1 药物浓度的检出限和标准曲线待测药品在0~10 000 μg·L-1范围内的FP值变化曲线见图 1。数据点经非线性拟合处理后,IC10和IC20~IC80测定结果见表 1。3种药物的检出限均在50 μg·L-1以下,线性范围较宽(大于10倍检出限),在当前检测环境下可对3种药品进行标准曲线的绘制和浓度测定。
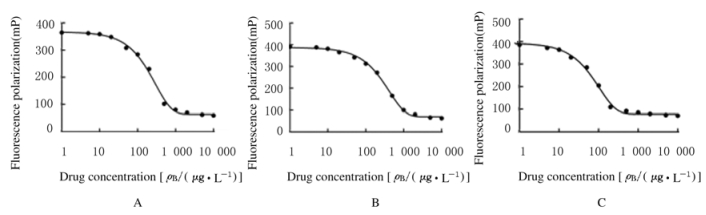
|
| A:Gentamycin; B: Digoxin; C: Sodium valproate. 图 1 FPIA法检测3种药品FP值非线性拟合曲线 Figure 1 Non-linear fitting curves of FP values of three drugs detected by FPIA |
|
|
| [ρB/(μg·L-1)] | ||
| Drug | Detection limit (IC10) |
Linear range (IC20-IC80) |
| Digoxin | 36 | 60-595 |
| Gentamycin | 22 | 38-445 |
| Sodium valproate | 8 | 15-145 |
在线性范围内选取12个线性浓度梯度位点,配置标准品浓度梯度溶液,测定FP值并绘制标准曲线(图 2),3种药品的标准曲线质量均较好,线性回归的r2值均在0.99以上,可以用于浓度测定。
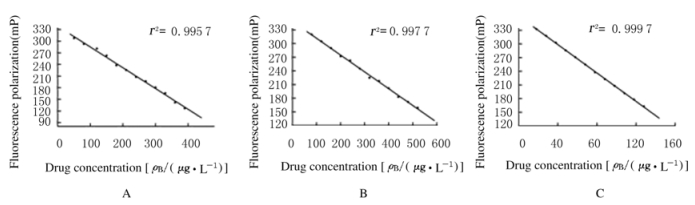
|
| A:Gentamycin; B: Digoxin; C:Sodium valproate. 图 2 FPIA法检测3种药品的标准曲线 Figure 2 Standard curves of three drugs detected by FPIA |
|
|
用FPIA法检测3组质控液的6个样本后计算平均值和ER,见表 2。3种药品在不同浓度质控液中的检测准确度均符合要求,ER均在5%以下。对同一待测样本进行连续20 d的日间精密度分析,在低浓度条件下FPIA法检测的日间精密度较差,3种药品的检测CV均大于8%,还需进一步优化检测条件以达到日间精密度标准。在中浓度和高浓度条件下,FPIA法检测的日间精密度符合标准,3种药品的检测CV均小于5%。见表 3。
| Drug | Concentration level |
Actual average concentration [ρB/(μg·L-1)] |
Measured average concentration [ρB/(μg·L-1)] |
Error rate (η/%) |
| Getamycin | Low | 50 | 48.11 | -3.78 |
| Medium | 180 | 186.92 | 3.84 | |
| High | 400 | 413.62 | 3.41 | |
| Digoxin | Low | 85 | 86.94 | 2.28 |
| Medium | 260 | 255.16 | -1.86 | |
| High | 490 | 508.77 | 3.83 | |
| Sodium valproate | Low | 18 | 18.55 | 3.06 |
| Medium | 50 | 51.97 | 3.94 | |
| High | 120 | 116.29 | -3.09 |
| Drug | Concentration level |
Sample concentration [ρB/(μg·L-1)] |
Inter-day average measured concentration [ρB/(μg·L-1)] |
Standard deviation [ρB/(μg·L-1)] |
Coefficient of variation (η/%) |
| Getamycin | Low | 50 | 48.29 | ±4.46 | 9.23 |
| Mediate | 180 | 185.97 | ±6.92 | 3.72 | |
| High | 400 | 392.31 | ±11.34 | 2.89 | |
| Digoxin | Low | 85 | 86.62 | ±7.94 | 9.17 |
| Mediate | 260 | 265.33 | ±11.39 | 4.29 | |
| High | 490 | 478.59 | ±19.81 | 4.14 | |
| Sodium valproate | Low | 18 | 17.66 | ±1.81 | 10.25 |
| Mediate | 50 | 52.03 | ±3.99 | 7.67 | |
| High | 120 | 125.16 | ±6.52 | 5.21 |
在中浓度质控液中加入不同体积浓度小鼠血清后,FPIA法检测的准确度见表 4。小鼠血清的存在对庆大霉素和地高辛的FPIA检测效果无明显影响,其ER在5%以内且无明显的血清浓度依赖性。在对丙戊酸钠的检测中,小鼠血清对FP值有明显的负向影响,尤其是在高浓度血清存在时(50%血清)检测误差明显升高,ER在10%以上,因此在检测小鼠丙戊酸钠血药浓度时应重新优化抗体的选择和检测条件,或者对血液样本做稀释处理以控制血清对检测准确度的影响。
| Drug | Serum ratio (η/%) |
Actual average concentration [ρB/(μg·L-1)] |
Measured average concentration [ρB/(μg·L-1)] |
Error rate (η/%) |
| Getamycin | 5 | 180 | 184.68 | 2.60 |
| 20 | 180 | 177.11 | -1.61 | |
| 50 | 180 | 178.26 | -0.97 | |
| Digoxin | 5 | 260 | 255.17 | -1.86 |
| 20 | 260 | 268.91 | 3.43 | |
| 50 | 260 | 268.24 | 3.17 | |
| Sodium valproate | 5 | 50 | 47.16 | -5.68 |
| 20 | 50 | 47.22 | -5.56 | |
| 50 | 50 | 43.58 | -12.84 |
根据3种药物在相关疾病治疗中的建议给药量及代谢特性,设计了FPIA法检测小鼠血药浓度测试的给药量及采血时间点。小鼠血液样本经稀释后测定血药浓度。庆大霉素的血药浓度峰值出现在给药后1 h左右,药物半消期在3 h左右;地高辛的血药浓度峰值出现在给药后1 h左右,药物半消期在24 h以上;丙戊酸钠的血药浓度峰值出现在给药后3 h左右,药物半消期在6~12 h。见表 5。
| [ρB/(μg·L-1)] | |||
| Time (t/h) |
Plasma concentration | ||
| Getamycin | Digoxin | Sodium valproate | |
| 1 | 19 800 | 24.8 | 88 400 |
| 3 | 9 600 | 21.4 | 97 200 |
| 6 | 5 100 | 17.9 | 70 100 |
| 12 | 3 300 | 15.1 | 46 600 |
| 24 | 2 500 | 17.1 | 29 800 |
FPIA技术在小分子物质检测方面具有广泛的应用空间[9-12]。以药物检测为例,以荧光素标记的药物和含待测药物的样本为抗原,与一定量的抗体进行竞争性结合。荧光标记的药物在环境中旋转时,偏振荧光的强度与其受激发时分子转动的速度成反比。大分子物质旋转慢,发出的偏振荧光强;小分子物质旋转快,其偏振荧光弱(去偏振现象)[13-15]。因此,在竞争性结合过程中,样本中待测药物越多,与抗体结合的标志抗原就越少,抗原抗体复合物体积越大,旋转速率越慢,从而激发的FP值越低[16]。当确定了已知浓度的标记抗原与FP值的关系后,就可以测量未知浓度的物质。因此,FPIA法可用来检测环境或食品样品中有毒物质如农药的残留量[17-19]。此外,临床医学诊断也广泛采用FPIA法[20-21]。FPIA法除可测定人体体液样本中某一特定物质的水平外,也可直接应用于临床诊断。Cercek等[22]对恶性肿瘤诊断方法的研究显示:进入淋巴细胞的荧光物质,受胞浆浓度有序性的干扰,其运动方向和速率会发生变化。胞浆黏度高时,荧光物质运动变慢,受偏振光激发产生的激发光与胞浆黏度低时产生的激发光性质不同。通过追踪测定激发的偏振光性质,即可了解淋巴细胞的胞浆流动性和黏度等环境的变化,结合其他辅助诊断方法,可有助于癌症的早期诊断[22-23]。利用FPIA法还可检测患者样本中病毒DNA如HBV、HPV的复制量,为临床诊断提供有力的量化指标。本文作者探讨FPIA法在小鼠血药浓度检测中的应用效果,测定了FPIA法检测血药浓度的线性范围和标准曲线,并对检测的准确度和稳定性进行了全面的考察。本研究建立和优化的3种药品的FPIA法血药浓度检测方案在小鼠给药实验中能够准确、有效地监测药物代谢变化,具有样本需求量少、无预处理、检测快速和高通量等优点。采用FPIA法检测得到的3种药物代谢数据与已知报道[24-26]相符。该方案的建立为今后FPIA法在药理实验和临床检测中的应用奠定了基础。
| [1] | 毛凯, 马晓娟, 张斌, 等. 反相高效液相色谱法测定叶黄素血药浓度及其大鼠灌胃药动学评价[J]. 中国医院药学杂志, 2018, 38(1): 22–25. |
| [2] | 贾永娟, 赵俊平, 金燕, 等. 在线固相萃取-高效液相色谱法测定血清中的茶碱[DB/OL]. 中国医院药学杂志, 2018, 38(3): 258-261. |
| [3] | 贾离离, 祁志红, 彭立军, 等. 超高效液相色谱仪器检出限计算方法的比较分析[J]. 现代食品科技, 2018, 34(2): 212–217, 240. |
| [4] | Nielsen K, Lin M, Gall D, et al. Fluorescence polarization immunoassay:detection of antibody to Brucella abortus[J]. Methods, 2000, 22(1): 71–76. DOI:10.1006/meth.2000.1038 |
| [5] | Mei S, Zhu L, Li X, et al. UPLC-MS/MS analysis of methotrexate in human plasma and comparison with the fluorescence polarization immunoassay[J]. Anal Sci, 2017, 33(6): 665–670. DOI:10.2116/analsci.33.665 |
| [6] | Choi JW, Kim GJ, Lee S, et al. A droplet-based fluorescence polarization immunoassay (dFPIA) platform for rapid and quantitative analysis of biomarkers[J]. Biosens Bioelectron, 2015, 67(3): 497–502. |
| [7] | Tachi T, Hase T, Okamoto Y, et al. A clinical trial for therapeutic drug monitoring using microchip-based fluorescence polarization immunoassay[J]. Anal Bioanal Chem, 2011, 401(7): 2301–2305. DOI:10.1007/s00216-011-5304-9 |
| [8] | 沈玉栋, 张世伟, 蔡肇婷, 等. 呋喃西林代谢物荧光偏振免疫检测方法研究[J]. 分析测试学报, 2009, 28(1): 27–31, 36. |
| [9] | Wakao O, Satou K, Nakamura A, et al. A compact fluorescence polarization analyzer with high-transmittance liquid crystal layer[J]. Rev Sci Instrum, 2018, 89(2): 024103. DOI:10.1063/1.5017081 |
| [10] | Banco MT, Mishra V, Greeley SC, et al. Direct detection of products from S-adenosylmethionine-dependent enzymes using a competitive fluorescence polarization assay[J]. Anal Chem, 2018, 90(3): 1740–1747. DOI:10.1021/acs.analchem.7b03556 |
| [11] | Zhang H, Yang S, Beier RC, et al. Simple, high efficiency detection of microcystins and nodularin-R in water by fluorescence polarization immunoassay[J]. Anal Chim Acta, 2017, 992: 119–127. DOI:10.1016/j.aca.2017.09.010 |
| [12] | Lippolis V, Porricelli ACR, Cortese M, et al. Determination of ochratoxin A in rye and rye-based products by fluorescence polarization immunoassay[J]. Toxins (Basel), 2018, 9(10): E305. |
| [13] | Jameson DM, Croney JC. Fluorescence polarization:past, present and future[J]. Comb Chem High Throughput Screen, 2003, 6(3): 167–173. DOI:10.2174/138620703106298347 |
| [14] | Huang X, Aulabaugh A. Application of fluorescence polarization in HTS assays[J]. Methods Mol Biol, 2016, 1439: 115–130. DOI:10.1007/978-1-4939-3673-1 |
| [15] | Ueda H, Dong J. From fluorescence polarization to Quenchbody:Recent progress in fluorescent reagentless biosensors based on antibody and other binding proteins[J]. Biochim Biophys Acta, 2014, 1844(11): 1951–1959. DOI:10.1016/j.bbapap.2014.06.005 |
| [16] | Popelka SR, Miller DM, Holen JT, et al. Fluorescence polarization immunoassay.Ⅱ.Analyzer for rapid, precise measurement of fluorescence polarization with use of disposable cuvettes[J]. Clin Chem, 1981, 27(7): 1198–1201. |
| [17] | Eremin SA, Smith DS. Fluorescence polarization immunoassays for pesticides[J]. Comb Chem High Throughput Screen, 2003, 6(3): 257–266. DOI:10.2174/138620703106298301 |
| [18] | Maragos C. Fluorescence polarization immunoassay of mycotoxins:a review[J]. Toxins (Basel), 2009, 1(2): 196–207. DOI:10.3390/toxins1020196 |
| [19] | 杨晓涵, 徐国杰, 张欣悦, 等. 基于荧光偏振免疫分析技术检测药茶中的黄曲霉素[J]. 药学学报, 2017, 52(4): 620–624. |
| [20] | 徐星洁. 荧光偏振免疫分析技术在临床治疗药物监测中的应用[J]. 海峡药学, 2017, 29(4): 231–232. |
| [21] | Mei S, Zhu L, Li X, et al. UPLC-MS/MS analysis of methotrexate in human plasma and comparison with the fluorescence polarization immunoassay[J]. Anal Sci, 2017, 33(6): 665–670. DOI:10.2116/analsci.33.665 |
| [22] | Cercek L, Cercek B. Apparent tumour specificity with the SCM test[J]. Br J Cancer, 1975, 31(2): 252–253. DOI:10.1038/bjc.1975.33 |
| [23] | Zhu MR, Du DH, Hu JC, et al. Development of a high-throughput fluorescence polarization assay for the discovery of EZH2-EED interaction inhibitors[J]. Acta Pharmacol Sin, 2018, 39(2): 302–310. DOI:10.1038/aps.2017.59 |
| [24] | 任兆钧. 庆大霉素及复方庆大霉素在小猪体内的药物代谢动力学研究[J]. 畜牧兽医学报, 1986, 17(1): 23–29. |
| [25] | 周晓洁, 王毅. 血清地高辛浓度测定44例分析[J]. 温州医学院学报, 1996, 26(3): 180–181. |
| [26] | 杜娟, 左非非, 魏双艳, 等. 山楂降脂胶囊中4种黄酮含量的测定[J]. 郑州大学学报:医学版, 2017, 52(4): 456–459. |
 2018, Vol. 44
2018, Vol. 44


